“金属及其化合物”中的不一定
陈春梅

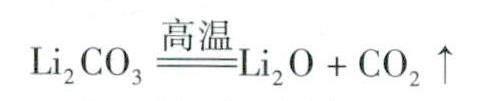

一、有关碱金属元素及其化合物的“不一定”
1.堿金属单质不一定可保存在煤油中。碱金属单质一般可保存在煤油中,但由于金属锂的密度(0. 53 g/cm3)比煤油的密度(0.80 g/cm3)小,因而金属锂不能保存在煤油中,只能保存在液态石蜡中。
2.在加热条件下,碱金属单质与氧气反应不一定能生成过氧化物或超氧化物。如Li与O2反应只能生成氧化物(Li2O)。
3.碱金属元素在化合物中不一定显+1价。碱金属元素在化合物中一般显+1价,但锂元素有+3价化合物(如Li2O3)。
4.碱金属元素的最高价氧化物对应的水化物受热不一定不能分解。如LiOH受热易分解:
5.碱金属元素的碳酸盐(正盐)在高温下受热不一定不能分解。如Li2CO3在高温下能够分解:
6.碱金属元素的氟化物不一定易溶于水。碱金属元素氟化物一般易溶于水,但LiF难溶于水。
7.碱金属元素的碳酸盐(正盐)不一定易溶于水。如Li2CO3难溶于水。
8.碱金属元素的磷酸盐(正盐)不一定易溶于水。如Li3PO4难溶于水。
9.随着核电荷数的递增,碱金属单质的密度不一定逐渐增大。如钾的密度(0. 862 g/cm3)比钠的密度(0. 971 g/cm3)小。
10.碱金属元素碳酸氢盐的溶解度不一定大于碳酸盐(正盐)。如NaHCO3的溶解度(20℃为9.6 g)比Na2CO3的溶解度(20℃为21.5g)小。
11.从试剂瓶中取出后剩余的药品不一定不允许放回原试剂瓶。从试剂瓶中取出后剩余的药品一般不允许放回原试剂瓶,但从试剂瓶中取出后剩余的Na和K要立即放回原试剂瓶。
12.在金属活动性顺序中,位于前面的金属不一定能把后面的金属从其盐溶液中置换出来。如Na、K等活泼金属不能把后面的金属从其盐溶液中置换m来,因为Na、K非常活泼,Na、K与盐溶液反应时首先与水反应生成碱和氢气,然后生成的碱可能与盐发生复分解反应。
13.碱金属元素的单质不一定只能在氧气(或氯气)中燃烧。碱金属单质不仅能在氧气(或氯气)中燃烧,还能在二氧化碳和氮气中燃烧。如:
14.碱金属的酸式盐溶液不一定显酸性。NaHSO4、KHSO4溶液均显酸性(因HSO-4能够电离出H+); NaH2PO4、KH2PO4、NaHSO3、KHSO3、NaHC2O4、KHC2O4溶液均显酸性(因其酸式酸根离子的电离程度大于水解程度);但Na2HPO4、K2HPO4、NaHS、KHS、NaHCO3、KHCO3溶液均显碱性(因其酸式酸根离子的水解程度大于电离程度)。
二、有关第ⅡA族元素(碱土金属元素)及其化合物的“不一定”
1.第ⅡA族元素的氧化物不一定是离子化合物。如BeO是共价化合物。
2.第ⅡA族元素的氯化物不一定是离子化合物。如BeCl2是共价化合物。
3.第ⅡA族元素的氧化物不一定是碱性氧化物。如BeO是两性氧化物。
4.第ⅡA族元素的最高价氧化物对应的水化物不一定不能与碱反应。如Be(OH)2是两性氢氧化物,能与NaOH等强碱溶液反应生成盐和水:
Be(OH)2 +2NaOH =Na2BeO2 +2H2O
5.第ⅡA族元素的单质不一定只能在氧气(或氯气)中燃烧。第ⅡA族元素的单质不仅能在氧气(或氯气)中燃烧,而且也能在二氧化碳和氮气中燃烧生。如:

