基于PS 信号放大策略的SERS 适配体传感器灵敏检测恩诺沙星
李岑,王盼雪*,王丽,刘莹,邢招娣,李国梁
(1.陕西科技大学食品科学与工程学院,陕西西安 710021;2.谱尼测试集团陕西有限公司,陕西西安 710018)
恩诺沙星是一种人工合成的氟喹诺酮类抗生素,通过抑制细菌DNA 回旋酶的活性,干扰DNA 双链解聚、分割和整合来抑制细菌的增殖[1]。恩诺沙星在养殖业中应用广泛,主要通过体外注射[2]、饲料投喂[3]和环境投放[4]等方式用于治疗或预防动物疾病。然而,恩诺沙星在养殖业中的误用和滥用,导致其在动物源食品中的残留量超标[5]。研究表明,人体长期摄入恩诺沙星残留超标的食物,轻则引起消化系统功能紊乱,产生过敏反应;重则造成肝、肾功能性损伤[6-8]。此外,恩诺沙星也容易诱导细菌耐药性的产生,进而影响氟喹诺酮类药物对人类疾病的治疗效果[9-10]。
目前,我国食品中恩诺沙星的标准检测方法是高效液相色谱法[11],该方法检测结果准确,但耗时较长、有机试剂用量大。近年来,研究人员开发了多种恩诺沙星的快速检测方法,如酶联免疫法[12]、比色法[13]、电化学法[14]等。这些快速检测方法有效缩短了检测时间,但存在费用高、准确性差等问题[15]。表面增强拉曼光谱(surface enhanced Raman spectroscopy,SERS)技术具有操作简便、指纹识别、灵敏度高等优点,在抗生素残留检测方面发展前景广阔[16]。然而,现有的恩诺沙星SERS 检测方法易受样品基质的干扰,很难实现复杂基质中恩诺沙星残留量的准确、灵敏检测。因此,本研究利用SERS 技术结合磁分离和信号放大策略,开发一种信号放大型SERS 适配体传感器,用于动物源食品中恩诺沙星残留的特异性、高灵敏检测,以期为动物源食品中抗生素残留的快速检测提供新思路。
1 材料与方法
1.1 材料与试剂
4-巯基苯甲酸、恩诺沙星(均为分析纯):上海阿拉丁生物科技有限公司;四水合氯金酸(分析纯):上海源叶生物科技有限公司;柠檬酸钠、四氢呋喃(均为分析纯):国药集团化学试剂有限公司;聚苯乙烯微球:苏州知益微球科技有限公司;链霉素修饰磁珠:上海碧云天生物技术有限公司;牛奶、猪肉:市售。
Apt 序列:5′-Biotin-CCC ATC AGG GGG CTA GGC TAA CAC GGT TCG GCT CTC TGA GCC CGG GTT ATT TCA GGG GGA-3′;cDNA 序列:5′-NH2C6-TCC CCC TGA AAT AAC CCG-3′。
1.2 仪器与设备
便携式拉曼光谱仪(BWS465-785):美国B&W Tek公司;纳米粒度及Zeta 电位分析仪(Litesizer 500):奥地利Anton Paar 公司;紫外可见分光光度计(Evolution 201):美国赛默飞世尔科技有限公司;高速离心机(H1750):湖南湘仪离心机有限公司;恒温振荡器(THZ-98A):上海一恒科学仪器有限公司;恒温磁力搅拌器(MYP11-2A):上海梅颖浦仪器仪表制造有限公司;绞肉机(JR69):浙江苏泊尔生活电器有限公司。
1.3 方法
1.3.1 拉曼探针4-MBA@PS@cDNA 的制备
向合成的cDNA 中加入适量无核酸酶水,涡旋混匀,配制100 μmol/L 溶液。分别取20 μL 聚苯乙烯(polystyrene,PS)微球(10%质量浓度)与73 μL 去离子水,加入离心管中,涡旋1 min。随后,加入50 μL 5 mmol/L 4-巯基苯甲酸(4-mercaptobenzoic acid,4-MBA)的四氢呋喃(tetrahydrofuran,THF)-水溶液,涡旋5 min,使PS 溶胀并吸附4-MBA。吸附完成后,9 000 r/min 离心10 min,去除上清液,并用含有10 mmol/L 三羟甲基氨基甲烷盐酸盐[tris(hydroxymethyl)aminomethane hydrochloride,Tris-HCl]与1 mmol/L 乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)混合缓冲液(pH7.4)洗涤沉淀物3 次,以去除多余的有机溶剂。随后,加入40 μL 1-乙基-(3-二甲基氨基丙基)碳酰二亚胺[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC](40 mmol/L)、40 μL N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)(100 mmol/L)和120 μL 4-吗啉乙磺酸(4-morpholineethanesulfonic acid,MES)(0.1 mol/L,pH6.0,0.5 mol/L NaCl),室温孵育15 min,激活PS 表面的羧基。8 000 r/min 离心5 min 以除去上清液,向沉淀中加入1 μL 100 μmol/L cDNA 溶液,37 ℃振荡孵育2 h。反应结束后,弃去上清液,用Tris-HCl缓冲液洗涤并重悬制备的拉曼探针4-MBA@PS@cDNA,4 ℃保存备用。
1.3.2 捕获探针MB@Apt 的制备
取15 μL 磁珠(magnetic bead,MB)加入离心管中,磁分离除去上清液,使用Tris 缓冲盐溶液(Tris buffered saline,TBS)(20 mmol/L Tris,0.137 mol/L NaCl,pH7.6)重复洗涤3 次并重悬于15 μL Tris-HCl 缓冲液中。然后,向MB 中加入1 μL 100 μmol/L Apt 溶液,37 ℃振荡孵育30 min。孵育完成后,磁分离除去上清液,用Tris-HCl 缓冲液重复洗涤3 次并重悬,4 ℃保存备用。
1.3.3 Au NPs 溶胶的制备
根据Wang 等[17]的方法制备Au NPs 溶胶。将300 μL HAuCl4·4H2O(1% 质量浓度)和30 mL 去离子水加入100 mL 的锥形瓶中。使用磁力搅拌器以1 400 r/min 速度搅拌混合物溶液并快速加热至沸腾。溶液沸腾后,立即加入质量浓度为1%的180 μL 柠檬酸钠溶液。继续搅拌并加热直至颜色变为酒红色后停止加热。室温冷却后置于4 ℃保存备用。
1.3.4 SERS 检测
首先,将32 μL 拉曼探针4-MBA@PS@cDNA 和4 μL 捕获探针MB@Apt 混合后置于恒温振荡器内,37 ℃孵育60 min。然后,用Tris-HCl 缓冲液重复洗涤3 次。随后,取40 μL 组装的复合探针与10 μL 恩诺沙星标准液混合。37 ℃孵育60 min 后,利用外源磁铁分离磁珠,收集上清液,并向其中加入40 μL THF 溶胀PS 微球从而释放拉曼报告分子。紧接着,向混合物中加入8 μL 磷酸缓冲盐溶液(phosphate buffered saline,PBS),涡旋5 min 使溶解的聚苯乙烯析出。8 000 r/min离心混合物10 min 后,取出50 μL 上清液与150 μL Au NPs 溶胶充分混匀,取5 μL 混合样品滴在表面覆有平滑锡纸的玻璃片上,用便携式拉曼光谱仪采集SERS 光谱。光谱采集条件:激发波长785 nm,激光功率320 mW,积分时间5 s,积分次数3 次。每个样品采集5 条代表性SERS 光谱。
1.3.5 加标回收试验
将猪肉样品用绞肉机充分绞碎。首先,称取5 g样品置于50 mL 聚丙烯离心管中,加入1 mL 不同浓度恩诺沙星标准溶液,使样品中恩诺沙星的浓度分别为0.015、0.075、0.150 μg/g。随后,加入20 mL Tris-HCl缓冲溶液,涡旋混匀,并超声处理30 min。然后,在转速为10 000 r/min、温度为4 ℃条件下离心5 min。最后,取10 μL 上清液进行SERS 检测。
1.4 数据分析
使用InsightMainApp 软件进行紫外吸收光谱数据分析,通过Origin 2021 软件进行拉曼光谱数据分析及标准曲线绘制。误差统计与计算采用Excel 2021 软件。
2 结果与分析
2.1 信号放大型SERS 适配体传感器检测恩诺沙星的原理
该研究利用SERS 技术结合磁分离和信号放大策略开发一种高灵敏SERS 适配体传感器,用于恩诺沙星的快速检测,原理如图1 所示。
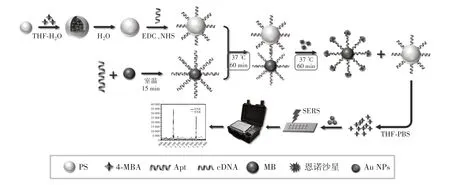
图1 信号放大型SERS 适配体传感器检测恩诺沙星的原理图Fig.1 Schematic diagram of detecting enrofloxacin using SERS signal amplification aptasensor
2.2 材料表征
利用紫外可见分光光度计和纳米粒度及Zeta 电位分析仪表征了构建的拉曼探针4-MBA@PS@cDNA和捕获探针MB@Apt,结果见图2。
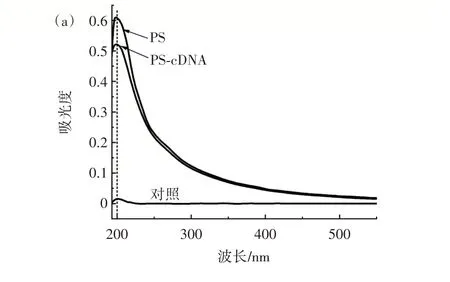
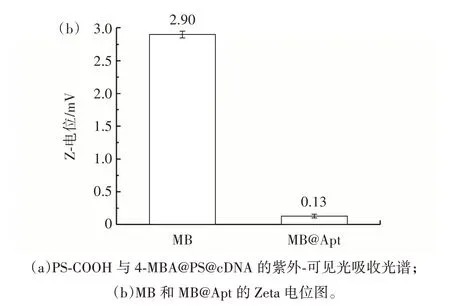
图2 材料表征结果Fig.2 Material characterization
如图1 所示,利用4-MBA、PS 和cDNA 制备信号放大型拉曼探针4-MBA@PS@cDNA,利用生物素标记的适配体和链霉亲和素修饰的磁珠制备捕获探针MB@Apt。拉曼探针和捕获探针通过碱基互补配对组装成复合探针4-MBA@PS@cDNA-MB@Apt。在没有恩诺沙星的情况下,复合探针4-MBA@PS@cDNAMB@Apt 稳定存在,样品经磁分离和THF 溶液处理后,上清液中4-MBA 浓度很低,SERS 信号强度弱。当目标分子恩诺沙星存在时,恩诺沙星与适配体特异性结合,导致拉曼探针4-MBA@PS@cDNA 从捕获探针上释放。释放的拉曼探针加入THF 后,可以释放出大量的4-MBA。因此,可以通过检测4-MBA 实现复杂样品中恩诺沙星的特异性灵敏检测。
由图2(a)可知,cDNA 修饰4-MBA@PS 后,PS 微球在200 nm 处的特征峰吸光值由0.61 下降至0.52,其原因是PS 微球表面修饰的cDNA 阻碍了PS 微球对紫外光的吸收,结果证明了4-MBA@PS@cDNA 的成功制备。由图2(b)可知,Apt 修饰MB 后,Zeta 电位从2.90 mV 降低至0.13 mV,这是因为适配体中磷酸盐骨架的负电荷中和了部分MB 携带的正电荷[18],结果证明了MB@Apt 的成功制备。
2.3 试验条件优化
2.3.1 4-MBA 浓度的优化
PS 负载的拉曼报告物的量直接影响SERS 适配体传感器的灵敏度。分别利用1×10-4~1×10-2mol/L 的4-MBA 溶液制备了4-MBA@PS,并采集了经THF 处理后上清液的SERS 光谱,结果见图3。
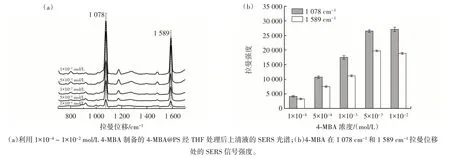
图3 拉曼报告物4-MBA 浓度优化Fig.3 Optimization of the concentration of Raman reporter 4-MBA
由图3(a)可知,4-MBA 的SERS 信号强度随其添加量的变化而变化。从图3(b)可以看出,浓度为1×10-4~1×10-2mol/L 时,4-MBA 位于拉曼位移1 078 cm-1和1 589 cm-1处特征SERS 信号的强度随着浓度的增加先升高后趋于稳定。这可能是因为当4-MBA 浓度为5×10-3mol/L 时,单个PS 微球内负载的4-MBA 达到饱和,特征峰SERS 信号强度进入平台期。因此,在后续试验中将选择5×10-3mol/L 4-MBA 制备拉曼探针。
2.3.2 制备拉曼探针的THF 与水体积比的优化
THF 在PS 微球溶胀和拉曼报告物扩散中起着关键作用。THF 与水的体积比决定了PS 微球的可逆溶胀程度,进而影响PS 微球对4-MBA 的负载能力。试验中采集了THF 与水的体积比为6∶1~14∶1 时PS 微球吸附和释放的4-MBA 的SERS 光谱,结果见图4。
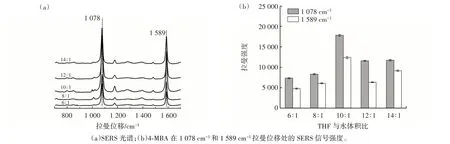
图4 制备拉曼探针的THF 与水体积比的优化Fig.4 Optimization of the volume ratio of tetrahydrofuran to water used for preparation of Raman probe
从图4(a)可以看出,4-MBA 位于1 078 cm-1和1 589 cm-1拉曼位移处的SERS 信号强度受到THF 与水体积比的影响。如图4(b)所示,当THF 与水的体积比为10∶1 时,4-MBA 的SERS 信号强度最高。这很可能是因为PS 微球在THF 与水的体积比为10∶1 时拥有最好的可逆收缩能力,过低的THF 与水的体积比使得PS 微球不能充分溶胀,阻碍其对4-MBA 的吸附过程。而过高的THF 与水的体积比使PS 微球难以从膨胀中收缩,从而导致4-MBA 提前泄漏。因此,THF 与水的体积比为10∶1 是制备4-MBA@PS@cDNA 的最合适条件。
2.3.3 释放拉曼报告物的THF 与PBS 的体积比优化
自从2016年起,我国健康管理已经从经典健康管理进入了精准健康管理的新高度。精准健康管理是运用精准检测,人工智能,电子健康档案,动态检测及大数据分析等,为人们提供精准健康检测、评估、分析及预测的等多种健康管理服务。这系列的服务不但需要技术支持,还需要提供服务者与接受服务者相互信任、相互配合、相互沟通才能完成。而高校教师群体文化程度高、相信科学、敢于尝试新兴事物。因此,对高校退休教师实施健康管理,有助于实现个体或群体健康的精准管理。
THF 在PS 微球溶胀中发挥着重要作用,不仅影响PS 微球对4-MBA 的吸附,而且影响PS 微球中4-MBA 的释放。此外,PS 微球在高浓度THF 中会发生单体间链裂解使其聚合度降低,产生的低聚物可溶解于溶剂,降低其对光的透射率,导致SERS 信号降低[19]。研究发现,PBS 中的Na+和K+可以降低低聚物的溶解度,使其析出,从而降低低聚物对检测的干扰[20]。这可能是由于Na+和K+带正电荷,降低了带负电荷的低聚物在溶液中的溶解度。本研究比较了THF与PBS 的体积比为6∶1~10∶1 时上清液中拉曼报告物的SERS 信号强度,结果见图5。

图5 释放拉曼报告物的THF-PBS 体积比的优化Fig.5 Optimization of the volume ratio of tetrahydrofuran to polybutylene succinate used for release of Raman reporter
从图5 可以看出,在THF 与PBS 的体积比为8∶1时,SERS 信号强度最高。这可能是由于当体积比在6∶1~8∶1 时,探针释放的4-MBA 的浓度随着THF 用量的增加而增加。而当体积比在8∶1~10∶1 时,溶液中的聚苯乙烯的单体无法完全从检测体系中析出,干扰了SERS 光谱的采集,导致采集的4-MBA 的SERS 信号强度降低。因此,后续将选择体积比为8∶1 的THFPBS 体系释放拉曼探针中的拉曼报告物。
2.3.4 制备捕获探针的MB 添加量的优化
利用生物素修饰的适配体和链霉亲和素修饰的磁珠制备了恩诺沙星的特异性捕获探针MB@Apt。通过比较在0~25 μL 时不同添加量的MB 与1 μL 100 μmol/L Apt 溶液反应后上清液的紫外-可见光吸收光谱图,优化了MB 的添加量,结果见图6。
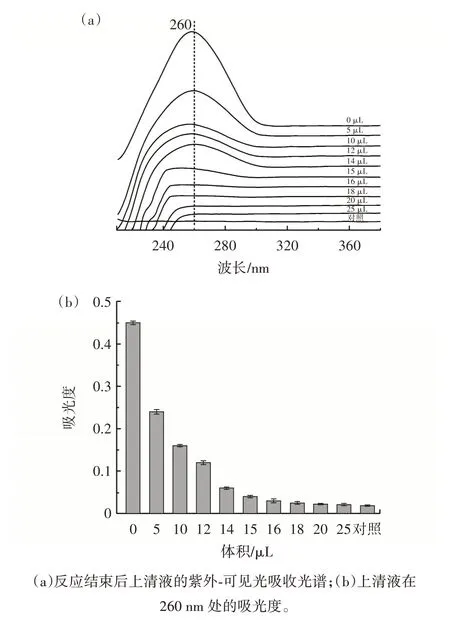
图6 制备捕获探针时磁珠用量的优化Fig.6 Optimization of the amount of magnetic bead used for preparation of capture probe
从图6(a)可以看出,磁分离后上清液在260 nm处的吸光度随着MB 添加量的增加而逐渐下降,说明MB 吸附的适配体随其添加量的增加而增加。由图6(b)可知,在MB 的加入体积为15 μL 时,DNA 紫外吸收波长260 nm 处的吸光度略高于对照组,表明Apt充分修饰了MB 并存在少量剩余。为了尽可能提高Apt 的修饰率并降低Apt 的损耗,后续试验中将选用15 μL 10%(质量分数)MB 与1 μL 100 μmol/L 的Apt溶液来制备捕获探针。
2.3.5 样品与金溶胶增强基底体积比的优化
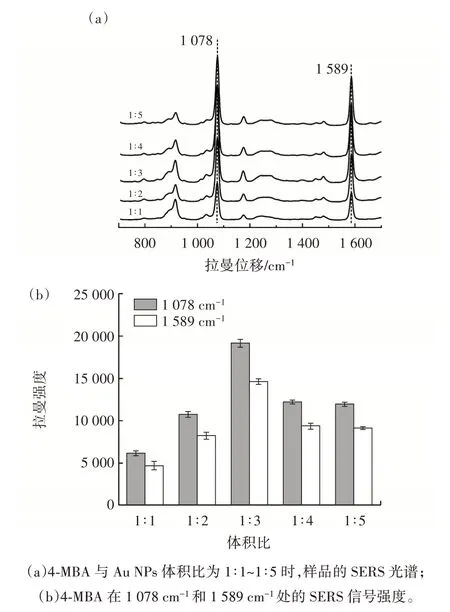
图7 4-MBA 与Au NPs 体积比的优化Fig.7 Optimization of the volume ratio of 4-MBA to Au NPs
从图7 可以看出,随着4-MBA 与Au NPs 体积比的增加,4-MBA 的特征SERS 信号强度先升高后降低,在体积比为1∶3 时特征峰处的SERS 信号强度最高。这可能是因为在体积比1∶1~1∶3 范围内,Au NPs 的增强效果随着其占比增大而增强。在1∶3~1∶5 时,过多的Au NPs 导致检测体系中4-MBA 浓度降低,SERS 信号强度也随之降低。因此,在后续试验中,4-MBA 与Au NPs 的最佳体积比设定为1∶3。
2.3.6 拉曼探针与捕获探针体积比的优化
拉曼探针4-MBA@PS@cDNA 与捕获探针MB@Apt的体积比直接影响SERS 适配体传感器的灵敏度。试验比较了利用不同体积比(1∶3~6∶1)的4-MBA@PS@cDNA与MB@Apt 组装的复合探针对1 μmol/L 恩诺沙星标准溶液的响应信号,结果见图8。
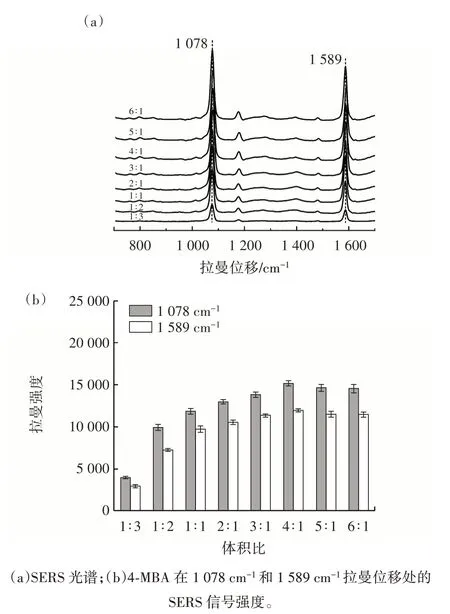
图8 4-MBA@PS@cDNA 与MB@Apt 体积比的优化Fig.8 Optimization of the volume ratio of 4-MBA@PS@cDNA to MB@Apt
由图8 可知,4-MBA@PS@cDNA 与MB@Apt 体积比在1∶3~4∶1 时,SERS 信号强度随着4-MBA@PS@cDNA占比的增加而增强,而随着4-MBA@PS@cDNA 占比的进一步增加,SERS 信号强度逐渐趋于稳定,说明4-MBA@PS@cDNA 与MB@Apt 的体积比为4∶1 时,捕获探针结合的拉曼探针基本饱和。因此,拉曼探针与捕获探针的体积比为4∶1 是构建复合探针的最佳比例。
2.4 利用建立的信号放大型SERS 适配体传感器检测恩诺沙星
为了评价构建的SERS 适配体传感器的灵敏度和定量性能,在最优条件下,利用建立的SERS 适配体传感器检测了不同浓度的恩诺沙星标准溶液,采集的SERS 光谱见图9。
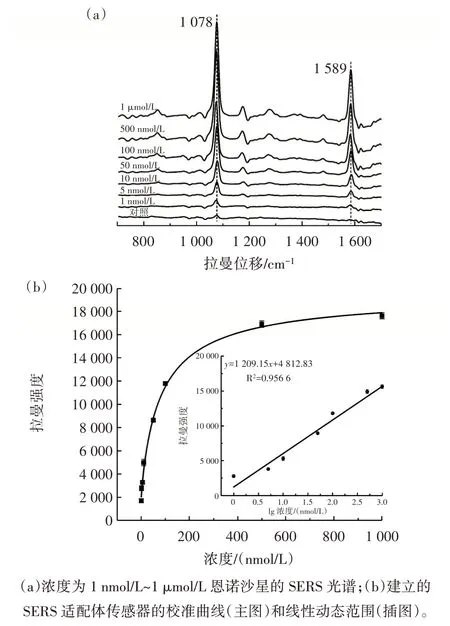
图9 信号放大型SERS 适配体传感器对不同浓度恩诺沙星的检测结果Fig.9 Detection of enrofloxacin at different concentrations using SERS signal amplification aptasensor
从图9 中可以看出,随着恩诺沙星浓度的增大,4-MBA 位于1 078 cm-1和1 589 cm-1拉曼位移处的SERS信号强度逐渐升高。而且,在1 nmol/L~1 μmol/L 的范围内,4-MBA 在1 078cm-1拉曼位移处的特征SERS 信号强度与恩诺沙星浓度的对数值具有良好的线性相关关系,线性回归方程为y=1 209.15x+4 812.83,决定系数(R2)为0.956 6。利用回归方程计算的最低检出限(limit of detection,LOD)为0.71 nmol/L。以上结果表明,本研究构建的SERS 适配体传感器具有较宽的线性范围和较低的检出限。
2.5 特异性分析
通过比较构建的信号放大型SERS 适配体传感器对恩诺沙星(enrofloxacin,ENR)和另外3 种氟喹诺酮类抗生素[环丙沙星(ciprofloxacin,CIP)、司帕沙星(sparfloxacin,SPX)、依诺沙星(enoxacin,ENO)]的检测性能,评估其特异性。结果见图10。
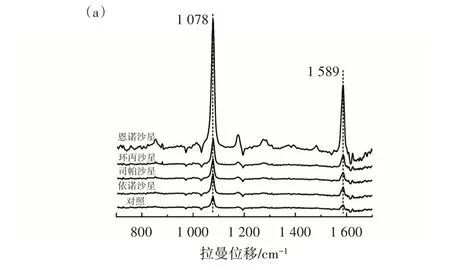
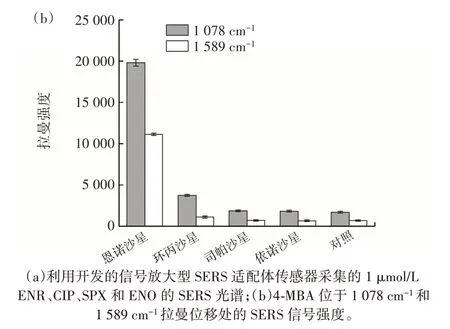
图10 特异性评价结果Fig.10 Specificity evaluation
由图10 可知,建立的SERS 适配体传感器对ENR的SERS 信号响应强度最高,对SPX 和ENO 的几乎无响应,而对CIP 样品溶液的信号响应略高于对照组。推测是由于CIP 和ENR 具有相似的喹啉结构,即ENR 分子中喹啉的7 号位的哌嗪基对位上的氢原子被乙基取代,CIP 则是完整的喹啉环,导致ENR 适配体对CIP 也表现出了较低的识别性。
2.6 稳定性与重现性分析
通过采集在4 ℃保存0~30 d 的复合探针与1 μmol/L ENR 反应的SERS 光谱评价了该方法的稳定性,结果见图11。
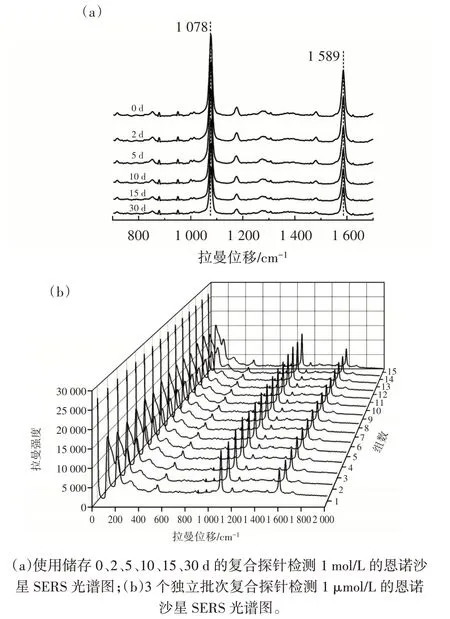
图11 稳定性和重现性分析Fig.11 Stability and reproducibility
从图11(a)可以看出,低温储存2~10 d 的复合探针在拉曼位移1 078 cm-1和1 589 cm-1处的SERS 信号强度没有明显差异。对两个特征峰处的SERS 强度进行统计分析,结果表明15 d 后特征峰SERS 信号强度分别降低15.38%和15.62%,30 d 后分别降低22.89%和23.90%。说明SERS 适配体传感器在0~10 d 内仍能保持良好的稳定性,但长期储存会导致SERS 传感器灵敏度下降。其原因是长时间储存使PS 微球负载的4-MBA 提前泄露,从而导致SERS 响应强度降低。此外,试验还比较了3 个独立批次共计15 组的复合探针用于检测浓度为1 μmol/L 的恩诺沙星溶液的SERS光谱图。从图11(b)可以看出,不同样品的SERS 光谱没有明显差异,说明所建立的信号放大型SERS 适配体传感器检测恩诺沙星具有较高的重现性。
2.7 加标回收试验结果
通过对牛奶和猪肉进行加标回收试验,评价了所建立的信号放大型SERS 适配体传感器对实际样品中恩诺沙星的检测性能。在最优条件下,检测了恩诺沙星标准液添加浓度为0.015、0.075、0.150 μg/g 的牛奶和猪肉样品。SERS 光谱图见图12,检测结果见表1。
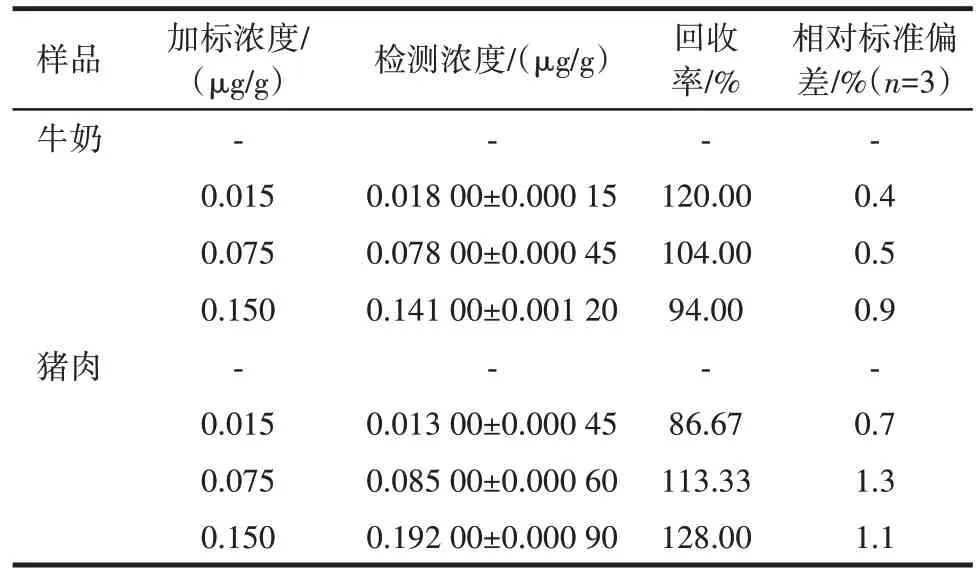
表1 牛奶和猪肉中恩诺沙星的检测结果Table 1 Detection of enrofloxacin in milk and pork
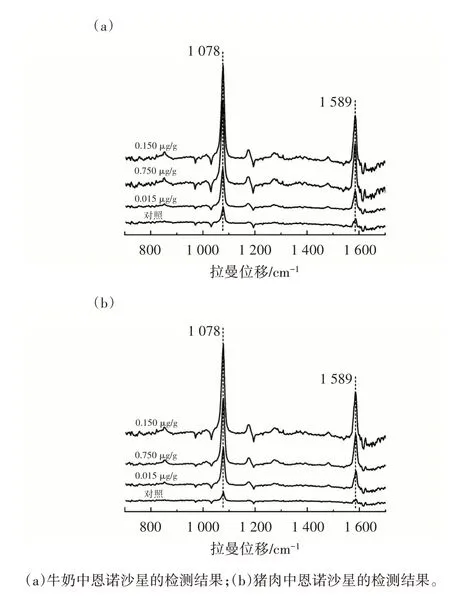
图12 加标回收试验结果Fig.12 Spiked recovery
由表1 可知,该传感器检测牛奶和猪肉中恩诺沙星的回收率为86.67%~128.00%,相对标准偏差为0.4%~1.3%(n=3)。以上结果表明,所建立的信号放大型SERS 适配体传感器对于动物源中恩诺沙星含量的测定具有较高的准确度和良好的稳定性,为食品中抗生素残留的快速检测提供了新思路。
3 结论
本研究利用PS 微球的可控溶胀性能,制备了信号放大型拉曼探针,通过Apt 和cDNA 互补杂交将磁性捕获探针和信号放大型拉曼探针组装为复合探针,结合SERS 技术,建立了一种高灵敏SERS 适配体传感器,用于动物源食品中恩诺沙星的快速检测。当恩诺沙星存在时,恩诺沙星与捕获探针特异性结合,释放出拉曼探针,溶胀拉曼探针释放出拉曼报告物4-MBA。在最佳的试验条件下,4-MBA 位于1 078 cm-1拉曼位移处SERS 信号强度与恩诺沙星浓度的对数值在1~100 nmol/L 时存在良好的线性相关关系,R2为0.956 6,LOD 为0.71 nmol/L。该方法检测牛奶和猪肉中恩诺沙星的加标回收率为86.67%~128.00%,相对标准偏差为0.4%~1.3%(n=3)。此外,本研究制备的复合探针稳定性好,可以在1.5 h 内完成恩诺沙星的定量检测。因此,本研究建立的PS 微球介导的信号放大型SERS 适配体传感器检测恩诺沙星灵敏度高、特异性好,为动物源食品中抗生素残留的检测提供了新的思路。

