正己烷-乙醇-水三元双相溶剂浸提法富集南极磷虾磷脂
郭向融,刘小芳,姜维,辛云,苏东,刘宇,冷凯良
(1.浙江海洋大学国家海洋设施养殖工程技术研究中心,浙江舟山 316022;2.中国水产科学研究院黄海水产研究所农业农村部极地渔业可持续利用重点实验室,山东青岛 266071)
南极磷虾作为可持续的远洋渔业资源,近年来受到越来越多的关注[1]。在南极海洋生物资源养护委员会的监督管理下,南极磷虾资源正被有序地开发利用[2-3]。我国南极磷虾渔业自2010 年入渔以来,经过十余年发展已取得长足进步[2-3]。南极磷虾渔业是海陆联动型海洋生物资源利用产业,新鲜捕获的南极磷虾先在船上加工为南极磷虾粉、南极磷虾冻虾等原料级产品,而后经远洋冷链运输至陆地再进行后续精深加工利用[1-3]。受捕捞加工船处理能力的限制,捕获的南极磷虾少部分可被加工为南极磷虾粉,大部分仍是以南极磷虾冻虾的形式运回陆地。目前,陆基加工利用南极磷虾粉生产南极磷虾油、南极磷虾蛋白肽等高值产品已发展得较为成熟[1,4],但南极磷虾冻虾仍一直作为饲料或者普通食品的原料被低值化应用[5],一定程度上造成了资源浪费。合理利用南极磷虾冻虾资源进行高值产品的开发,对于支撑南极磷虾产业高质量发展具有重要意义。
磷脂是分子结构中含有磷酸基团的极性脂质成分,其是构成细胞膜的基础结构物质,并在维持生物体正常代谢和功能稳态中发挥重要作用[6]。南极磷虾的磷脂含量高[7],且南极磷虾所富含的二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)等多不饱和脂肪酸主要以磷脂型式存在[8-9]。现有研究指出,磷脂是南极磷虾最重要的活性脂质成分,与甘油酯、游离脂肪酸等其他脂质成分相比,磷脂在防治心脑血管疾病[10]、调节糖/脂代谢[11-12]、维持肠道功能稳态[12]等方面能够发挥更优的活性作用。南极磷虾磷脂的提取生产已引起产业关注,将成为南极磷虾脂质类高值产品开发的新方向。
磷脂的富集方法主要包括溶剂萃取法、层析分离法及超临界萃取法等,其中,溶剂萃取法是最常采用的手段,层析分离法和超临界萃取法则受到加工处理量小、生产投入大、设备要求高等因素限制而尚未在工业化生产中大规模应用[13]。利用不同脂质成分间的极性差异,采用由极性溶剂和非极性溶剂构成的双相溶剂体系进行萃取可实现目标脂质化合物的富集[14]。以正己烷-乙醇为主体构成的烃-醇型混合溶剂是油脂工业中较为成熟的混合溶剂之一,具有提取效果好且产物安全性高等优势[14-15]。然而,南极磷虾含水量接近80%[5,16],在直接浸提南极磷虾总脂质的过程中水分也会同步被提取出来,水分的存在会对正己烷-乙醇混合溶剂体系的相平衡产生影响[14],并最终影响磷脂的富集效果,目前鲜有研究对此进行深入探讨[15]。因此,本研究以解冻后的南极磷虾为原料,针对乙醇浸提南极磷虾总脂质以及正己烷-乙醇-水三元双相溶剂萃取富集南极磷虾磷脂的工艺条件进行优化,并对制备获得的南极磷虾磷脂的组成进行分析,以期为南极磷虾冻虾资源的合理利用提供参考,为新型南极磷虾脂质类高值产品的开发提供技术支持。
1 材料与方法
1.1 材料与试剂
南极磷虾冻虾:辽宁远洋渔业有限公司;磷脂酰胆碱(phosphatidylcholine,PC)标准品、磷脂酰乙醇胺(phosphatidylethanolamine,PE)标准品、溶血型磷脂酰胆碱(lysophosphatidylcholine,LPC)标准品、37 种脂肪酸甲酯混标(纯度均≥98%):德国默克生命科学有限公司;三氯甲烷、浓硫酸、浓硝酸、高氯酸:青岛润嵩化学科技有限公司;甲醇、乙醇、异丙醇、正己烷、甲酸铵:国药集团化学试剂有限公司。除特殊标记外,所用化学试剂均为分析纯。
1.2 仪器与设备
BAS224S-CW 型电子天平:赛多利斯科学仪器(北京)有限公司;HH-4 型恒温水浴锅:常州智博瑞仪器制造有限公司;LXJ-IIB 型离心机:上海安亭科学仪器厂;RE52AA 型旋转蒸发仪:上海亚荣生化仪器厂;UV1-102Ⅱ型紫外/可见分光光度计:上海天美科学仪器有限公司;LC-16 型液相色谱仪(配置蒸发光散射检测器):日本岛津公司;HP-6890 型气相色谱仪(配置火焰离子化检测器):美国安捷伦科技有限公司。
1.3 试验方法
1.3.1 南极磷虾总脂质提取条件优化
南极磷虾冻虾进行静水解冻,以南极磷虾块掰开断裂处虾体完整作为解冻完全的标志[17]。适量解冻后的南极磷虾采用乙醇在相应试验条件下进行总脂质的浸提,浸提完成后进行离心(室温25 ℃,5 000 r/min,20 min)处理,收集上清液经旋蒸脱溶得总脂质,称量总脂质的质量并记录。固定料液比1∶3(g/mL)、浸提温度40 ℃、浸提时间3 h、浸提3 次,探究料液比[1∶1、1∶2、1∶3、1∶4、1∶5(g/mL)]、浸提时间(1、2、3、4、5 h)、浸提温度(20、30、40、50、60 ℃)、浸提次数(1、2、3、4、5 次)对总脂质提取效果的影响。以总脂质得率为评价指标,确定各因素的最佳条件。总脂质得率(w,%)计算公式如下。
式中:m为南极磷虾总脂质质量,g;M为南极磷虾质量,g。
1.3.2 正己烷-乙醇-水三元双相溶剂萃取南极磷虾磷脂的条件优化
参考文献[14,18]选择覆盖正己烷-乙醇-水混合溶剂双相区域的不同相点进行南极磷虾磷脂萃取条件的优化,正己烷-乙醇-水三元体系的相平衡图及各相点对应的正己烷-乙醇-水的体积比分别见图1 和表1。
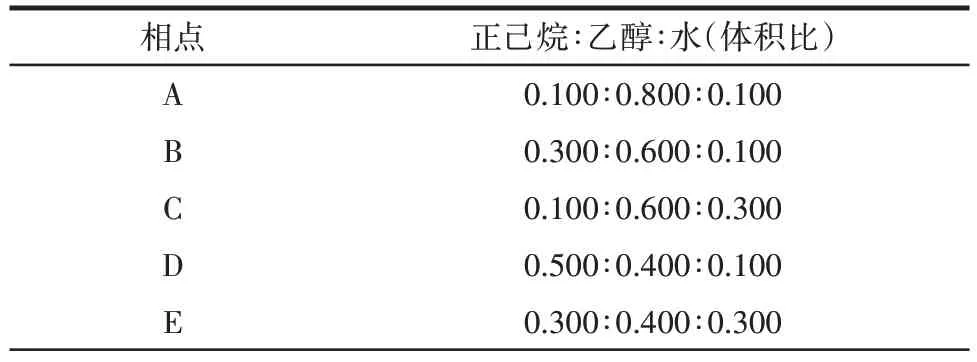
表1 不同相点对应的正己烷-乙醇-水的体积比Table 1 Volume ratio of hexane-ethanol-water at the selected phase point
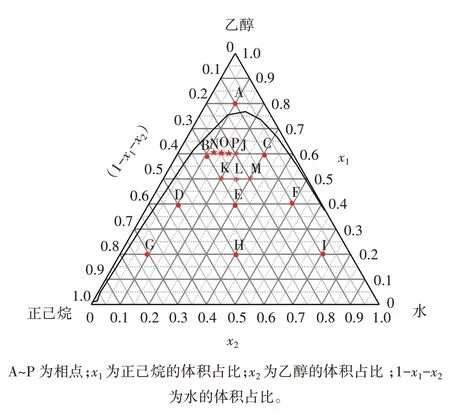
图1 正己烷-乙醇-水三元体系的相平衡图Fig.1 Phase equilibrium diagram of hexane-ethanol-water system
取适量南极磷虾总脂质,按照相应试验条件进行萃取处理,先加入乙醇,涡旋混匀使脂质充分溶解,然后加入超纯水,再次涡旋混匀后加入正己烷,充分混匀后于室温25 ℃静置,待分层完全后分别收集上相溶液和下相溶液,经旋蒸脱溶得上相脂质提取物和下相脂质提取物,用于各指标的测定。不同处理组中南极磷脂总脂质与正己烷-乙醇-水混合溶剂的料液比均为1∶100(g/mL)。以脂质得率、磷脂含量、磷脂得率为评价指标,确定正己烷-乙醇-水混合溶剂从南极磷虾总脂质中萃取富集磷脂的最佳条件。各评价指标按照以下公式计算。
式中:w1为上相脂质得率,%;m1为上相脂质质量,g;m为南极磷虾总脂质质量,g;w2为下相脂质得率,%;m2为下相脂质质量,g;w3为磷脂得率,%;c为下相脂质中磷脂含量,%;c0为南极磷虾总脂质中磷脂含量,g。
1.3.3 南极磷虾磷脂的富集及组成分析
500 g 解冻后的南极磷虾,水分含量经测定为(78.52±1.63)g/100 g,利用乙醇按照1.3.1 中优化确定的条件进行浸提,浸提完成后进行离心(室温25 ℃,5 000 r/min 离心20 min)处理,收集上清液即为总脂质提取液,按照1.3.2 中优化确定的正己烷-乙醇-水的体积比依次补齐超纯水和正己烷,充分混匀后于室温静置,待分层完全后收集下相溶液,经旋蒸脱溶得南极磷虾磷脂,然后进一步测定磷脂含量、磷脂组成和脂肪酸组成。
1.3.4 评价指标测定方法
1.3.4.1 磷脂含量测定
磷脂含量按照GB/T 5537—2008《粮油检验磷脂含量的测定》中的钼蓝比色法进行测定。
1.3.4.2 磷脂组成分析
参照文献[19-20]的方法进行磷脂组成分析:适量磷脂样品采用三氯甲烷-甲醇溶液(2∶1,体积比)溶解,采用液相色谱法分析磷脂组成,利用外标法对不同磷脂组分进行定量,而后计算各磷脂组分在总磷脂中所占比例。液相色谱条件:色谱柱ZORBAX Rx-SIL(250 mm×4.6 mm,5 μm);柱温35 ℃;流动相A:异丙醇、水、5 mmol/L 甲酸铵体积比85∶14∶1,流动相B:正己烷、异丙醇、5 mmol/L 甲酸铵体积比82∶17∶1;洗脱程序:0 min(A、B 体积比0∶100),5 min(A、B 体积比20∶80),7 min(A、B 体积比40∶60),17 min(A、B 体积比70∶30),23 min(A、B 体积比100∶0),25 min(A、B 体积比100∶0),26 min(A、B 体积比0∶100),30 min(A、B体积比0∶100);洗脱流速1 mL/min;漂移管温度60 ℃;雾化器压力172 kPa;进样量10 μL。定量分析:在20~500 mg/L 浓度范围内,PC 定量方程为Y=1.118 8X+3.430 9,R2=0.998 7;PE 定量方程为Y=1.339 3X+2.786 2,R2=0.997 6;LPC 定量方程为Y=1.119 8X+3.213 5,R2=0.999 0;其中,X为各磷脂组分标准品的质量浓度(mg/L),Y为相应峰面积的对数值。
1.3.4.3 脂肪酸组成分析
参照文献[19-20]的方法进行脂肪酸组成分析:适量磷脂样品经甲酯化处理后,采用气相色谱法分析脂肪酸组成,利用峰面积归一化法对各脂肪酸进行定量。气相色谱条件:INNOWAX 毛细管柱(0.32 mm×30 m,0.25 μm);进样量1 μL;分流比15∶1;升温程序:自170 ℃按照3 ℃/min 速率升温至210 ℃,保持30 min;高纯氮气为载气,流速40 mL/min;检测器温度250 ℃,氢气流速40 mL/min,空气流速450 mL/min。
1.4 数据处理
试验结果以平均值±标准偏差的形式表示,采用Excel 2016、IBM SPSS 27.0、Origin 2022 软件进行数据处理和图形绘制。采用单因素方差分析进行组间多重比较,以P<0.05 为差异具有统计学意义。
2 结果与分析
2.1 南极磷虾总脂质提取条件的确定
料液比、浸提时间、浸提温度、浸提次数对南极磷虾总脂质提取效果的影响见图2。
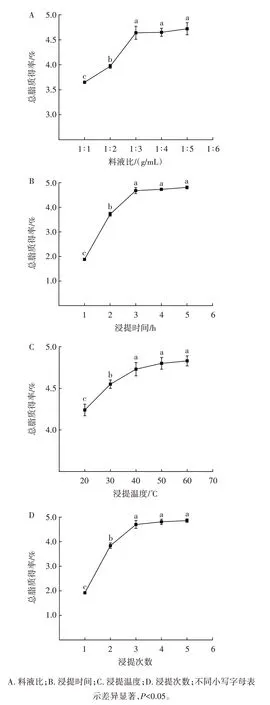
图2 不同提取条件对南极磷虾总脂质提取效果的影响Fig.2 Effects of different extraction conditions on the extraction efficiency of total lipids from Antarctic krill
由图2A 可知,随着溶剂体积的增加,总脂质得率逐渐提高,当料液比达到1∶3(g/mL)后,总脂质得率趋于稳定;依据传质平衡原理,在一定范围内,随着溶剂体积的增加,浸出的脂质逐渐增多,当脂质基本被提取出后,继续增加溶剂并不会改善提取效果,但却会增加成本和后续脱溶的能耗[21]。因此,选定料液比1∶3(g/mL)为最佳条件。由图2B 可知,随着浸提时间的延长,总脂质得率逐渐升高,浸提3 h 时总脂质得率较高;随着浸提时间的延长,南极磷虾原料与浸提溶剂中的脂质浓度差不断缩小,直至扩散基本达到平衡[22],之后浸提时间继续延长,总脂质得率基本稳定。因此,选定浸提时间3 h 为最佳条件。由图2C 可知,总脂质得率随着浸提温度的升高而显著升高(P<0.05),当浸提温度高于40 ℃后,继续升高浸提温度,总脂质得率无显著变化(P>0.05)。适当提高浸提温度能够加快分子运动,促进脂质的溶出,但浸提温度过高会引起料液间气化层的形成,阻碍分子扩散,无法继续带来浸提效果的明显改变[21,23]。因此,选定浸提温度40 ℃为最佳条件。由图2D 可知,总脂质得率随着浸提次数的增加而增加,浸提超过3 次后总脂质得率基本不变。随着浸提次数的增加,原料中的脂质不断被提取,待充分抽提后,增加浸提次数不会带来浸提效果的改善。因此,选定浸提3 次为最佳条件。
综上,确定南极磷虾总脂质提取条件为料液比1∶3(g/mL)、浸提时间3 h、浸提温度40 ℃、浸提次数3 次,在此条件下重复进行6 次提取试验,总脂质得率为(4.69±0.13)%,这与前期研究中测得的南极磷虾总脂质含量保持一致[19,24],表明在上述条件下,南极磷虾总脂质已被提取完全。
2.2 正己烷-乙醇-水三元双相溶剂萃取南极磷虾磷脂条件确定
正己烷-乙醇-水三元体系不同相点条件对南极磷虾磷脂萃取效果的影响见图3。

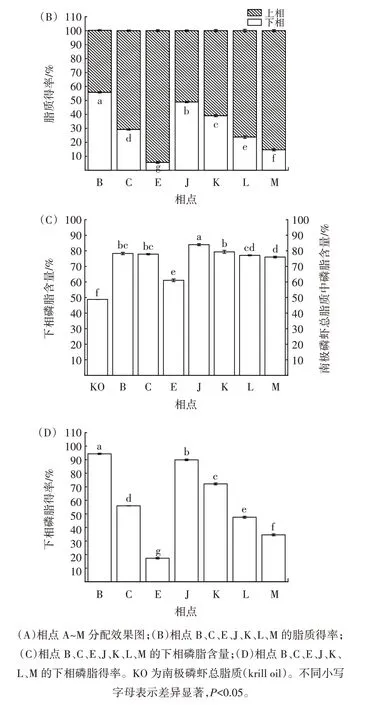
图3 A~M 相点条件对南极磷虾磷脂萃取效果的影响Fig.3 Effects of A-M phase point conditions on the extraction efficiency of Antarctic krill phospholipids
南极磷虾总脂质中的磷脂属极性脂质,其因头部基团中含有磷酸和碱基而具有很强的亲水性,在萃取过程中优先富集于极性较高的下相乙醇-水层;而南极磷虾总脂质中的甘油酯、游离脂肪酸等中性脂质则更易分配至极性较低的上相正己烷层[25]。由图3(A)可知,与处于均相区的相点A 相比,采用非均相区的相点B~I 对应条件处理,南极磷虾总脂质可得到不同程度的分离。相点F、H、I 因体系中水的比例过大引起了磷脂乳化[26-27],而相点D、G 需在总脂质提取液中引入较高比例的正己烷,因此选定相点B、C、E 所对应的三角区域进行进一步的条件优化。由图3(A)可知,在相点B、C、E、J、K、L、M 对应条件下,南极磷虾总脂质在正己烷-乙醇-水三元体系中能够实现双相分配。由图3(B)可知,在相点B 对应条件下,下相脂质得率最高,为(55.87±0.53)%,显著高于其他相点(P<0.05);下相脂质得率由高到低顺序为B>J>K>C>L>M>E。由图3(C)可知,在相点J 对应条件下,下相脂质中的磷脂含量最高,为(83.95±0.65)%,显著高于其他相点(P<0.05);下相脂质中的磷脂含量由高到低顺序为J>K>B>C>L>M>E。由图3(D)可知,在相点B 对应条件下,下相磷脂得率最高,达到(94.31±0.48)%,显著高于其他相点(P<0.05);其次为相点J 和相点K,下相磷脂得率分别为(89.87±0.59)%和(72.15±0.70)%;下相磷脂得率由高到低顺序为B>J>K>C>L>M>E。综上,选定相点B、J所对应的直线区域进行进一步的条件优化。
B、N、O、P、J 相点条件对南极磷虾磷脂萃取效果的影响见图4。
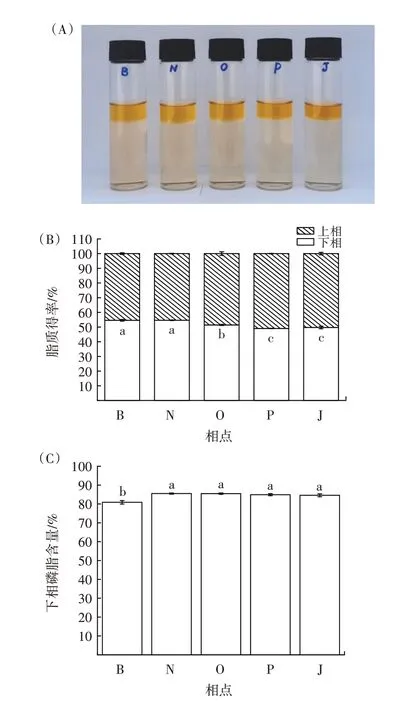
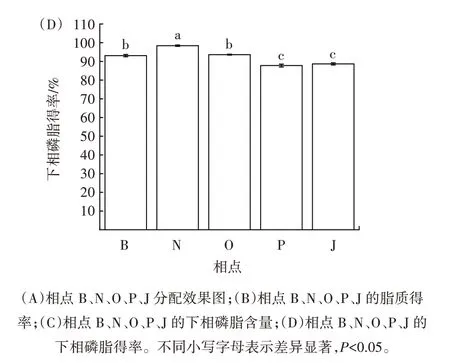
图4 B、N、O、P、J 相点条件对南极磷虾磷脂萃取效果的影响Fig.4 Effects of B,N,O,P,J phase point conditions on the extraction efficiency of Antarctic krill phospholipids
在由相点B 至相点J 的直线区域内,正己烷-乙醇-水三元体系中乙醇的比例保持不变、正己烷的比例逐渐减少、水的比例逐渐增大。由图4(A)可知,在相点B、N、O、P、J 对应条件下,南极磷虾总脂质在正己烷-乙醇-水三元体系中能够实现双相分配。由图4(B)可知,在相点B 至相点J 的直线区域内,随着萃取条件的变化,下相脂质得率逐渐降低;在相点B、N 对应条件下,下相脂质得率显著高于其他相点(P<0.05)。由图4(C)可知,在相点B 至相点J 的直线区域内,随着萃取条件的变化,下相脂质中的磷脂含量先升高后趋于稳定;在相点N 对应条件下,下相磷脂含量最高,为(85.51±0.37)%。由图4(D)可知,在相点B 至相点J的直线区域内,随着萃取条件的变化,下相磷脂得率先升高后下降;在相点N 对应条件下,下相磷脂得率最高,达到(98.39±0.38)%,表明磷脂已基本全部被萃取富集于正己烷-乙醇-水三元双相体系的下相。综上,确定相点N 所对应条件为最佳萃取条件,即正己烷-乙醇-水三者体积比为0.275∶0.600∶0.125。
2.3 南极磷虾磷脂的组成分析
制备获得的南极磷虾磷脂12.85 g,经测定磷脂含量为(85.46±0.31)%,这与前述萃取富集工艺研究的结果保持一致。采用本研究优化后的工艺条件进行南极磷虾磷脂的富集,与张千等[13]采用的水化法(磷脂含量70.78%)和魏山山[28]采用的氧化铝柱层析分离法(磷脂含量79.83%)相比效果更优,与魏山山[28]采用的硅胶柱层析分离法(磷脂含量97.77%)和阴法文[29]采用的超临界萃取法(磷脂含量92.81%)相比效果略有不足。本研究所采用的正己烷-乙醇-水三元双相溶剂浸提法能够快速高效地实现南极磷虾磷脂的富集,处理效果理想且未引入有害溶剂,具有较好的规模化应用价值。
南极磷虾磷脂的磷脂组成和脂肪酸组成分析结果见图5 和表2。
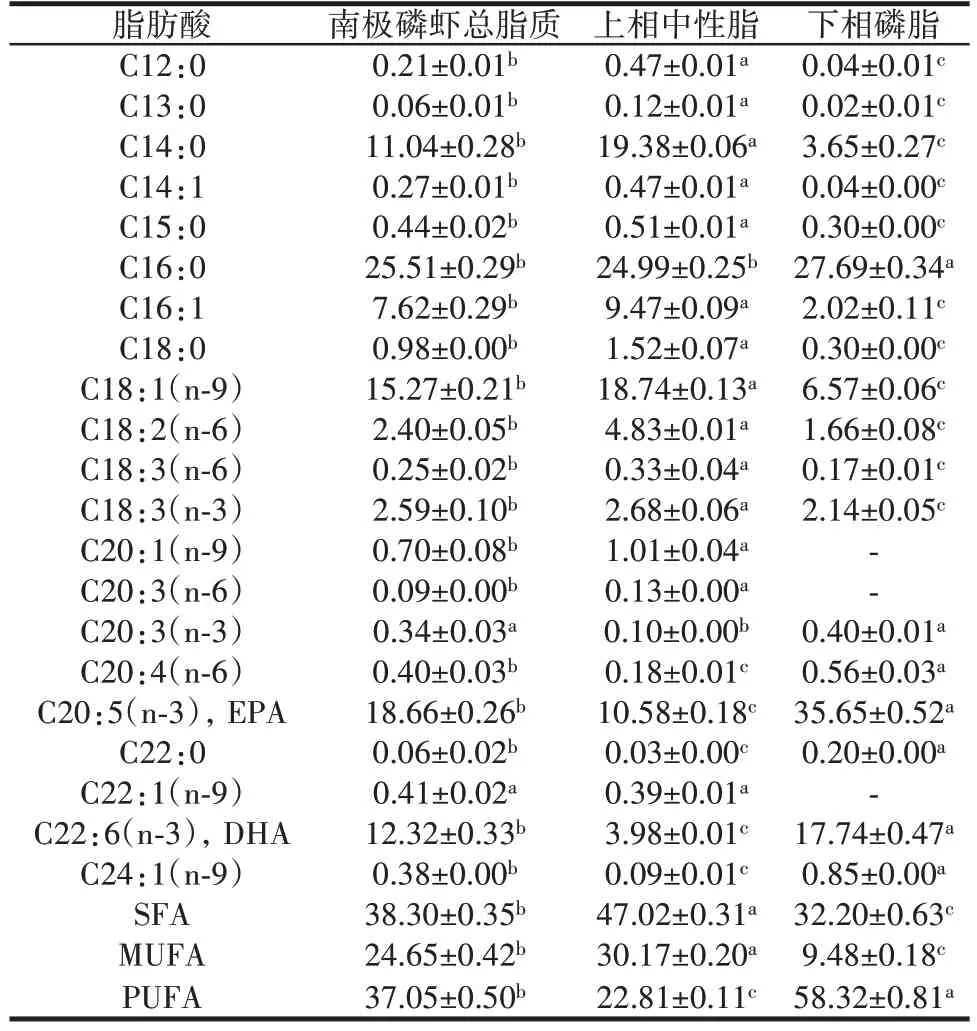
表2 南极磷虾磷脂的脂肪酸组成Table 2 Fatty acid composition of Antarctic krill phospholipids%
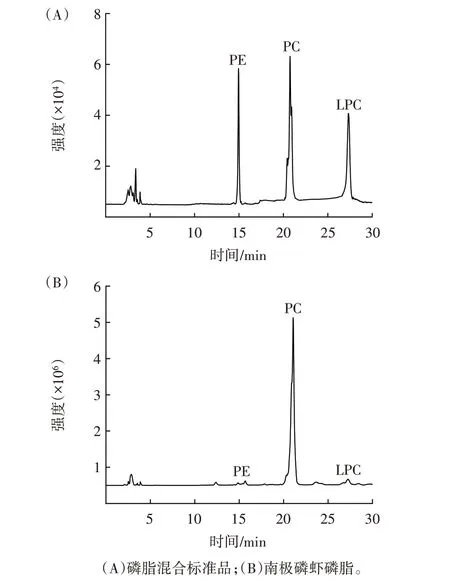
图5 磷脂混合标准品和南极磷虾磷脂的高效液相分离图谱Fig.5 The HPLC-ELSD spectrum of phospholipids standard and Antarctic krill phospholipids
由图5 可知,南极磷虾磷脂主要为PC,含有少量的PE 和LPC;经计算,PC 约占总磷脂含量的(91.29±1.28)%。由表2 可知,南极磷虾磷脂中多不饱和脂肪酸含量丰富且主要为EPA 和DHA,分别占总脂肪酸含量的(35.65±0.52)%和(17.74±0.47)%,以上结果与已有研究报道保持一致[7,19]。此外,通过对比上相中性脂和下相磷脂的脂肪酸组成可知,南极磷虾富含的EPA、DHA 等多不饱和脂肪酸更多地以磷脂型式存在。现有文献指出,与大豆磷脂和卵黄磷脂等陆地食品原料来源的磷脂相比,海洋EPA/DHA 磷脂在防治心脑血管疾病、调节代谢稳态、改善神经系统功能等方面的活性更优[20,30]。南极磷虾磷脂作为典型的海洋EPA/DHA 磷脂,其后续的开发和应用值得重点关注。
3 结论
本研究以解冻后的南极磷虾为原料,对乙醇浸提南极磷虾总脂质以及正己烷-乙醇-水三元双相溶剂萃取富集南极磷虾磷脂的工艺条件进行优化,并对制备获得的南极磷虾磷脂的组成进行分析。工艺研究结果表明,乙醇提取南极磷虾总脂质最优条件为料液比1∶3(g/mL)、浸提温度40 ℃、浸提时间3 h、浸提次数3 次,在此条件下,南极磷虾总脂质得率为(4.69±0.13)%;正己烷-乙醇-水三元双相溶剂从南极磷虾总脂质中萃取富集磷脂的最佳体积比为0.275∶0.600∶0.125,制备获得的南极磷虾磷脂中磷脂含量为(85.46±0.31)%。组成分析结果表明,南极磷虾磷脂主要为PC,含有少量的PE 与LPC;南极磷虾磷脂是典型的海洋EPA/DHA 磷脂,磷脂中EPA 和DHA 的含量分别占总脂肪酸含量的(35.65±0.52)%和(17.74±0.47)%。正己烷-乙醇-水三元双相溶剂浸提法能够快速高效地实现南极磷虾磷脂的富集,具有较好的应用前景。研究结果对于推进南极磷虾冻虾资源合理利用以及新型南极磷虾脂质类高值产品的开发具有积极意义。

