月桂酸淀粉酯Pickering 乳液的制备及负载姜黄素
李佳楠,李玉锋,王小凤,张一凡,3,朱旻鹏,3*
(1.沈阳师范大学粮食学院,辽宁沈阳 110034;2.味之源生物科技(辽宁)有限公司,辽宁沈阳 110042;3.沈阳市粮油深加工重点实验室,辽宁沈阳 110034)
Pickering 乳液是乳状液中的一种,不添加表面活性剂,用固体颗粒吸附于油水界面上,形成单层或多层膜,从而起到稳定乳液的作用。相比于化学表面活性剂,天然固体颗粒稳定的Pickering 乳液具有更好的生物降解性和安全性,可广泛应用于食品、药品及化妆品行业[1-3]。淀粉是一种丰富、环保的天然颗粒,其中大米淀粉资源丰富,廉价易得,颗粒粒径较小,具有制备Pickering 乳液的潜力,但由于其亲水性较强,制得的Pickering 乳液稳定性较差[4]。通过酯化改性提高淀粉疏水性以提高其乳化能力是常用的方法。Wang 等[5]使用辛烯基琥珀酸酐(octenyl succinic anhydride,OSA)对不同晶型淀粉进行改性,结果表明OSA 改性显著改善了淀粉的乳化性能。Wang 等[6]将制得的辛烯基琥珀酸酐(OSA)改性抗性淀粉用作乳化剂,制备的乳液具有良好的乳化性。Li 等[7]使用壬烯基琥珀酸酐(nonenyl succinic anhydride,NSA)对藜麦淀粉进行改性,所得中等取代度的NSA 改性藜麦淀粉在稳定Pickering乳液方面最有效。尽管部分酸酐类酯化剂可对天然淀粉进行疏水改性,但因安全性因素,其在使用上受到一定的限制。脂肪酸作为一种安全无毒的酯化剂,越来越受到研究者的重视。Mirzaaghaei 等[8]采用不同类型的脂肪酸氯化物(fatty acid chlorides,FACs)代替OSA,所得改性淀粉乳化能力与OSA 改性淀粉相似,且具有更短的反应时间,在食品中添加无限制。
月桂酸(lauric acid,LA)是一种两亲性中链饱和脂肪酸,对人体无毒,被列为“一般公认安全”[9]。淀粉分子与LA 酯化后,会引入疏水性LA 长链,兼备亲水亲油性,乳化性显著提高[10]。相比传统方法,淀粉的微波辅助改性技术可有效提高反应速度,提高反应效率,同时可以显著改变天然淀粉的理化特性,提高其消化率,促进乳化并降低其黏度[11]。基于此,本研究以大米淀粉为原料,通过微波辅助合成月桂酸淀粉酯(lauric acid starch ester,LAS),以LAS 颗粒构建Pickering 乳液,研究乳液稳定性,对负载姜黄素的Pickering 乳液进行抗氧化性及模拟体外释放性能分析,以评估LAS制备乳液负载姜黄素的潜力,为脂肪酸改性淀粉作为食品递送体系提供理论依据。
1 材料与方法
1.1 材料与试剂
大米淀粉:安徽省联河米业有限公司;LA:上海麦克林生化科技股份有限公司;中链甘油三酯(mediumchain triglycerides,MCT)、2,2′-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二胺盐[2,2′-biamine-bis-(3-ethylbenzothiazoline-6-sulfonic acid)diamine salt,ABTS]:上海源叶生物科技有限公司;人工胃液、人工小肠液:北京雷根生物技术有限公司;2,2-联苯基-1-苦基肼基(2,2-biphenyl-1-picrylhydrazyl,DPPH):上海金穗生物科技有限公司;ProClean 950 抑菌防腐剂:上海碧云天生物技术股份有限公司;氘代二甲基亚砜:上海西格玛奥德里奇贸有限公司。
1.2 仪器与设备
T25 高速均质机:德国IKA 公司;MAS-ⅡPLUS 常压微波合成/萃取反应器:上海新仪微波化学试剂有限公司;M3000 激光粒度分析仪:英国Malwern 公司;Ascend III 500MHz 核磁共振氢谱仪:德国布鲁克公司;UV-1200S 紫外分光光度计:翱艺仪器(上海)有限公司;DSA100 接触角测量仪:德国KRUSS 公司;ZP-5B压片机:上海天凡药机制造厂;ZQPW-70 恒温振荡箱:天津市莱玻特瑞仪器设备有限公司。
1.3 试验方法
1.3.1 微波辅助LAS 的制备
将10 g 大米淀粉用去离子水配成浓度为45%的淀粉乳。用45 ℃乙醇将LA 和盐酸溶解,其中LA 用量为大米淀粉干基的4%、5%、6%、7%和8%,盐酸用量为大米淀粉干基的0.06%、0.08%、0.10%、0.12%和0.14%,将LA 乙醇溶液加入到制备好的大米淀粉乳中,置于微波反应器中分别在400、500、600、700、800 W 功率下反应10、15、20、25、30 min(反应期间保持机械搅拌),得到LAS。反应结束后,淀粉酯用热乙醇反复洗涤,至洗涤液用AgNO3检测不产生白色沉淀为止。最后将淀粉酯于45 ℃烘干后粉碎过80 目筛,常温下密封保存。
1.3.2 取代度测定
参考陈海龙[10]的方法并稍作修改。在250 mL 锥形瓶中加入1.2 g LAS、3 mL 无水乙醇和70 mL 去离子水,沸水浴中充分混匀20 min 后,随即加入7 mL 0.25 mol/L的NaOH 溶液,搅拌1 h。滴入2~3 滴酚酞指示剂直至液体颜色变为粉红色,将其摇晃均匀,用0.1 mol/L 的标准HCl 溶液滴定至粉红色刚好消失,记录消耗的盐酸体积V1(mL)。空白以原大米淀粉作对照,其余条件不变,记录消耗的盐酸体积V0(mL)。按下列公式计算脂肪酸淀粉酯的取代度(D)。
式中:162 为葡萄糖酐单元(anhydroglucose,AGU)的分子量,g/mol;183 为月桂酸酰基的分子量,g/mol;m为月桂酸淀粉酯样品质量,g;c为盐酸标准溶液的浓度,mol/L。
1.3.3 颗粒粒径测定
制备浓度为2% 的淀粉酯溶液,通过激光粒度分析仪测定颗粒的粒径大小。测定参数:颗粒折射率为1.590,分散剂为水,分散剂的折射率为1.330。
1.3.4 核磁共振氢谱测定
取适量的LAS 溶于氘代二甲基亚砜中,光谱在500 MHz、60 ℃下获得,脉冲角30°,延迟时间10 s,采集时间2 s。
1.3.5 颗粒三相接触角测定
参考Zhang 等[12]的方法。使用压片机将冻干粉末压成直径13 mm、厚度2 mm 的薄片放置于接触角测量仪上,使用注射器将一滴去离子水轻轻滴入薄片表面,使用接触角测量仪的高速摄像机以每秒10 帧的速率记录液滴形状的演变,利用OCA 20 软件将水滴的轮廓数据自动拟合到拉普拉斯-杨方程中,以确定接触角。
1.3.6 Pickering 乳液的制备
以一定浓度的LAS 水溶液作水相,中链甘油三酯(medium-chain triglycerides,MCT)作油相,将油相水相混合,使用高速均质机在转速13 000 r/min 下均质2 min,得到乳液,于乳液中加入ProClean 950 抑菌防腐剂以防止微生物生长,室温下保存。
1.3.7 Pickering 乳液乳化指数测定
将制备好的Pickering 乳液放置于带有刻度具塞试管中,观察室温下Pickering 乳液,通过乳化指数来表征乳液的稳定性,乳化指数(E,%)按下列公式计算。
式中:H0为乳化层体积,mL;H为乳液总体积,mL。
1.3.8 乳液稳定性
1.3.8.1 LAS 添加量对Pickering 乳液稳定性的影响
选取取代度为0.016 7 的LAS 为乳化剂,MCT 为油相,油相体积为50%,LAS 添加量分别为1.0%、1.5%、2.0%、2.5%、3.0%、3.5%,以1.3.6 方法制备乳液,记录不同时间的乳化指数。
1.3.8.2 油相体积对Pickering 乳液稳定性的影响
选取取代度为0.016 7 的LAS 作为乳化剂,MCT做油相,LAS 添加量为2.0%,油相体积分别取20%、30%、40%、50%、60%、70%,以1.3.6 方法制备乳液,记录不同时间的乳化指数。
1.3.8.3 LAS 的取代度对Pickering 乳液稳定性的影响
选取不同取代度(0.012 1、0.014 7、0.015 1、0.016 7)的LAS 作为乳化剂,MCT 作为油相,油相体积为50%,LAS 添加量为2.0%,以1.3.6 方法制备乳液,记录不同时间的乳化指数。
1.3.9 抗氧化性测定
1.3.9.1 负载姜黄素Pickering 乳液的制备
将一定量姜黄素溶于适量MCT 中,8 000 r/min 离心5 min,上清液作油相。油相体积为60%,LAS 颗粒(取代度0.016 7)添加量为2.5%,其余方法同1.3.6,得到姜黄素Pickering 乳液。
1.3.9.2 DPPH 自由基清除率的测定
配制浓度为0.2 mmol/L DPPH 乙醇溶液,将姜黄素Pickering 乳液按不同添加量(0.1、0.2、0.3 mL 和0.4 mL)与2 mL DPPH 乙醇溶液充分混合,避光反应30 min,反应结束后,将测试样品于517 nm 波长下测量吸光度A,用无水乙醇作对照,测量其吸光度A0。DPPH 自由基清除率(R,%)计算公式如下。
1.3.9.3 ABTS+自由基清除率的测定
将7 mmol/L 的ABTS 溶液和2.45 mmol/L 过硫酸钾溶液等体积混合,避光反应12 h 制得ABTS 溶液。使用前用乙醇稀释ABTS 溶液,使其在734 nm 处的吸光度为0.70±0.02。将姜黄素Pickering 乳液按不同添加量(30、40、50、60 μL)与4 mL ABTS 溶液充分混合,避光反应30 min,反应结束后,将待测样品置于734 nm 处测定其吸光度A,用无水乙醇作对照,其测量吸光度A0。ABTS+自由基清除率(Q,%)计算公式如下。
1.3.10 姜黄素乳液体外消化测定
1.3.10.1 姜黄素包埋率测定
包埋率参考Zeng 等[13]的方法稍作修改。将姜黄素乙醇溶液配制成不同浓度梯度标准液进行标准曲线的绘制(Y=0.156 8X+0.009 5,R2=0.999 6),其中X和Y分别对应姜黄素浓度和吸光度。将一定量姜黄素溶于MCT 中用作油相,取10 mL 油相用无水乙醇稀释100 倍,于425 nm 波长下测定吸光度,结合标准曲线计算油相中姜黄素的含量m0(mg);另取9 mL 油相以1.3.9.1 方法制备乳液,收集10 mL 姜黄素乳液并加入3 mL 无水乙醇于恒温振荡箱中以200 r/min 振荡5 min进行破乳,以8 000 r/min 的速度离心10 min,收集上清液并用无水乙醇稀释100 倍,紫外分光光度计于425 nm 波长下测量吸光度,计算乳液中姜黄素的含量m(mg),空白用水代替乳液。根据以下公式计算包埋率(P,%)。
1.3.10.2 姜黄素乳液体外模拟消化
参考吴唯娜等[14]的方法并作修改。模拟胃消化:姜黄素Pickering 乳液与人工胃液等体积混合,调节混合液的pH 值为2,置于37 ℃恒温振荡箱中以100 r/min的速度连续振荡2 h,在不同时间段(0、30、60、90、120 min)取消化液以10 000 r/min 的速度离心分离10 min,取上清液并记录体积。取5 mL 上清液与5 mL 无水乙醇涡旋混匀1 min,用紫外分光光度计在418 nm 处测混合液吸光度,根据标准曲线(Y=0.156 8X+0.009 5,R2=0.999 6)计算姜黄素含量,以得出姜黄素释放量。模拟肠消化:将姜黄素Pickering 乳液与人工肠液等体积混合,调节pH 值为7,后续操作与模拟胃消化步骤相同,测定姜黄素含量。姜黄素释放率(C,%)的计算公式如下。
式中:A为最初添加到消化系统中的姜黄素的量,mg;A1为消化过程中不同时间下的姜黄素的量,mg。
1.4 数据分析
本研究试验重复测定3 次,采用SPSS 25 软件处理试验数据并进行数据分析;采用Origin 2021 软件绘制图表。
2 结果与分析
2.1 取代度对LAS 粒径的影响
图1 为不同取代度LAS 颗粒的粒径分布。
由图1 可知,不同取代度的LAS 粒径大多分布在10 μm 左右,还有部分颗粒分布在45 μm 左右,呈双峰分布,这可能是由于原淀粉中含有A 型淀粉(直径>10 μm)和B 型淀粉(直径≤10 μm)[15-16],与LA 发生酯化反应时均被引入疏水性长链。月桂酸淀粉酯的颗粒粒径随着取代度的增加而增加,说明引入更多疏水基团导致LAS 粒径变大。当取代度为0.014 7 时,LAS 颗粒的体积平均直径(D4,3)为21.30 μm,平均粒径(D50)为10.30 μm,取代度为0.016 7 时,D4,3为21.90 μm,D50为10.75 μm,取代度对LAS 粒径的影响并不明显,这可能是因为所选LAS 颗粒样品的取代度都较低。
2.2 核磁共振氢谱分析
图2 为LAS 的核磁共振氢谱图。
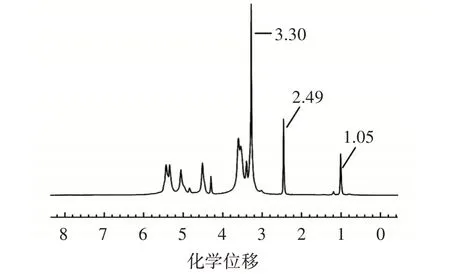
图2 LAS 的核磁氢谱图Fig.2 Nuclear magnetic hydrogen spectrum of lauric acid starch ester
由图2 可知,化学位移2.49 和3.30 处有较强峰出现,分别为DMSO-d6的质子峰和残留的H2O 的质子峰,化学位移5.5、5.4、5.1 和4.5 的为原大米淀粉的OH-3、OH-2、H-1 和OH-6 的4 个质子峰,化学位移3.6 附近的吸收峰为原大米淀粉的H 质子峰[17]。当LA 和大米淀粉发生酯化反应时酯化链上的甲基末端会存在3 个质子,化学位移0.8 处的峰是月桂酰基末端甲基氢(H-10)的质子峰、酰基上残余氢(H-9)的质子峰位于化学位移1.2 附近、1.05 的吸收峰是其他亚基基团的氢核吸收峰[18],在化学位移0.8~2.2 之间存在的吸收峰说明淀粉与LA 发生了酯化反应。
2.3 颗粒接触角分析
研究表明,固体颗粒的三相接触角越接近90°,乳化性能越好,同时,固体颗粒从油水界面脱离所需要的能量就越高,制得的乳液稳定性越好[19]。大米淀粉及LAS 的接触角见图3。

图3 大米淀粉及LAS 的接触角Fig.3 Contact angle of rice starch and lauric acid starch ester
由图3 可知,A 为原大米淀粉,接触角θ为53.0°,B、C 分别是取代度0.014 7、0.016 7 的LAS 颗粒,接触角θ分别为80.2°、83.0°,随着LAS 取代度的增加,颗粒接触角也增大,接近90°。结果表明引入月桂酸疏水基团后大米淀粉的疏水性能明显改善。
2.4 Pickering 乳液稳定性分析
2.4.1 LAS 添加量对Pickering 乳液稳定性的影响
图4 为不同LAS 添加量对Pickering 乳液稳定性的影响。
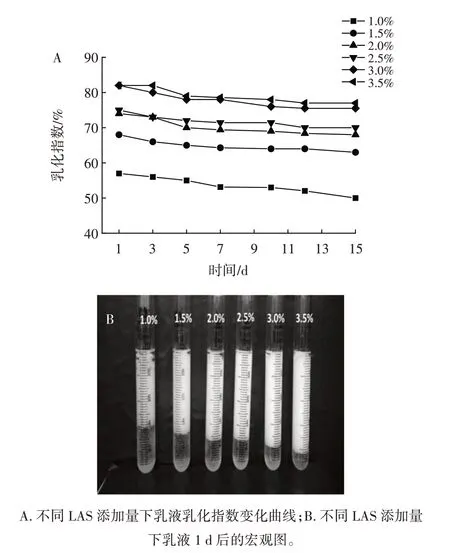
图4 不同LAS 添加量对Pickering 乳液稳定性的影响Fig.4 Effect of the amount of lauric acid starch ester on the stability of Pickering emulsion
由图4 可知,LAS 在添加量为1.0%~3.5% 的条件下,均能形成一定体积的乳液,乳液体积随LAS 添加量的增加而增大,表现出良好的乳化能力。1 d 后可以明显看出随着LAS 添加量的增加,乳化层体积逐渐变大,储存15 d 后,乳液体积略有降低,乳液表现出较强的稳定性,LAS 添加量越大,乳液稳定性越强。这说明LAS 颗粒形成Pikcering 乳液需要满足一定数量要求,足量的LAS 可吸附在油水界面,形成物理屏障,维持乳液稳定性。
2.4.2 油相体积对Pickering 乳液稳定性的影响
不同油相体积对Pickering 乳液稳定性的影响见图5。
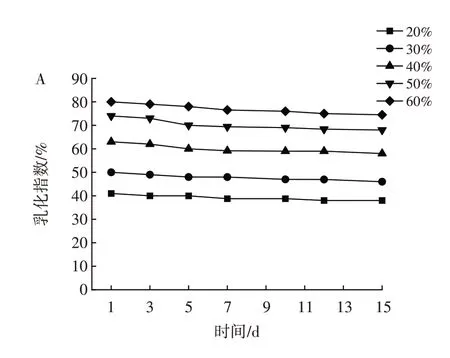
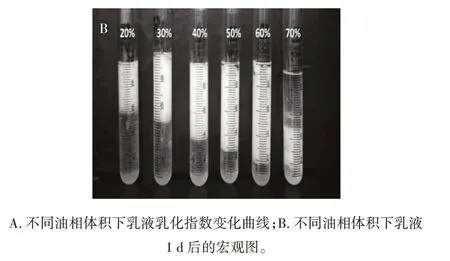
图5 不同油相体积对Pickering 乳液稳定性的影响Fig.5 Effect of oil phase volume on the stability of Pickering emulsion
由图5 可知,当油相体积从20%增加到60%时,乳化层体积不断增加,乳液乳化指数增大,15 d 后均表现出较好的稳定性。如图5B 所示,当油相体积增加到70% 时,有较多的油相析出,无法形成稳定的乳液。其中,油相体积为60%时,形成乳液的体积最大,乳化指数为80%,此时的油水比最佳。这说明LAS 构建Pickering 需要合适的油水相比,过高和过低均不利于乳液的形成和稳定,这与田亚超[20]的研究结果类似。
2.4.3 LAS 取代度对Pickering 乳液稳定性的影响
LAS 取代度对Pickering 乳液稳定性的影响见图6。
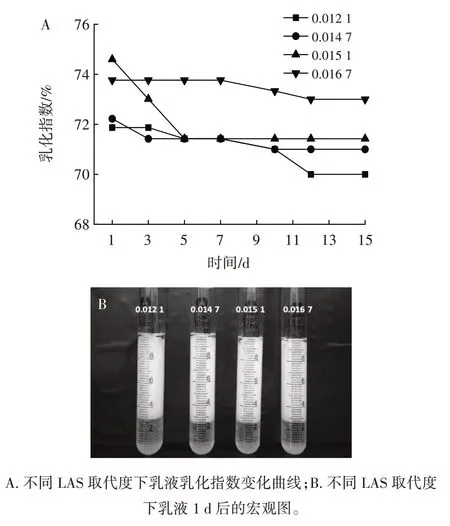
图6 LAS 取代度对Pickering 乳液稳定性的影响Fig.6 Effect of degree of substitution of lauric acid starch ester on the stability of Pickering emulsion
由图6 可知,不同取代度LAS 稳定的Pickering 乳液的乳化指数相差不大,这可能是由于LAS 样品取代度差异不明显。随着储藏时间的延长,乳化指数均不同程度的降低,取代度越大,其制备的乳液乳化稳定性越好[21]。当取代度为0.016 7 时,1 d 后乳液乳化指数为73.76%,15 d 后乳化指数仍为73%,表现出良好的稳定性。这可能是由于取代度提高增强了LAS 颗粒的疏水性,使LAS 颗粒可以更稳定地吸附于油水界面,从而增强乳液的稳定性,这与颗粒三相接触角的结果一致。
2.5 姜黄素乳液抗氧化性分析
2.5.1 DPPH 自由基清除率
姜黄素具有抗氧化功能,是对人体健康非常重要的多酚。但是由于其不易溶于水且本身极易受环境影响而降解,使得姜黄素在人体中的生物利用率降低,因此使用乳液对其进行包埋可有效提高此类活性物质的利用率[22],将姜黄素嵌入Pickering 乳液中,可以有效提高其在消化液中的分散性,同时乳液液滴周围的紧密界面可隔离空气,对姜黄素起到屏障保护作用[23]。
本研究由LAS 制备的Pickering 乳液中姜黄素包埋率达68.00%。DPPH 自由基与抗氧化剂发生反应转移电子,从而清除自身自由基。通过测量DPPH 溶液的吸光度变化,可以评估待测物质对DPPH 自由基的清除能力,进而体现其抗氧化能力[24]。不同Pickering乳液用量对DPPH 自由基的清除作用见图7。
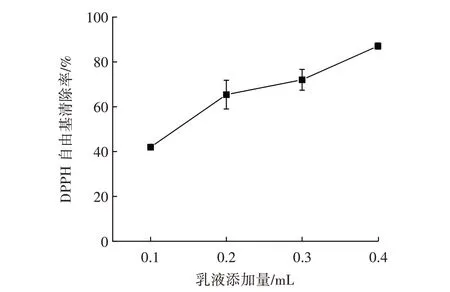
图7 不同Pickering 乳液用量对DPPH 自由基的清除作用Fig.7 Scavenging of different Pickering emulsions against DPPH free radical
由图7 可知,LAS 制备的姜黄素Pickering 乳液具有清除DPPH 自由基的能力,随着乳液添加量的增加,LAS 制备的乳液DPPH 自由基清除率从41.98% 增加到87.08%,乳液表现出较好的抗氧化活性,此结果与Li 等[25]的研究结果一致。
2.5.2 ABTS+自由基清除率
由于单一方法无法真正评估乳液抗氧化性,且DPPH 法反应时间较长,为了更加准确评价姜黄素乳液的抗氧化性,使用了ABTS+自由基清除法评价姜黄素Pickering 乳液的抗氧化性[26]。不同Pickering 乳液的添加量对ABTS+自由基的清除作用见图8。
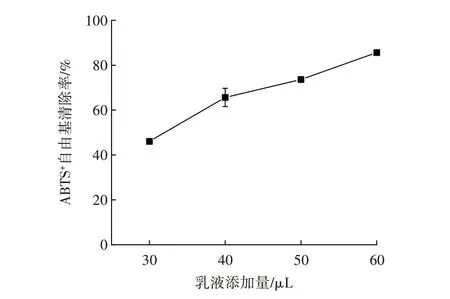
图8 不同Pickering 乳液的添加量对ABTS+自由基的清除作用Fig.8 Scavenging of different Pickering emulsions against ABTS+free radical
由图8 可知,随着乳液添加量的增加,LAS 制备的乳液ABTS+自由基清除率从46.06% 增加到85.62%。因此,由LAS 制备的姜黄素Pickering 乳液对DPPH 自由基和ABTS+自由基均有清除作用,这可能因为DPPH和ABTS+自由基等疏水自由基与姜黄素分子的疏水区域相互作用,随着乳液中姜黄素含量的增加,相互作用也在增加,从而增强对自由基的清除能力[27]。
2.6 体外消化分析
经过消化的乳液可以逐渐释放姜黄素,使姜黄素在胃肠道里发挥抗氧化、抗炎等功能[28],同时姜黄素的释放速率可在一定程度上反映乳液在不同条件下对疏水性功能物质的递送能力。姜黄素乳液在胃肠液中姜黄素释放率见图9。
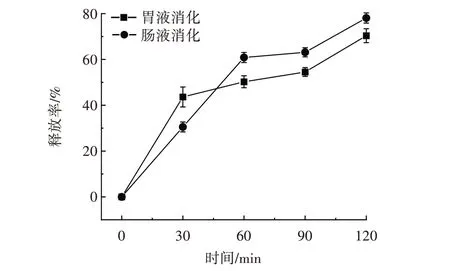
图9 姜黄素乳液在胃肠液中的姜黄素释放率Fig.9 Release of curcumin emulsion in gastrointestinal fluid
由图9 可知,在胃液消化和肠液消化的条件下,前30 min,乳液对姜黄素的释放均存在突释现象,这可能是由于附着于LAS 颗粒表面的姜黄素迅速释放。胃液消化阶段,30 min 以后姜黄素释放速度减慢,这是由于乳液内部的姜黄素开始缓慢释放[29],Pickering 乳液在消化时间为90 min 时姜黄素释放率为54.51%。当胃部消化120 min 时,LAS 制备的Pickering 乳液中姜黄素的释放率达到最大,为70.37%。在肠液中,随着消化时间的延长,姜黄素的释放量逐渐增加,在前60 min 时,姜黄素释放速率较大,释放率为60.85%,60 min 后姜黄素释放速度较慢,在120 min 时,姜黄素释放率为78.09%。姜黄素Pickering 乳液在肠液中的释放率高于胃液中的释放率,这主要是由于环境pH 值的改变,导致肠液中乳液破乳较严重,使得姜黄素释放速度加快。
3 结论
LA 与大米淀粉酯化后,能显著提高颗粒疏水性,形成稳定的水包油型Pickering 乳液。乳液稳定性受LAS 取代度、添加量和油相体积影响。使用取代度为0.016 7 的LAS,添加量为3.5%、油相体积为60%时制备的乳液最为稳定,储存15 d 后仍能保持较高乳化稳定性。LAS 构建的Pickering 乳液可负载姜黄素,其包埋率为68.00%,姜黄素Pickering 乳液对DPPH 和ABTS+自由基均有较强的清除能力,随着清除率随乳液用量的增加而增加,对DPPH 自由基清除率为87.08%,ABTS+自由基清除率为85.62%,表现出良好的抗氧化特性。模拟胃肠消化结果表明,Pickering 乳液包封姜黄素可在胃部和肠道有效释放,前30 min 存在突释现象,随后释放速度降低,胃中的释放率低于肠道,120 min时的释放率分别为70.37%、78.09%,证明淀粉月桂酸酯制备的Pickering 乳液可作为递送疏水性功能物质姜黄素的有效系统。本研究为丰富淀粉脂肪酸酯的应用、构建新型食品级功能物质乳液递送系统提供了理论依据。

