产果胶酶曲霉菌株的筛选、果胶酶酶学性质及在香蕉果汁生产中的应用

摘要 本研究从土壤中分离筛选得到一株产果胶酶的丝状真菌XYYWZSP4,用以橘子皮粉为碳源的液体培养基培养5 d后,培养液中的果胶酶活力为0.78±0.01 U/mL。观察该菌株在察氏培养基平板上的形态和分生孢子梗的形态,鉴定其为曲霉。测得该菌株液体培养产生果胶酶的酶学性质:最适作用pH值为4.5,最适作用温度为60 ℃,在pH值3.0~8.0范围内稳定(残余酶活力高于90%),在不高于40 ℃环境下稳定。该果胶酶具有优良的金属离子相容性,在所有供试金属离子中,仅5 mM钙离子抑制该酶的酶活力。将该果胶酶应用于实验室试验香蕉果汁生产中,得到果汁产率达(89.85±1.57)%,果汁中还原性物质含量达(11.53±0.09) g/L。
关键词 果胶酶;曲霉;酶学性质;香蕉果汁
中图分类号 TS255.44 文献标识码 A
文章编号 1007-7731(2024)08-0101-06
Screening of pectinase producing Aspergillus strain, enzymatic properties of pectinase and its application in banana juice production
XIAN Yingying
(Wuzhou University, Wuzhou 543002, China)
Abstract A filamentous fugal strain XYYWZSP4 producing pectinase was isolated from soil sample, and (0.78±0.01) U/mL of pectinase activity in culture broth was produced by using orange peel powder as sole carbon source. It was identified as Aspergillus sp. by observation of colony characters on Czapek medium plate and conidiophore. The enzyme property of its pectinase was determined as following: optimal pH at 4.5, optimal temperature at 60 ℃, stable at pH range of 3.0-8.0 (with residual enzyme activity higher than 90%); stable at temperature not higher than 40 ℃. The pectinase had excellent metal ions compatibility with only inhibition effect of calcium at 5 mM among all tested metal ions. When the pectinase was applied in banana juice production, the juice yield of (89.85±1.57)% and reducing material concentration of (11.53±0.09) g/L were obtained.
Keywords pectinase; Aspergillus; enzyme property; banana juice
果胶是一种来自植物的生物大分子,又称聚半乳糖醛酸,其主链为通过α-(1,4)糖苷键连接的半乳糖醛酸聚合体,部分半乳糖醛酸可能会被甲酯化或被小分子单糖糖基化[1]。果胶在植物体内具有极其重要的作用,其主要存在于中胶层,可以将相邻细胞黏连;亦存在于细胞壁中,参与构成细胞壁[2]。果胶酶是降解果胶的酶的统称,主要分为降解修饰半乳糖醛酸残基的基团的酶和降解主链上α-(1,4)糖苷键的酶,其中,降解主链上α-(1,4)糖苷键的酶被分为随机降解内部键和降解外部键的酶,随机降解内部键的酶按照降解方式被分为以水解方式降解的内切聚半乳糖醛酸酶和以裂解方式降解的果胶裂合酶[3]。
在水果果汁生產中起主要作用的果胶酶为内切聚半乳糖醛酸酶,因为其最适作用pH值为酸性,而水果果汁的自然pH值亦为酸性[4]。在果汁中加入果胶酶可以促进水解果胶,以降低果汁黏度和提高果汁的产率,因此,果汁工业生产中常广泛加入工业果胶酶制剂[5]。目前的工业果胶酶制剂是用黑曲霉菌株生产的Pectinex XXL和Pectinex color[6],可供果汁企业选择的工业果胶酶制剂品种较少。由于各种水果果汁的pH值不一致,因而无法完全保证工业果胶酶制剂能适用于所有水果果汁的生产[5]。
本研究从土壤中分离丝状真菌,并将菌株进行液态培养。通过测定培养液中的果胶酶活力获得产果胶酶的菌株,并鉴定其为曲霉属真菌。测定菌株所产果胶酶的酶学性质,并检验其在果汁生产中的应用效果。
1 材料与方法
1.1 供试材料
1.1.1 试验药品与试剂 聚半乳糖醛酸和半乳糖醛酸均购买自上海源叶生物科技有限公司(化学纯)。橘子皮粉为沙糖橘果皮经烘箱烘干,用小型植物组织粉碎机粉碎,过60目筛子分离后所得粉末。
1.1.2 试验仪器 往复式恒温摇床(上海智城分析仪器制造有限公司),数显恒温水浴锅(江苏省金坛市医疗仪器厂),超净工作台(苏州安泰空气技术有限公司),低温冰箱(中科美菱低温科技股份有限公司),Olympus Cx21光学显微镜(Olympus株式会社),微波炉(青岛胶南海尔微波制品有限公司),离心机(德国Eppendorf有限公司)。
1.2 试验方法
1.2.1 样品采集与微生物分离 在梧州学院内采集花圃土壤样品,将土壤置于灭菌后的水中充分震荡获得菌悬液。将菌悬液用灭菌后的水以10倍为梯度进行稀释,每个稀释梯度所得菌悬液取50 μL涂布于仅以橘子皮粉为碳源的分离培养基平板上,在28 ℃温度下培养5 d后观察微生物的生长情况。
培养基配方:橘子皮粉10 g/L,胰蛋白胨5 g/L,K2HPO4 3 g/L,(NH4)2SO4 2.5 g/L,MgSO4·7H2O 0.2 g/L,FeSO4 0.025 5 g/L,pH 5.5,琼脂粉2%。
1.2.2 微生物复筛 将能在分离培养基平板上生长的微生物接种至筛选培养基中(筛选培养基为不含琼脂粉的分离培养基),在28 ℃、180 rpm的摇床中培养5 d,测定培养液中的果胶酶活力,筛选出产果胶酶的微生物。
1.2.3 形态观察 将该菌株接种于察氏培养基平板,在28 ℃培养5 d后观察。用光学显微镜采用10倍目镜和40倍物镜检查孢子梗和孢子形态。
1.2.4 果胶酶活力的测定 使用3,5-二硝基水杨酸法测定果胶酶活力,试剂配方参考文献[7]。酶活力的测定体系为350 μL含有0.5%(W/V)聚半乳糖醛酸的0.1 M柠檬酸-Na2HPO4缓冲液+50 μL待测果胶酶,反应30 min后加入800 μL 3,5-二硝基水杨酸试剂,沸水浴显色5 min后用自来水冷却,11 000 rpm离心1 min,使残余的聚半乳糖醛酸沉淀,取上清液选择540 nm波长比色。以半乳糖醛酸单体为标准物建立标准曲线,1 U酶活力定义为1 min内,使底物水解释放出1 μmol还原性物质(以半乳糖醛酸计)所需的酶量。
1.2.5 酶学性质的测定 最适作用条件:(1)最适作用酸碱度为在pH值3.0~6.5范围内测定果胶酶的酶活力。酶活力最高处则为最适作用酸碱度。(2)最适作用温度为在不同温度下测定果胶酶的酶活力,酶活力最高处的温度即为最适作用温度。
耐受性测试具体如下。(1)酸碱耐受性。将果胶酶置于0.1 M不同酸碱度下,在25 ℃保温24 h后再测定残余酶活力,以未受酸碱处理的果胶酶的酶活力作为完整酶活力,受酸碱处理的果胶酶的剩余酶活力折算为百分比。所用缓冲液为柠檬酸-Na2HPO4(pH 3.0~7.0)、Tris-HCl(pH 7.0~9.0)和甘氨酸-NaOH(pH 8.5~12.0)。(2)温度耐受性。将果胶酶置于不同温度下保温15、30、45和60 min后测定残余酶活力,以未受热处理的果胶酶的酶活力作为完整酶活力,受热处理的果胶酶的剩余酶活力折算为百分比。(3)金属离子对酶活力的影响。将不同浓度的不同金属离子加入反应体系,測定果胶酶在额外添加金属离子情况下的酶活力。将没有额外添加金属离子时的酶活力作为标准,有额外添加金属离子时的酶活力作为相对酶活力。
1.2.6 果胶酶在香蕉果汁中的应用效果测定 将香蕉剥皮,果肉切碎后与2倍于果肉重量的灭菌水混合,用果浆机制浆30 s。在果浆中加入0.25 U/mL果胶酶后混匀,静置于50 ℃环境下,保温1和12 h后所得果浆用于分析。对照组为以等量体积的灭菌水代替果胶酶,亦在50 ℃环境下保温1和12 h。保温后,将果浆在11 000 rpm离心2 min,使未被果胶酶水解的成分沉淀,上清液即为制得的果汁。测量果汁的体积,将果汁的体积除以果浆的体积即为出汁率;测定果浆和果汁中还原性物质的量。
2 结果与分析
2.1 微生物的分离、筛选与鉴定
从土壤样品中分离得到一株能在以橘子皮粉为唯一碳源的培养基平板上生长的丝状真菌(编号XYYWZSP4),在将其接种至液体培养基培养后,测定得出其培养液中含有果胶酶(0.78±0.01) U/mL。
该菌株形态学观察结果如图1所示。由图1可见,该菌株在察氏培养基平板上生长10 d后菌落为圆形,直径为3.0 cm(图1A)。培养10 d后的菌落表面平整,质地均匀,较为疏松。菌株产生的黄色色素扩散到平板中,把平板染成黄色。菌落边缘整齐,无锯齿、褶皱和隆起等形状。菌落边缘为白色,为生长期较短的菌丝体;菌落内部为黄色,为生长期较长的菌丝体。通过显微观察,菌株的气生菌丝末端膨大成球形,球面着生分生孢子瓶梗,瓶梗末端产生圆形的分生孢子(图1B),这是曲霉属的显著特征之一[8]。结合菌株培养形态和孢子、孢子梗形态可以鉴定XYYWZSP4为曲霉属真菌
2.2 果胶酶酶学活力与性质的测定
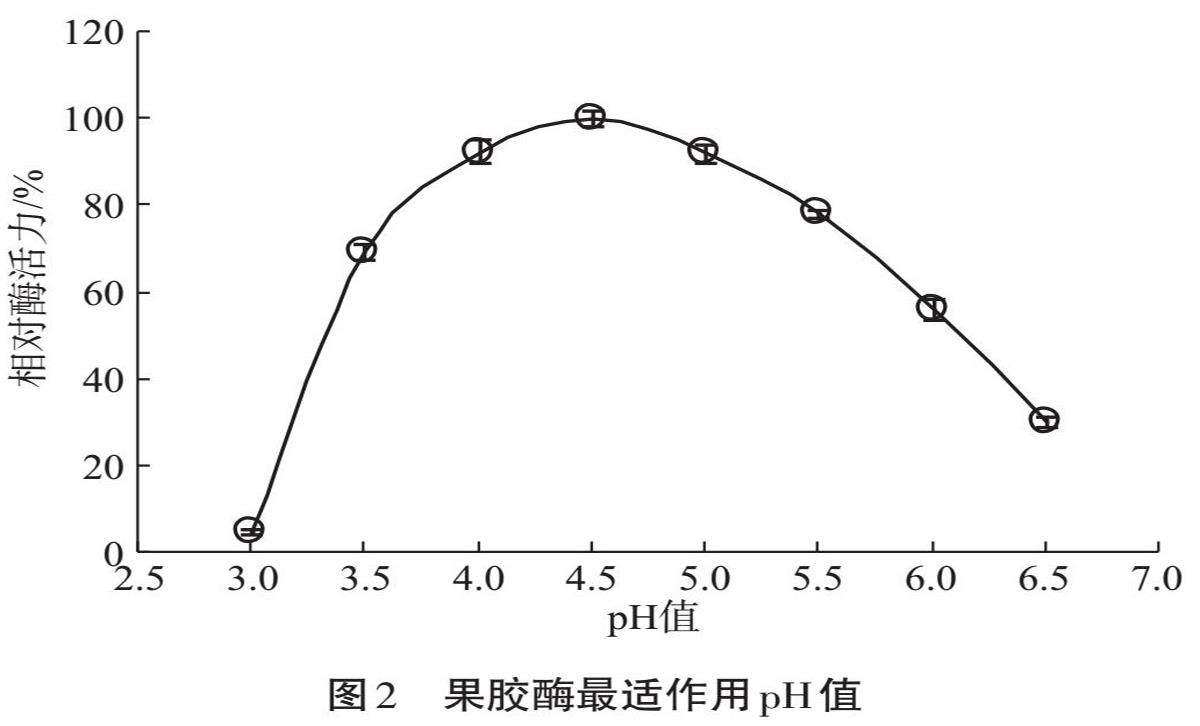
该果胶酶最适作用pH值如图2所示。当环境中pH值在3.0时,酶活力仅为(4.92±0.42)%,其pH值在4.5时酶活力最高,并且在pH值4.0和5.0时相对酶活力分别为(92.52±2.72)%和(92.06±1.95)%。结果显示该果胶酶可在酸性环境中发挥作用。同时,聚半乳糖醛酸酶的催化氨基酸的解离环境为酸性,而果胶裂合酶则与之相反为碱性,因此可以确定该菌株可产聚半乳糖醛酸酶。
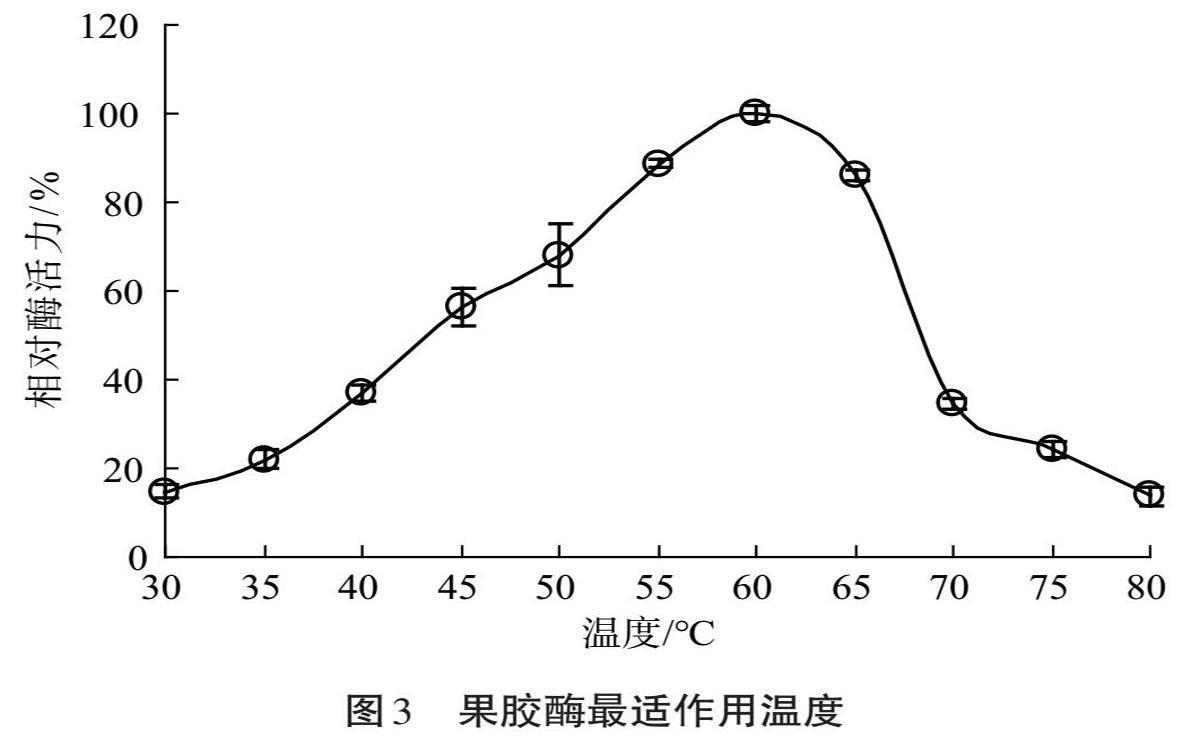
该果胶酶最适作用温度如图3所示。当环境温度为30 ℃时,酶活力仅为(14.68±1.48)%。当温度上升到60 ℃时酶活力达到最高值,因而其最适作用温度为60 ℃。这说明该果胶酶适宜在中温环境下发挥作用,可用于果汁生产;不适用于需要在室温乃至低于20 ℃环境下进行的以果汁为原料的果酒发酵。
该果胶酶pH值耐受性如图4所示。该果胶酶在酸性下的pH耐受性较好。在pH值3.0~8.0保温24 h后(25 ℃下),其剩余酶活力高达90%。对于用途为生产果汁的果胶酶,在酸性环境下保持酶活力稳定是一项非常重要的特性,因为果汁的自然pH值为酸性。该果胶酶的酸稳定特性可确保其在果汁生产中稳定发挥作用。
该果胶酶温度耐受性如图5所示。该果胶酶在40 ℃环境下稳定性较好,保温1 h后酶活力无损失。在45 ℃环境下稳定性稍差,保温1 h后酶活力剩余(82.19±2.02)%。在50 ℃环境下保温1 h后酶活力剩余(43.37±3.43)%。这说明该果胶酶可以在不高于40 ℃的环境下长期发挥作用,但在40 ℃时不能发挥全部酶活力(图3),因此在实际应用中可根据用酶成本来适当调整使用温度。同时,货架期是酶制剂生产中需要考虑的因素,该果胶酶可以在不高于40 ℃的环境下保持稳定,即其可以室温保存,无须置于冷库中保存,有利于节省成本。
金属离子对果胶酶活力的影响如表1所示。Na2EDTA不影响该果胶酶的酶活力,表明该果胶酶发挥酶活力时不需要金属离子作为辅助。在所有供试金属离子中,仅5 mM钙离子抑制该酶活力。1.0、2.5和5.0 mM的Co2+、Fe2+、Fe2+和Mn2+均促进该果胶酶的酶活力,而K+、Li+、Mg2+和Na+在1.0、2.5和5.0 mM时均对酶活力无影响。这说明该果胶酶对多数受试金属离子均有较好的相容度。对于果胶酶来说,与金属离子有好的相容度是非常重要的优点,因为水果是植物的一部分,而金属离子是植物生长的必要元素,存在于植物体内。
2.3 果胶酶应用于香蕉果汁脱胶分析
果胶酶应用于香蕉果汁脱胶结果如图6所示。对照组经过离心后沉淀的表面质地疏松,有明显的胶状物质(图6A、C),此时的果汁产率为(79.81±2.74)%,还原性物质浓度为(9.48±0.21) g/L。加果胶酶处理1 h后离心所得沉淀的表面已经没有疏松物质,说明果胶开始被降解(图6B),此时果汁产率为(82.60±0.64)%,还原性物质浓度为(9.78±0.02) g/L。加果胶酶处理12 h后(图6D)离心所得沉淀的体积非常小,此时果汁产率为(89.85±1.57)%,还原性物质的浓度为(11.53±0.09) g/L。这说明该酶可用于果汁的水解,不仅可以实现对果汁的增产,还可以将胶体水解和促进细胞崩解、释放细胞内成分,以增加果汁的营养。
3 结论与讨论
该果胶酶在pH值4.0~5.0范围内发挥出高于90%的相对酶活力,符合酸碱度处于该区间内的水果果汁制造要求,如梨(pH值4.8)[9]、苹果(pH值4.0)[10]、芭蕉(pH值4.71)[11]、火龙果(pH值4.56)[11]和芒果(pH值4.52)[11]等。大多数水果果汁的酸碱度处于pH值4.0~5.0,因此该研究对象果胶酶比一个来自Achaetomium sp. Xz8的果胶酶(最适作用pH值6.0)[12]有更广阔的应用范围。该果胶酶在pH值3.0~8.0范围内的稳定性较好,可确保该酶能在酸性范围内应用。该果胶酶的最适作用温度(60 ℃)与一个来自酿酒酵母的果胶酶[13]相同。该果胶酶的热稳定性优于一个来自黑曲霉的果胶酶[9]。
研究表明,果胶酶的酶活力广泛被钙离子(Ca2+)抑制,例如,1 mM的Ca2+将来自Bispora sp. MEY-1的果胶酶的酶活力抑制至(56.2±1.7)%,5 mM的Ca2+将酶活力抑制至(4.6±2.9)%[10]。此外,一个来自Achaetomium sp. Xz8的果胶酶[12]、镰刀菌Q7-31T果胶酶[14]、皮落青霉GYS-6果胶酶[15]亦可被Ca2+抑制。相对来说,XYYWZSP4果胶酶具有更好的Ca2+相容性。Cu2+在1.0、2.5和5.0 mM時均不抑制XYYWZSP4果胶酶的酶活力,这明显优于来自Bispora sp. MEY-1的果胶酶[(1 mM的Cu2+将果胶酶的酶活力抑制至(22.2±2.9)%,5 mM时完全抑制)][9]和来自草酸青霉的果胶酶(1和2 mM的Cu2+分别将果胶酶的酶活力抑制至(25.0±0.9)%和(19.7±4.6%)[11]。K+、Li+、Mg2+和Na+在1.0、2.5和5.0 mM时均对该果胶酶酶活力无影响,亦是优良的性质,因为金属离子广泛存在于植物体内,例如,香蕉含有多种金属离子,因此果胶酶需要优良的金属离子相容性[16]。
获得果胶酶的目的是将其应用于水果果汁脱胶[17-18]。在测定酶活力时使用的底物聚半乳糖醛酸是经过提纯所得的,并且测定系统内化学成分简单,因此不能充分表明果胶酶的应用潜力[19-20]。实际上,果汁中的多种因素都有可能影响果胶酶的应用效果,例如,果汁的起始pH值、金属离子或其他物质以及果胶的结构等。目前已有研究将果胶酶应用于香蕉果汁的生产试验,但暂未报道果胶酶对其还原性物质增量的影响,故本研究对香蕉果汁的生产有一定的参考意义[4,11]。
综上,本研究从土壤中获得了一株产果胶酶的曲霉菌,并测定了该果胶酶的多项酶学性质,最终将该果胶酶应用于香蕉果汁的脱胶中。试验结果表明,该果胶酶的加入可以使果汁的产率提升至(89.85±1.57)%,还原性物质含量提升至(11.53±0.09) g/L,这表明该果胶酶在果汁生产中有一定的应用前景。
参考文献
[1] SAKAI T,SAKAMOTO T,HALLAERT J,et al. Pectin,pectinase and protopectinase:production,properties,and applications[J]. Advances in applied microbiology,1993,39:213-294.
[2] RIDLEY B L,ONEILL M A,MOHNEN D. Pectins:structure,biosynthesis,and oligogalacturonide-related signaling[J]. Phytochemistry,2001,57(6):929-967.
[3] PEDROLLI D B,MONTEIRO A C,GOMES E,et al. Pectin and pectinases:production,characterization and industrial application of microbial pectinolytic enzymes[J]. The open biotechnology journal,2009,3(1):9-18.
[4] CHENG Z,XIAN L,CHEN D,et al. Development of an innovative process for high-temperature fruit juice extraction using a novel thermophilic endo-polygalacturonase from Penicillium oxalicum[J]. Frontiers in microbiology,2020,11:1200.
[5] LOZANO J E. Fruit manufacturing:scientific basis,engineering properties,and deteriorative reactions of technological importance[M]. New York:Springer,2006.
[6] PARK S I,ZHAO Y Y. Development and characterization of edible films from cranberry pomace extracts[J]. Journal of food science,2006,71(2):505-518.
[7] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical chemistry,1959,31(3):426-428.
[8] 向玉萍,邱树毅,曹文涛,等. 酱香型白酒核心产区大曲中霉菌的分离及鉴定[J]. 食品与发酵科技,2021,57(2):56-65.
[9] WANG J J,ZHANG Y H,QIN X,et al. Efficient expression of an acidic endo-polygalacturonase from Aspergillus niger and its application in juice production[J]. Journal of agricultural and food chemistry,2017,65(13):2730-2736.
[10] YANG J,LUO H Y,LI J,et al. Cloning,expression and characterization of an acidic endo-polygalacturonase from Bispora sp. MEY-1 and its potential application in juice clarification[J]. Process biochemistry,2011,46(1):272-277.
[11] CHENG Z,CHEN D,WANG Q Y,et al. Identification of an acidic endo-polygalacturonase from Penicillium oxalicum CZ1028 and its broad use in major tropical and subtropical fruit juices production[J]. Journal of bioscience and bioengineering,2017,123(6):665-672.
[12] TU T,MENG K,BAI Y G,et al. High-yield production of a low-temperature-active polygalacturonase for papaya juice clarification[J]. Food chemistry,2013,141(3):2974-2981.
[13] HIROSE N,KISHIDA M,KAWASAKI H,et al. Purification and characterization of an endo-polygalacturonase from a mutant of Saccharomyces cerevisiae[J]. Bioscience,biotechnology,and biochemistry,1999,63(6):1100-1103.
[14] 秦日甜,謝占玲. 镰刀菌Q7-31T果胶酶PGL1的分离纯化、酶学性质鉴定及结构分析[J]. 生物技术通报,2018,34(4):151-160.
[15] 郭莉,谈安群,谭祥,等. 皮落青霉产聚半乳糖醛酸酶酶学性质及其应用研究[J]. 西南大学学报(自然科学版),2021,43(11):1-8.
[16] KYAMUHANGIRE W,MYHRE H,S?RENSEN H T,et al. Yield,characteristics and composition of banana juice extracted by the enzymatic and mechanical methods[J]. Journal of the science of food and agriculture,2002,82(4):478-482.
[17] MARTINS E D,LEITE R S R,DA SILVA R,et al. Purification and properties of polygalacturonase produced by thermophilic fungus Thermoascus aurantiacus CBMAI-756 on solid-state fermentation[J]. Enzyme research,2013,2013:438645.
[18] ZHOU H X,LI X,GUO M Y,et al. Secretory expression and characterization of an acidic endo-polygalacturonase gene from Aspergillus niger SC323 in Saccharomyces cerevisiae[J]. Journal of microbiology and biotechnology,2015,25(7):999-1006.
[19] PENG X B,CHEN G J,HAN Z G,et al. High-level secretive expression of a novel achieved Talaromyces cellulolyticus endo-polygalacturonase in Pichia pastoris by improving gene dosage for hydrolysis of natural pectin[J]. World journal of microbiology & biotechnology,2019,35(6):84.
[20] IBRAHIM E,JONES K D,TAYLOR K E,et al. Molecular and biochemical characterization of recombinant cel12B,cel8C,and peh28 overexpressed in Escherichia coli and their potential in biofuel production[J]. Biotechnology for biofuels,2017,10:52.
(責编:杨 欢)
基金项目 广西高校中青年教师科研基础能力提升项目(2022KY0674)。
作者简介 冼莹莹(1987—),女,广西梧州人,硕士,从事功能性食品及用酶开发研究。
收稿日期 2024-01-10

