槐米提取物对黄嘌呤氧化酶活性抑制评价及作用机制研究

摘要 为了探究槐米醇提物药效物质对体外黄嘌呤氧化酶(XOD)活性抑制的作用机制,本研究采用体外XOD促动力学模型对槐米醇提物及其潜在活性成分芸香叶苷、槲皮素及白桦脂醇进行XOD活性抑制评价,以分析其天然成分芸香叶苷热-酸性水解作用对XOD活性抑制的影响。试验结果表明,槐米提取物A在药剂浓度100~700 μg/mL,对体外XOD活性抑制具有良好作用,其最大抑制率可达36.68%,与对照药剂别嘌呤醇(90 μg/mL,抑制率61%)相比,抑制率较弱。槐米中主要化学成分芸香叶苷、槲皮素及白桦脂醇在一定药剂浓度范围内,芸香叶苷抑制率不明显,槲皮素表现出优异的XOD抑制作用(抑制率61.64%,IC50值为203.6 μmol/L),白桦脂醇次之。在酸性水解作用的条件下,芸香叶苷酸性水解混合物抑制XOD活性作用较热水解作用混合物较高。研究认为槐米醇提物对体外XOD活性抑制的药效物质可能为槲皮素。
关键词 黄嘌呤氧化酶;槐米;芦丁;槲皮素;活性抑制
中图分类号 TS201.2;R284.1 文献标识码 A
文章编号 1007-7731(2024)08-0085-06
槐米为豆科植物槐的干燥花蕾,采收于夏季,主要分布于河南、山东、山西、陕西和贵州等地。芦丁为中药饮片槐米的主要评价指标之一,槐米中芦丁成分含量较高,占比约20%~30%[1],是槐米的主要成分之一[2-3]。此外,相关研究报道了槐米醇提取物中其他的潜在活性成分,如桦皮醇、槐二醇以及槐花米甲、乙、丙素,槲皮素和槐花皂苷Ⅰ、Ⅱ、Ⅲ等[4-8]。
槐米具有丰富的黄酮类成分,其药用价值较高,并具有多种生物活性,有良好的保健作用。槐米中芦丁提取工艺的改善、药理作用及药效学研究等方面是槐米的研究重点。槐米的药理作用与其成分有关,有关槐米药理作用方面的研究报道得到高度关注,特别是其提取物在抗氧化[9]、自由基清除等方面[10-12]已取得一定的研究成果。
黄嘌呤氧化酶(Xanthine oxidase,XOD)是近年来治疗高尿酸血症的有效生物靶点之一,是生物体内嘌呤代谢过程中黄嘌呤或次黄嘌呤羟基化作用生成尿酸的核心调控者。因此,探明提取物中起效物质组分对靶点生物酶的作用机制,是研究槐米药理作用的核心。本文采用体外XOD促动力学模型,探讨槐米醇提取物及其潜在药效成分对XOD活性抑制评价,探究其有效活性成分的量效和构效作用关系,并进一步探讨潜在活性成分模拟水煮泡或酸性胃液蠕动环境条件下的行为作用及机制分析,为相关研究提供参考。
1 材料与方法
1.1 试验材料
仪器:UV-Vis(759S,上海棱光),超声清洗仪(YQ-020A,上海易净),电子天平(FA124,上海恒平),N-1210BV-WB型旋转蒸发仪(理化器械株式会社),恒温水浴锅(江苏新春兰科学仪器有限公司,HH-M8),真空冷冻干燥机(上海继谱电子科技有限公司,FD-2C-80),涡流混合器[冠森生物科技(上海)有限公司,XH-D]。
试剂:槐米(中药饮片,采购于中药材大市场,经鉴定为合格产品),所用试剂为黄嘌呤氧化酶(XOD),黄嘌呤(Xan),别嘌呤醇(All),焦磷酸钠缓冲溶液(0.1 mol/L,准确称量焦磷酸钠5.318 g、EDTA 0.017 5 g,超声溶解于纯净水,定容至200 mL,并用磷酸调pH值至7.5),EDTA,磷酸,槲皮素,芸香叶苷,白桦脂醇和无水乙醇等。以上试剂为分析纯,购于国药试剂公司,试验分析用水均为纯净水。
1.2 试验方法
1.2.1 槐米提取物A的制备 称取槐米粉末90.0 g于1 000 mL烧杯中,加入适量无水乙醇(500 mL),室温浸泡24 h,过滤,滤渣继续浸泡1次(12 h),过滤,合并滤液,真空浓缩至无溶剂状态,然后经冷冻干燥24 h,可获得试验样品槐米提取物A。
1.2.2 槐米提取物B的制备 称取槐米粉末用量(90.0 g)置于圆底烧瓶中,加入500 mL水,回流3 h,冷却至室温,过滤,滤液冷冻干燥,获得待测样品B。
1.2.3 天然芸香叶苷的提取分离及纯化 取1.2.1中获得的槐米提取物A(10.0 g),依次采用石油醚和乙酸乙酯混合试剂(V1∶V2 = 1∶1~10∶1)进行超声洗涤至混合试剂近无色状态,离心分离,收集固体,冷冻干燥,然后将固体进行水重结晶(2次),过滤,干燥,即获得淡黄色固体粉末芸香叶苷,其收率为19.8%。
1.2.4 芸香叶苷酸水解及其混合物制备 称取0.004 3 g芸香叶苷(自制)分别置于5 mL EP离心管,加入盐酸水混合液(1 mL,pH值2.0~3.0),水浴恒温35 ℃,分别振荡作用2、4、6、8、12、16、20和24 h,振荡结束后,用1% NaOH水溶液调节pH值至5.0~6.0,然后冷冻干燥,制备获得不同作用时间待测样品D,以分析其潜在活性成分评价及构效关系。
1.2.5 体外XOD促动力学模型構建 向0.1 mol/L焦磷酸钠缓冲溶液(0.4 mL,pH值7.5)中加入1.0 mmol/L的Xan溶液(1.0 mL),并加入100 mu/mL XOD溶液(1.6 mL),涡流振荡混匀。随后,将反应体系置于(35±2) ℃的水浴中恒温15 min。采用UV-Vis定波长(294 nm)光度扫描,记录对应的光度值[ΔA0,294](参比液为2 mL缓冲液+1 mL 1.0 mmol/L的Xan溶液),以探究槐米煎煮过程对XOD活性抑制的影响。
1.2.6 体外XOD活性抑制测试 按照1.2.5的体外XOD促动力学模型建立步骤,将待测试样品溶液(0.4 mL)、1.0 mmol/L的Xan溶液(1.0 mL)和0.01 mg/mL的XOD溶液(1.6 mL)依次加入反应试管中,混匀,并恒温(35±2) ℃水浴15 min。遵循上述1.2.5检测方法,记录294 nm处的吸光度值[ΔA1,294]。以下列公式计算待测样所对应的抑制率(参比液为0.4 mL各浓度待测液+1.6 mL缓冲液+1mL 1.0 mmol/L的Xan溶液),以探究酸性蠕动作用过程对芸香叶苷的影响。
[抑制率(%)=ΔA0,294-ΔA1,294ΔA0 ,294×100]
式中,[ΔA0,294]为未加入抑制剂,294 nm处的吸光度值;[ΔA1,294]为加入抑制剂,294 nm处的吸光度值。
1.3 数据分析
本文采用OriginPro 8.5软件对相关试验数据进行线性或以非线性回归法拟合。
2 结果与分析
2.1 槐米提取物对体外XOD活性抑制影响
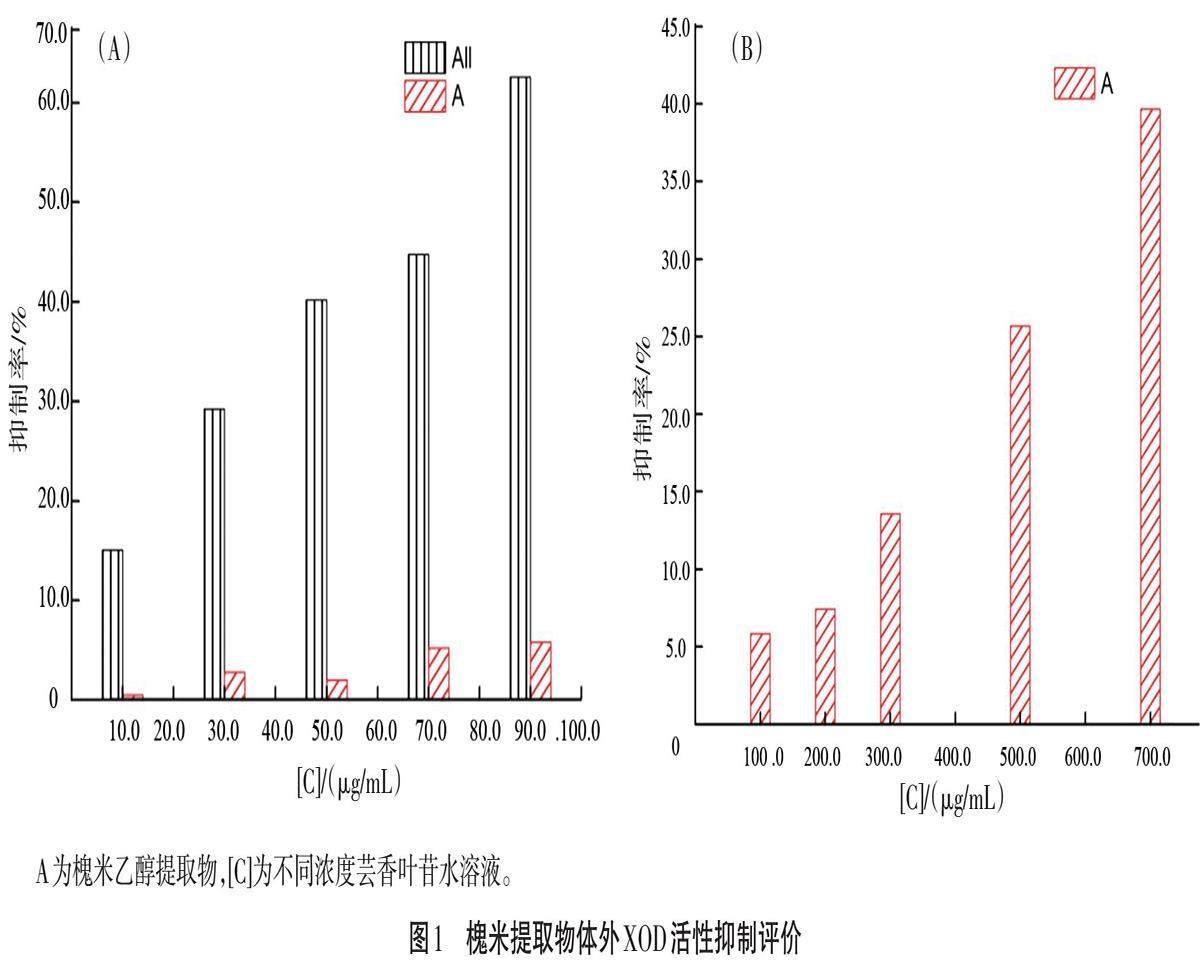
为进一步研究传统中药饮片槐米中潜在活性成分在高尿酸血症治疗方面的药理药效和作用机制,试验选取了临床上有效的药物靶点XOD作为靶-药结合研究对象,并构建体外XOD促动力学模型。同时,利用体外XOD促动力学模型评价槐米提取物A对体外XOD生物活性抑制作用,探讨其量效关系。如图1(A)所示,当槐米提取物A药剂浓度在10~90 μg/mL,在相同药剂浓度条件下,体外XOD活性抑制作用相比对照药剂All,呈现出较大差异性。为此,试验进一步考察了槐米提取物A在较高药剂浓度范围内对体外XOD生物活性的影响,试验结果显示,随着药剂浓度从100 μg/mL递增至700 μg/mL,槐米提取物A对体外XOD活性抑制率与其浓度呈现出良好的依赖性,且最大抑制率为36.68%,但仍小于对照药剂All对XOD活性抑制作用,如图1(B)所示。由此说明,槐米提取物A中可能具有潜在生物活性物质,可有效抑制XOD生物活性。
2.2 潜在活性成分评价及构效关系分析
芸香叶苷、槲皮素、白桦脂醇、槐花二醇、槐花米甲、乙、丙素和槐花皂苷Ⅰ、Ⅱ、Ⅲ等是槐米中的已知化學成分,由于槐花二醇以及槐花米甲、乙、丙素和槐花皂苷Ⅰ、Ⅱ、Ⅲ等成分难以分离获得。为进一步揭示槐米提取物A中可能存在的潜在活性成分,试验选取了易溶于乙醇的化学成分芸香叶苷、槲皮素和白桦脂醇为研究对象,分子结构如图2所示。
芸香叶苷又名芦丁,为天然黄酮苷类化合物,是黄酮醇与二元糖以糖苷键合而成的天然化合物,待测样品芸香叶苷在药剂浓度为62.5~750.0 μmol/L,可观察到芸香叶苷对体外XOD活性抑制作用不明显,与药剂浓度无相关依赖性,且抑制率低于5%,如图3所示。该试验结果与槐米提取物A对体外XOD活性抑制作用相差较大。
天然白桦脂醇属于五环三萜类化合物,拥有多个手性碳,是萜类手性化合物的代表之一。为探究槐米中化学成分白桦脂醇对XOD活性作用的影响,试验采用体外XOD促动力学模型对天然白桦脂醇进行生物活性评价及量效关系分析。试验结果显示,随着白桦脂醇药剂浓度在62.5~625.0 μmol/L递增,UV光谱图中呈现的294 nm处吸光度值变化影响较为明显,并与药剂浓度呈一定的线性关系,但最大抑制率也未超过30%,仍然低于在相同条件下槐米提取物A对体外XOD活性抑制效果,如图4所示。由此说明,天然白桦脂醇是槐米提取物A中的有效抑制成分之一。
针对槐米提取物中黄酮醇类化合物槲皮素,试验采用与上述相同的体外活性评价方法,对天然槲皮素成分进行体外XOD活性抑制评估。结果表明,在不同浓度的待测药剂作用下,槲皮素对体外XOD活性作用表现出良好的抑制效果,特别是在药剂浓度为62.5~250.0 μmol/L内,槲皮素对体外XOD活性抑制作用与药剂浓度可呈良好的依赖性,随着药剂浓度的继续增加,其对应的抑制率可明显地观察到趋近于最大值(61.64%,IC50值为203.6 μmol/L),如图5所示,由此说明,槲皮素可能为槐米提取物A中主要的有效抑制活性成分。
2.3 槐米煎煮过程对XOD活性抑制的影响
从上述试验结果可知,槐米提取物A中可能性有效抑制活性成分分别为槲皮素和白桦脂醇。槲皮素是一种富电子体系的多酚类化合物,可充当较强的天然还原剂,与天然成分芸香叶苷分子结构比对分析可知。芸香叶苷是一个槲皮素和二元糖以糖苷键形式链接组成的黄酮苷类化合物,从化学反应角度分析可知,芸香叶苷中的糖苷键在热—酸性环境中易发生断键,形成槲皮素和二元糖。此外,相关研究发现,芸香叶苷成分在槐米中的含量较高,约占30%,是槐米中的主要化学成分之一。由此可知,如果芸香叶苷成分在一定的条件下转化为槲皮素,在药理方面可能会有效提升槐米提取物A对XOD活性的药用价值。中药药剂制备方式热水煎煮过程可能会促使槐米中的主要成分芸香叶苷分子结构水解,生成槲皮素和糖元。为此,试验称取一定量的中药饮片槐米,并模拟其水煎煮过程,煎煮3 h后,过滤,汤剂经冷冻干燥,可获得待测样品B(槐米水提物)。随后,试验将待测样品B在体外XOD促动力学模型中进行XOD活性测试,结果表明,如图6(A)所示,在药剂浓度100~700 μg/mL内,待测样品B对XOD活性的抑制率,相比槐米提取物A而言表现出一定的增效作用。为了进一步验证试验提出的观点,试验称取一定量的芸香叶苷配制成不同浓度的水溶液,回流3 h,冷却至室温,并采用体外XOD促动力学模型对其待测样品B进行XOD活性测试,试验结果与芸香叶苷(未经回流处理)的XOD活性作用相比,回流后芸香叶苷溶液与相同浓度未经回流处理的芸香叶苷溶液对体外XOD活性抑制作用的差异不明显,且未能表现出较强的增效作用,如图6(A)所示,这说明热水回流过程对芸香叶苷分子结构影响不大,可能未造成其糖苷键的水解。试验再次考察了不同浓度的芸香叶苷在弱酸性(柠檬酸,pH值5.0~6.0)溶液中回流过程的行为变化,经3 h回流后,获得相对应的待测样品C。在对待测样品C活性评价方面,待测样品C对体外XOD活性抑制作用与芸香叶苷(回流或为回流处理)对比呈现出较好的正面响应值,且十分明显,如图6(B)所示,这说明弱酸性热水条件有助于芸香叶苷分子结构中的糖苷键水解。
槐米经水煎煮后对XOD活性抑制表现出的一定程度增效作用,其原因可能为槐米中存在酸性成分,在热水煎煮过程中促使芸香叶苷分子结构中的糖苷键水解,转化为槲皮素,从而提高了待测样品B中槲皮素含量的占比,表现出较好的XOD活性抑制作用。
2.4 酸性蠕动作用过程对芸香叶苷的影响
传统中药饮片服用方式以水煮泡為主,其汤汁经胃肠进入血液循环,作用于病灶。人体胃肠道酸性蠕动作用过程往往是药剂中有效成分吸收的主要途径之一。因此,试验采用恒温水浴溶出仪,模拟芸香叶苷在酸性胃液蠕动作用下的变化,如图7所示,即取一定量的芸香叶苷置于pH值2.0~3.0的酸性溶液中,恒温35 ℃,振荡作用不同时间,并配制成药剂浓度为750 μmol/L(以芸香叶苷浓度为准)的待测样品D。当芸香叶苷在酸性溶液中振荡作用2 h时,其抑制率略高于相同药剂浓度(750 μmol/L)的芸香叶苷(未参加酸性溶液中振荡作用);随着酸性溶液中振荡作用时间延长,其对应的抑制率为递增趋势;在作用时间为24 h时,其对应抑制率可达到40.6%,但仍低于相同药剂浓度的槲皮素(750 μmol/L,抑制率61.2%),说明芸香叶苷在酸性溶液中振荡作用24 h时可能未完全转化为槲皮素。
以上试验结果验证了槐米中主要化学成分芸香叶苷在人体或动物胃肠道作用过程可能会被分解为具有相对高效的XOD活性抑制成分槲皮素,从而提升了槐米在高尿酸血症方面应用的可行性。该结果与有关槐米提取物对高尿酸血症小鼠降尿酸作用的有效性研究一致,进一步说明中药饮片槐米治疗高尿酸血症的潜在活性成分可能与槲皮素有关。
3 结论
槐米作为传统的中药饮片之一,具有良好的医用价值。天然芸香叶苷、槲皮素及白桦脂醇等成分为槐米中已知化学成分,其中芸香叶苷作为槐米中的主要化学成分,且含量比重较大,是槐米中的重要潜在活性成分。本文利用体外XOD促动力学模型,研究槐米提取物及其潜在活性成分芸香叶苷、槲皮素和白桦脂醇对XOD活性抑制作用及量效关系,明确了槲皮素对XOD活性作用影响较大。试验进一步模拟了槐米中主要化学成分芸香叶苷在中药饮片水煮泡或酸性胃液蠕动作用对XOD活性抑制的影响,揭示了槐米醇提物对高尿酸血症小鼠降尿酸作用的机制,为相关研究提供参考。
参考文献
[1] 李振志,朱华,谢锋,等. 不同产地槐米中芦丁的含量测定[J]. 世界中医药,2013,8(8):952-954.
[2] 韦源林,史艳财,邹蓉,等. 不同来源金槐槐米的红外光谱及芦丁含量的比较[J]. 广西植物,2019,39(11):1541-1549.
[3] 陈璐,耿柏林,郭禄晶,等. 不同产地槐米中芦丁的提取及含量测定比较[J]. 农业科技与信息,2020(8):58-60.
[4] 刘丽丽,王涛,李晓霞,等. 槐米化学成分研究Ⅱ[J]. 辽宁中医药大学学报,2014,16(7):51-53.
[5] 刘丽丽,李晓霞,陈玥,等. 槐米化学成分研究I[J]. 天津中医药大学学报,2014,33(4):230-233.
[6] 侯晓楠. 槐米中功效成分的分离纯化及其生物活性研究[D]. 天津:天津大学,2018.
[7] 李秋红,栾仲秋,王继坤. 中药槐米的化学成分、炮制研究及药理作用研究进展[J]. 中医药学报,2017,45(3):112-116.
[8] 王笑,王雨,张冰,等. 槐不同药用部位本草学、化学成分和药理作用研究进展[J]. 中草药,2018,49(18):4461-4467.
[9] 沈密,马存林,梁少华,等. 槐米提取物的抗氧化性能研究[J]. 河南工业大学学报(自然科学版),2012,33(6):72-76.
[10] 郭亚力,李聪,欧灵澄,等. 槐米中天然抗氧化剂的提取及其抗自由基性能研究[J]. 食品科学,2004,25(7):154-157.
[11] 安茹. 槐米中槲皮素的提取及其对高尿酸血症的影响[D]. 天津:天津科技大学,2010.
[12] 栾仲秋,向月,李秋红,等. 槐米提取物对类风湿关节炎大鼠Th17/Treg细胞平衡的调节作用[J]. 中国医药导报,2019,16(20):25-28.
(责编:王 菁)
作者简介 杨长远(1996—),男,贵州天柱人,从事制药工程研究。
收稿日期 2024-01-30

