2019-2022年中国H6N1亚型禽流感病毒的生物学特性分析
陈源,崔鹏飞,施建忠,张元成,于晴晴,颜成,张亚萍,王丛丛,张洁,王燕,邓国华,陈化兰
2019-2022年中国H6N1亚型禽流感病毒的生物学特性分析
陈源,崔鹏飞,施建忠,张元成,于晴晴,颜成,张亚萍,王丛丛,张洁,王燕,邓国华,陈化兰
中国农业科学院哈尔滨兽医研究所/动物疫病防控全国重点实验室/国家禽类实验动物资源库,哈尔滨 150069
【背景】H6亚型禽流感病毒(avian influenza virus,AIV)广泛流行于我国南方地区,是我国家禽中最常见AIV之一。H6N1亚型AIV频繁地与其他野鸟源毒株重配,并且可以作为供体为高致病性AIV提供内部基因片段,产生新型重组病毒,进而威胁人类健康。【目的】通过对我国H6N1亚型AIV的演化动态及其相关生物学特性分析研究,为我国禽流感的综合防控提供数据支持。【方法】采集2019—2022年我国25个省(直辖市、自治区)的活禽交易市场及养殖场家禽喉和泄殖腔拭子,通过接种鸡胚分离到7株H6N1亚型AIVs并对其进行全基因组测序,分析其遗传演化特征、受体结合特性及其对SPF鸡和BALB/c小鼠的感染性。【结果】遗传演化分析表明,7株病毒的基因与分离于北美及东南亚地区的野鸟源病毒基因同源性较高,基因来源复杂,具有明显的遗传多样性。贝叶斯演化分析表明,H6亚型AIV HA基因曾发生过多次的跨洲际传播,欧亚谱系病毒在北美地区也有着较长时间流行。1株病毒HA基因与北美地区毒株基因高度同源,根据贝叶斯演化分析结果,推测该病毒在野鸟体内经历了复杂的基因重配后形成,后经野鸟传入我国。特殊氨基酸位点分析结果显示,病毒HA蛋白裂解位点序列均为PQIETR↓GLF,符合低致病性AIV特征;此外,另有1株病毒的NP蛋白发生Y52H突变,据报道,该突变对AIV获得抵抗人干扰素刺激基因BTN3A3的能力起到关键作用。受体结合特性分析表明,部分毒株具有双受体结合特性,但结合人源受体能力弱于结合禽源受体能力。病毒对SPF鸡的感染性试验表明,鸡感染A/chicken/Jiangxi/S40445/2019(H6N1)后能通过呼吸道及消化道排毒,并且病毒可在鸡群内通过接触传播。鸡感染A/duck/Jiangxi/S10941/2019(H6N1)后仅有少数鸡通过呼吸道排毒,病毒无法在鸡群间通过接触传播。BALB/c小鼠的感染性试验表明,H6N1亚型AIV无需提前适应便可在小鼠呼吸道内有效复制,但对小鼠仍呈低致病力。【结论】2019—2022年分离于我国的H6N1亚型AIV基因大部分来源于野鸟源病毒,候鸟可经东亚-澳大利亚迁徙路线将病毒传入我国;部分病毒能够结合人源唾液酸受体并在小鼠呼吸道内有效复制,表明该亚型病毒对公共卫生安全构成潜在威胁。
H6N1;禽流感病毒;跨洲际传播;重配;感染性
0 引言
【研究意义】禽流感病毒(avian influenza virus,AIV)是单股负链分节段的RNA病毒,病毒基因组包含8个基因片段。不同亚型AIV之间常发生基因的交换,这个过程称为基因重配。一些通过基因重配产生的新型病毒不仅会对家禽养殖业造成严重经济损失,甚至还能突破种间屏障感染人。因此,持续地对AIV进行监测并分析其生物学特性,具有重要的意义。【前人研究进展】H6亚型AIV于1965年被首次报道分离自火鸡,随后逐渐在多种野鸟和家禽中分离到不同NA亚型的H6亚型AIV[1-4]。禽流感监测数据表明,H6亚型AIV在我国南方地区广泛存在,是水禽中最常见的AIV之一[5]。2000—2005年,中国香港学者对我国南方地区分离到的H6亚型AIV进行研究发现,H6N2亚型为病毒的优势亚型,依据其遗传演化关系,鸭源H6N2亚型AIV的HA进化树可分为3个分支,分别为ST339-like分支、ST2853-like分支和HN573- like分支[6]。伴随着时间的推移,H6亚型AIV不断演化,H6N6亚型AIV取代H6N2亚型AIV,成为我国水禽中最常见的H6亚型AIV[7-8]。H6亚型AIV不仅在水禽中广泛流行,甚至能跨物种感染哺乳动物和人类。2011年,ZHANG等[9]在广东省猪群中分离到1株H6N6亚型AIV;2013年,台湾报道了全球首例人感染了H6N1亚型AIV病例[10-11]。H6N1病毒在我国H6亚型AIV中分离率较低,主要分布于我国台湾、香港地区以及我国大陆东南地区[12-13]。我国鸭群中的H6N1亚型AIV频繁地与野鸟源病毒重配,内部基因来源复杂[8]。【本研究切入点】目前对近年来我国流行的H6N1亚型AIV的研究较少,其相关生物学特性尚未被系统分析。本研究对2019—2022年期间分离自我国的H6N1亚型AIV进行了系统的生物学特性研究,包括基因溯源分析、分离株的受体结合特性分析以及分离株对SPF鸡、BALB/c小鼠的感染性分析。【拟解决的关键问题】了解我国最新分离到的H6N1亚型AIV的演化动态,评价其对鸡的感染性和跨物种感染人的风险。
1 材料与方法
1.1 试验时间与地点
本研究于2019—2023年在中国农业科学院哈尔滨兽医研究所完成。
1.2 毒株
本研究中的7株H6N1亚型AIVs由国家禽流感参考实验室分离、鉴定并保存。
1.3 实验动物、鸡胚
9—11日龄的SPF鸡胚购自国家禽类实验动物资源库。BALB/c小鼠购自北京维通利华实验动物技术有限公司。
1.4 主要实验试剂
病毒RNA提取试剂盒购自天根生化科技(北京)有限公司;M-MLV逆转录酶购自美国Promega公司;2× Taq Master Mix购自北京康为世纪生物科技有限公司;测序反应试剂盒Big Dye Terminator 3.1购自美国ABI公司。
1.5 病毒分离及亚型鉴定
将家禽咽喉及泄殖腔拭子旋涡震荡、离心后取上清液,以0.2 mL/枚接种于9—11日龄鸡胚,37℃孵化48 h后收集鸡胚尿囊液。参照血凝试验国家参考标准测定尿囊液血凝性,并对血凝阳性尿囊液通过H1—H16亚型AIV单因子血清及新城疫血清确定其HA亚型。
1.6 病毒纯化与EID50测定
将病毒悬液与磷酸缓冲盐溶液(phosphate buffer solution,PBS)以1﹕9的比例混合,置于涡旋振荡器上使其充分混匀,随后用PBS 10倍连续稀释,以0.1 mL/枚接种于鸡胚。将鸡胚置于37℃恒温孵化箱中,48 h后测定鸡胚尿囊液的血凝性,将最高稀释度、最高血凝价的鸡胚尿囊液分装冻存于-70℃冰箱中。取纯化后病毒,将病毒用PBS 10倍连续稀释,每个稀释度病毒悬液以0.1 mL重复接种5个鸡胚。接种完毕后将鸡胚置于37℃恒温孵化箱,48 h后将鸡胚取出,收集鸡胚尿囊液,测定尿囊液血凝性。利用Reed- Muench方法计算各病毒的鸡胚半数感染量(fifty percent embryo infectious dose, EID50)。
1.7 病毒全基因组测序及遗传演化分析
参照核酸提取试剂盒说明书,取140 μL纯化后的病毒,提取病毒RNA,随后以引物(5′-AGCRAAA GCAGG-3′)为反转录引物,参照M-MLV逆转录酶使用说明书,将病毒RNA反转录得到cDNA。利用Hoffmann等[14]设计的引物,以病毒cDNA为模板,扩增病毒全基因组。将扩增产物利用磁珠纯化后,参照Big Dye Terminator 3.1测序反应说明书,进行测序反应,反应完成后利用磁珠将测序反应产物纯化,纯化后的产物在测序仪上进行基因序列的测定。利用DNA-Star软件拼接序列后,在Phylosuite[15]中进行序列的比对以及ML树的重建。采用贝叶斯节点标记法,在BEAST V1.10.4[16]重建系统发生关系,并获得进化树上各个节点的绝对分化时间及其可信区间。在iTOL(https://itol.embl.de/)对进化树美化。
1.8 病毒对BALB/c小鼠的感染性试验
将病毒以106EID50/50 μL的剂量经鼻腔感染6周龄BALB/c小鼠,每组感染8只,在感染后的第3天随机安乐死3只小鼠,采集小鼠的鼻甲、脑、肺脏、脾脏、肾脏,定容于1 mL PBS中,脏器经研磨后,用PBS对脏器研磨液10倍倍比稀释,在每个稀释度的研磨液中取0.1 mL接种于9—11日龄鸡胚,48 h后计算每个稀释度研磨液的血凝阳性鸡胚数量,利用Reed-Muench方法计算小鼠脏器内的病毒滴度。其余组内的5只小鼠继续称重至第14天,计算其体重变化以及观察其健康情况。
1.9 病毒对SPF鸡的感染性以及传播性试验
每个隔离器内设置10只感染组鸡、3只复制组鸡,另设置3只接触传播组鸡。将感染组鸡和复制组鸡以106EID50/100 μL的剂量经鼻腔滴注病毒,感染24 h后,将接触传播组鸡放入隔离器中。感染后第3、5、7、9、11和13天采集感染组鸡和接触传播组鸡的咽喉和泄殖腔拭子;感染后第3天安乐死复制组鸡,取其脑、气管、胸腺、肺脏、肾脏、脾脏、胰腺、心脏、肝脏、法氏囊和盲肠,用于病毒滴定。在感染后第21天,测定感染组鸡及接触传播组鸡血清转阳情况。
1.10 病毒的受体结合特性分析
参照文献[17]的方法,将初始浓度为1 ng·μL-1糖链进行2倍倍比稀释,以100 μL/孔的标准加入96孔ELISA板中,4℃条件下包被过夜。弃去96孔板中液体,用预冷的PBS洗涤4次。将病毒配置成64单位抗原后,以100 μL/孔的标准加入ELISA板中,4℃条件下孵育6 h。用含Tween-20的磷酸盐缓冲液(PBS with tween-20, PBST)洗涤ELISA板4次,用预冷的PBS洗涤1次。加入1﹕300比例稀释的鸡多抗血清100 μL/孔,4℃孵育2 h。PBST洗涤4次后,加入辣根过氧化物酶标记的羊抗鸡二抗,37℃孵育1 h后洗涤。加入显色液,避光显色5 min。ELISA板中每孔加入0.5 mol·L-1硫酸50 μL,终止显色反应。在490 nm读取OD值,利用GraphPad分析结果并作图。
2 结果
2.1 病毒分布
2019—2022年于我国25个省(直辖市、自治区)的活禽交易市场及养殖场内对家禽进行禽流感主动监测,共分离到7株H6N1亚型AIVs。7株病毒均分离自我国南方地区,其中湖南省分离到2株,江西省分离到2株,另外在我国贵州省、湖北省、福建省各分离到1株病毒。7株病毒中有5株分离于养殖场,2株分离于市场。仅有1株病毒分离自鸡,其余病毒均分离自鸭(表1)。
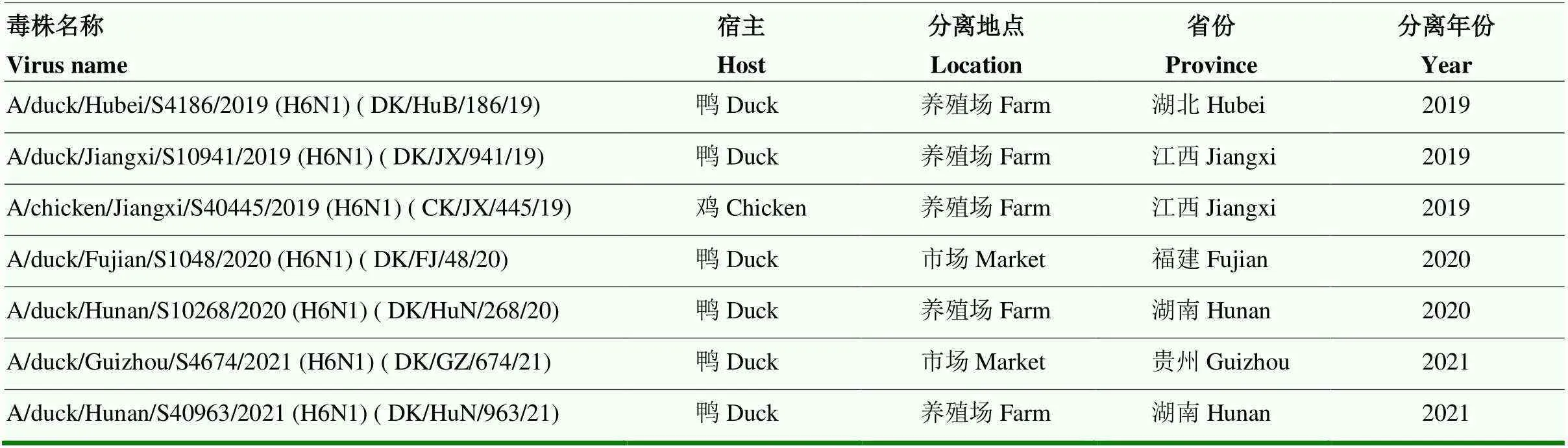
表1 H6N1亚型AIVs信息
2.2 病毒基因组序列的同源性分析
在GISAID数据库中通过BLAST得到与7株H6N1亚型AIVs各节段基因核苷酸相似性最高的病毒(表2)。结果显示,7株H6N1亚型 AIVs 的全基因组与数据库中分离地为东亚及北美的野鸟源病毒的基因同源性较高,达到98%以上。推测H6N1病毒在野鸟群体中经历了复杂的重配后再传入我国家禽,其内部基因来源十分复杂,具有明显的遗传多样性。
2.3 病毒HA基因演化分析
对7株病毒HA基因同源性进行分析,结果显示核苷酸相似性在91.3%—99.2%之间。通过BEAST V1.10.4对H6亚型AIVs HA基因重建最大分支可信度(MCC)树,以推断HA基因的演化关系。结果显示,H6亚型AIV分为欧亚谱系及北美谱系,其最近共同祖先可追溯至1916年(图1)。欧亚谱系的病毒在20世纪80年代就已在北美的野鸟群体中监测到,直至2022年仍可在北美野鸟群体中监测到欧亚谱系的病毒。在欧亚谱系中,出现了多起洲际基因交换事件,结合进化树中毒株的宿主信息,推断病毒随候鸟迁徙跨洲际传播。与 DK/JX/941/19 HA基因亲缘关系较近的基因来自韩国以及阿拉斯加的野鸟源病毒,与分离于北美地区和韩国的病毒聚在一簇;其余分离株HA基因与东亚野鸟源病毒基因具有较高的同源性。以上结果表明,H6N1亚型AIVs HA基因与来自野鸟的H6亚型AIVs高度同源,推断DK/JX/941/19 HA基因节段是由候鸟迁徙传入我国。
2.4 病毒NA基因遗传演化分析
NA基因核苷酸相似性在95.9%—99.6%之间,以相似性高于95%为依据进行分组,7株病毒的NA基因均位于同一组内,与东亚地区野鸟源 H1N1、H5N1、H6N1 AIVs的N1基因亲缘关系较近(图2)。
2.5 病毒内部基因遗传演化分析
分离株内部基因之间的核苷酸相似性分别为PB2:93.7%—99.7%,PB1:92.7%—98.9%,PA:93%— 96.5%,NP:93.5%—99.6%,M:96%—99.4%,NS:70.6%—99.8%。以相似性高于95%为依据分组,M 基因分为1组,其余内部基因分组情况为PB2:2组,PB1:2组,PA:3组,NP:3组,NS:2组。NS基因可分为2个等位基因群,其余内部基因均位于欧亚分支且均与野鸟源毒株基因亲缘关系较近(图3)。

表2 7株H6N1亚型AIVs各基因节段同源性的分析

续表2 Continued table 2

图1 HA基因贝叶斯分析最大分支可信度(MCC)树

图2 NA基因遗传演化分析

图3 PB2、PB1、PA、NP、M、NS 基因遗传演化分析
2.6 DK/JX/941/19的演化关系推断
由于DK/JX/941/19 HA基因与分离于北美地区的病毒聚在一簇,而其余基因片段均与东亚野鸟源、鸭源病毒有着较高的同源性,表明东亚与北美的病毒基因库发生基因漂移,因此,有必要对此病毒进行演化分析,以分析其完成重配的时间。
通过BEAST V1.10.4对DK/JX/941/19的8个基因片段进行定年分析,结果显示8个内部基因片段的最近共同祖先最早可追溯至2016年5月,最晚为2019年1月,推断病毒在2019年初完成重配(表3)。
DK/JX/941/19 HA基因与来自阿拉斯加、韩国的野鸟源病毒 HA 基因高度同源,而其余的基因也多与韩国的野鸟源病毒基因相似。基于阿拉斯加、韩国与我国均位于东亚-澳大利亚候鸟迁徙路线,推测起始于阿拉斯加地区的候鸟经该路线迁徙至韩国,其携带的北美地区HA基因与韩国野鸟群体中的东亚分支基因重配形成新型病毒,最后通过候鸟迁徙传入我国鸭场。
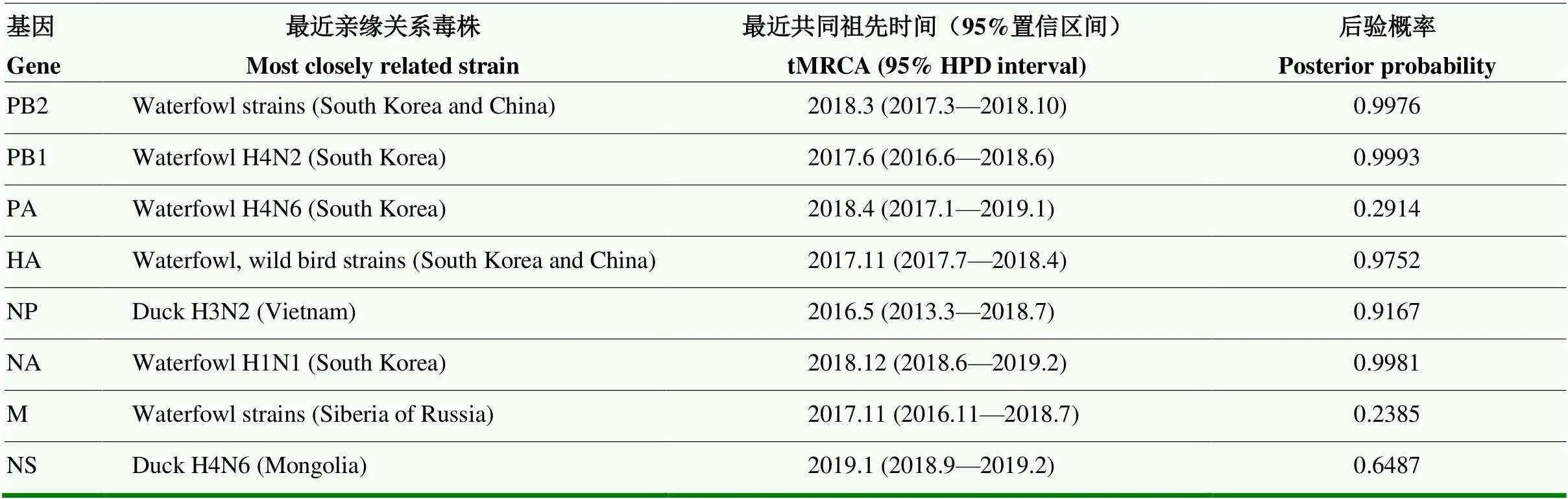
表3 DK/JX/941/19演化关系推断
2.7 病毒基因组特殊氨基酸位点分析
7株H6N1亚型AIVs HA裂解位点基序均为PQIETR↓GLF,符合LPAIVs特征。
分析影响病毒受体结合特性的相关位点,显示有5株病毒获得了T160A的突变,据报道,获得该突变的H5N1病毒增强了对人源受体的结合[18]。
内部基因分子特征分析显示病毒PB2蛋白的627、701位点未发生突变,但DK/GZ/674/21在NP蛋白上发生Y52H的突变,据报道,该突变对AIV获得抵抗人干扰素刺激基因BTN3A3的能力起到关键作用[19]。5株病毒发生NP M105V的突变,有研究表明,获得该突变的H5N1病毒增强了对鸡的致病性[20]。
2.8 病毒对小鼠的感染性
将7株H6N1亚型AIVs分别以106EID50的剂量经鼻腔感染小鼠。在感染后第3天安乐死小鼠,取其脑、鼻甲、脾、肾、肺进行病毒滴定。结果显示,所有小鼠均未死亡或出现明显临床症状,部分小鼠体重有轻微下降(图4)。病毒在小鼠肺脏及鼻甲均能有效复制,其中在肺脏复制的平均滴度范围为5.4— 6.4 log10EID50/mL,在鼻甲复制的平均滴度范围为0.98—3.58 log10EID50/mL。以上结果表明,7株H6N1亚型AIVs能在小鼠呼吸器官中有效复制,但对小鼠呈低致病力。
2.9 病毒对鸡的感染性
为探究来自不同宿主的H6N1亚型AIV对鸡的感染能力,选取鸡源病毒(CK/JX/445/19)及鸭源病毒(DK/JX/941/19),以106EID50/100 μL的剂量经鼻腔感染SPF鸡。结果显示,感染组的鸡感染 CK/JX/445/19后,10只鸡的血清均转阳,仅有4只鸡排毒(图5),持续到感染后第7天;此外,3只接触组的鸡中有2只可通过泄殖腔向外排毒,其血清也发生转阳,表明该病毒可在鸡群中通过接触传播。鸡感染 DK/JX/ 941/19后,感染组的鸡的血清均转阳,但仅在2只感染组的鸡的咽喉中检测到病毒,排毒持续到第3天;未在接触组的鸡中检测到病毒,其血清也并未转阳,表明该病毒无法在鸡群中通过接触传播。在感染后第3天对复制组的鸡的脏器进行病毒滴定,均未在脏器中检测到病毒。鸡感染CK/JX/445/19后,以泄殖腔排毒为主;鸡感染 DK/JX/941/19后,排毒能力较弱,仅能通过咽喉排毒。
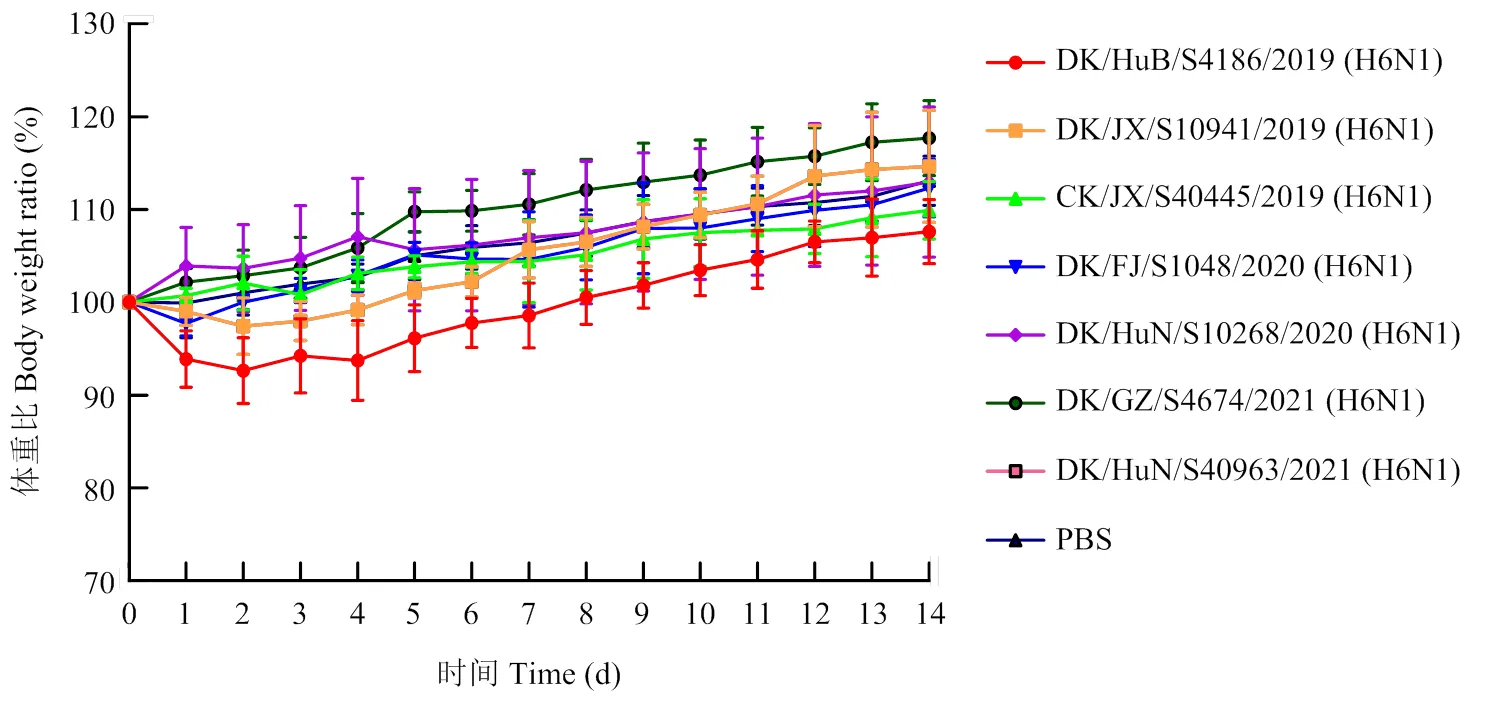
图4 小鼠体重变化
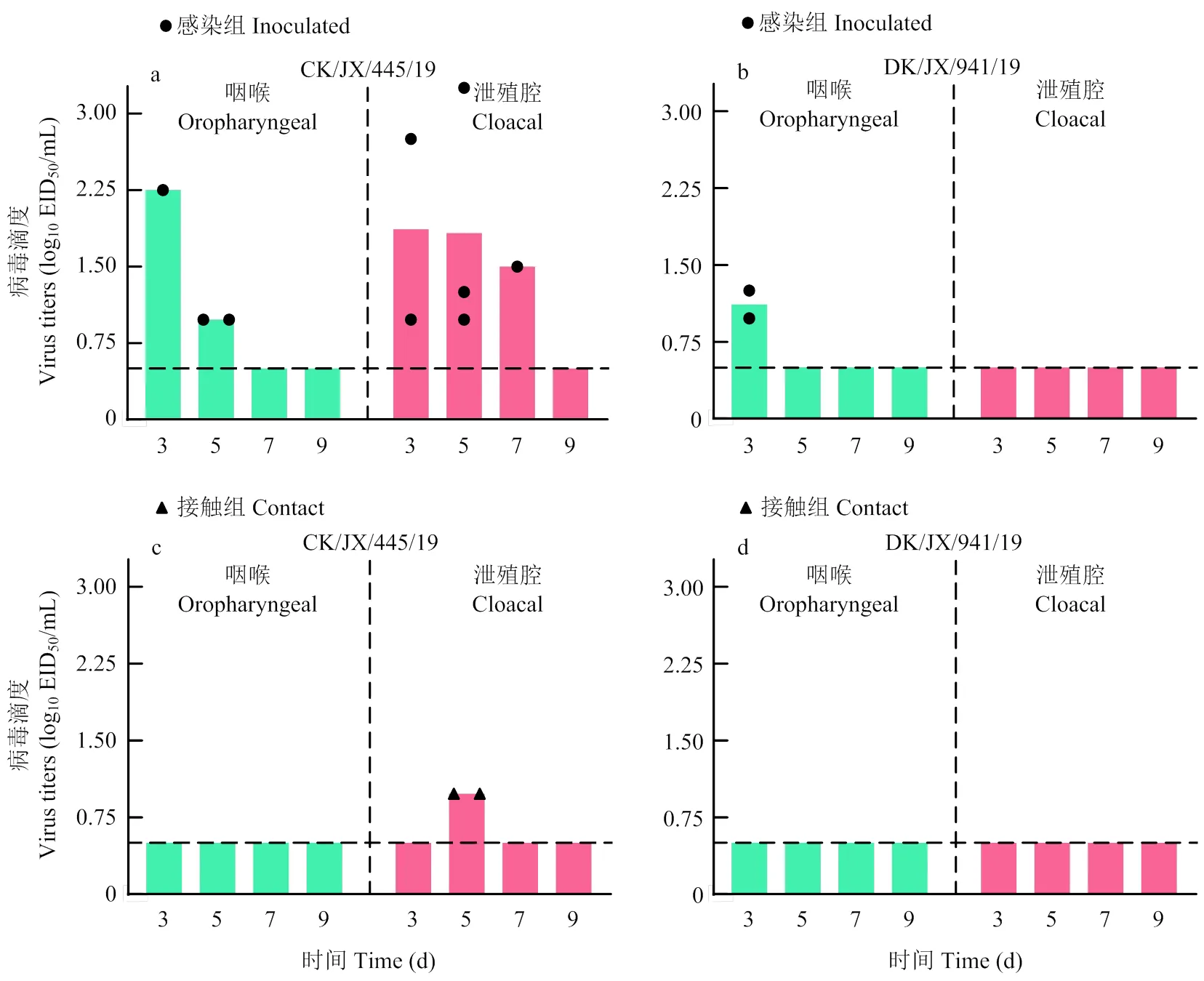
a:鸡接种 CK/JX/445/19 排毒情况;b:SPF 鸡接种 DK/JX/941/19 排毒情况;c:接触组鸡(CK/JX/445/19)排毒情况;d:接触组鸡(DK/JX/941/19)排毒情况
2.10 病毒的受体结合特性分析
对7株H6N1亚型AIVs的受体结合特性进行测定,结果显示,所有毒株均对禽源唾液酸(sialic acid, SA)α2,3-Gal受体有着较强的结合能力,此外,DK/GZ/ 674/21与DK/HuB/186/19对人源唾液酸SAα2,6-Gal受体还有着较低的结合水平(图6)。

图6 H6N1亚型AIVs受体结合特性
3 讨论
3.1 H6N1亚型AIVs的跨洲际传播与候鸟迁徙密切相关
本文中的H6N1亚型AIV基因与野鸟源AIV基因高度同源,表明野鸟是H6N1亚型AIV天然的基因储存库。相关研究表明,H6亚型AIV与其他亚型AIV相比,在野鸟体内的适应性更好,是在野鸟中检出率最高的 AIV之一[21-23]。鉴于H6亚型AIV在野鸟中具有较好的适应性及高检出率,推测该亚型病毒应更容易发生跨洲际传播。BAHL等[24]研究发现,欧亚谱系的H6亚型AIV可随着候鸟的迁徙,跨洲际传播到北美,其通过对易感宿主的竞争导致部分北美谱系病毒被替代。本研究通过Beast构建最大分支可信度(MCC)树,证实了H6基因发生过多次跨洲际的传播,欧亚谱系中的部分病毒在北美地区有着较长时间的流行。在本研究中,还发现DK/JX/941/19 HA基因与北美阿拉斯加地区、韩国 H6N5 亚型 AIV HA 基因聚在一簇,基于地理位置及进化关系,推断该病毒可能在2019年初完成重配,并通过候鸟经东亚-澳大利亚迁徙路线传入我国。值得注意的是,本文中有5株H6N1亚型AIVs分离自我国养鸭场,其地理位置均处于东亚-澳大利亚迁徙路线所在区域。我国开放的水禽养殖环境使得候鸟有机会进入养殖场并为候鸟将病毒传播给水禽提供了有利条件。
大量的H6亚型AIV分离自水禽,鸭源或鹅源H6亚型AIV一般需要适应后才可在陆生家禽体内有效复制。本研究中的鸭源病毒DK/JX/941/19感染鸡后无法在鸡体内有效复制,而鸡源病毒CK/JX/445/19感染鸡后则表现出较好的适应性。CK/JX/445/19的基因与分离自韩国和蒙古的野鸭源病毒基因高度同源,这表明来源于野鸭的H6N1亚型AIV传入我国后,部分病毒经过适应后能在鸡体内有效复制并在鸡群间传播。
综上所述,候鸟迁徙是H6N1亚型AIV跨洲际传播的重要因素。应加强水禽养殖场的饲养管理,避免水禽与野鸟和陆生家禽的接触,阻断病毒的传播链。
3.2 H6N1亚型AIVs对公共卫生安全构成潜在威胁
AIV不仅对家禽养殖业影响巨大,部分亚型的病毒还对人类健康构成了严重威胁,如H3N8、H5N1、H5N6、H7N9、H9N2、H10N3亚型AIVs[25-31]。甲型流感病毒的宿主特异性决定了其一般难以跨物种感染人,有多种因素阻止了流感病毒的外溢,如病毒对宿主细胞的受体结合特异性[32]、病毒聚合酶的活性[33]以及相关宿主因子的限制[34]。本研究中的DK/GZ/674/21在NP蛋白上发生了Y52H的突变,提示该病毒可能不受人体内干扰素刺激基因BTN3A3的限制[19];对病毒受体结合特性的测定显示了该病毒已具备了低水平结合人源受体的能力。已有研究表明,H6亚型AIV HA蛋白上Q226L突变能使其结合人源受体能力强于结合禽源受体能力,并使其能在豚鼠间通过飞沫传播[35];在感染人的H6N1亚型AIV发现其HA蛋白发生了E190V和G228S突变,使得病毒获得了结合人源受体的能力。本文中所研究的病毒虽然并未获得以上突变,但病毒已能不用预先适应便能在哺乳动物体内有效复制并有部分病毒具备结合人源唾液酸受体的能力,表明H6N1亚型AIV对公共卫生安全构成了潜在威胁。
4 结论
本研究系统性地分析了2019—2022年我国H6N1亚型禽流感病毒(AIV)生物学特性,结果表明,H6N1亚型AIV多分离自水禽,其与北美和东亚的野鸟源病毒亲缘关系密切,来源于水禽的 H6N1 亚型 AIV 传入我国鸡群后,部分病毒经过适应后可在鸡体内有效复制并能在鸡群间传播。H6N1病毒可在小鼠呼吸道内有效复制并且部分病毒获得结合人源受体能力,具有跨种感染人的潜在风险,对人类健康构成了一定的威胁。因此,应持续开展对H6N1亚型AIV的监测,了解其进化动态及跨种感染人的潜在风险。
[1] LANG G, FERGUSON A E, CONNELL M C, WILLS C G. Isolation of an unidentified hemagglutinating virus from the respiratory tract of turkeys. Avian Diseases, 1965, 9(4): 495-504.
[2] OLESIUK O M, SNOEYENBOS G H, ROBERTS D H. An influenza A virus isolated from turkeys. Avian Diseases, 1967, 11(2): 203.
[3] DOWNIE J C, LAVER W G. Isolation of a type A influenza virus from an Australian pelagic bird. Virology, 1973, 51(2): 259-269.
[4] ZHAO G, LU X L, GU X B, ZHAO K K, SONG Q Q, PAN J J, XU Q G, DUAN Z Q, PENG D X, HU S L, WANG X Q, LIU X F. Molecular evolution of the H6 subtype influenza A viruses from poultry in Eastern China from 2002 to 2010. Virology Journal, 2011, 8: 470.
[5] BI Y H, CHEN Q J, WANG Q L, CHEN J J, JIN T, WONG G, QUAN C S, LIU J, WU J, YIN R F, et al. Genesis, evolution and prevalence of H5N6 avian influenza viruses in China. Cell Host & Microbe, 2016, 20(6): 810-821.
[6] HUANG K, BAHL J, FAN X H, VIJAYKRISHNA D, CHEUNG C L, WEBBY R J, WEBSTER R G, CHEN H, SMITH G J D, PEIRIS J S M, GUAN Y. Establishment of an H6N2 influenza virus lineage in domestic ducks in Southern China. Journal of Virology, 2010, 84(14): 6978-6986.
[7] HUANG K, ZHU H C, FAN X H, WANG J, CHEUNG C L, DUAN L, HONG W S, LIU Y M, LI L F, SMITH D K, CHEN H L, WEBSTER R G, WEBBY R J, PEIRIS M, GUAN Y. Establishment and lineage replacement of H6 influenza viruses in domestic ducks in Southern China. Journal of Virology, 2012, 86(11): 6075-6083.
[8] CUI J Q, CUI P F, SHI J Z, FAN W F, XING X, GU W L, ZHANG Y C, ZHANG Y P, ZENG X Y, JIANG Y P, et al. Continued evolution of H6 avian influenza viruses isolated from farms in China between 2014 and 2018. Transboundary and Emerging Diseases, 2022, 69(4): 2156-2172.
[9] ZHANG G H, KONG W L, QI W B, LONG L P, CAO Z X, HUANG L Z, QI H T, CAO N, WANG W H, ZHAO F R, et al. Identification of an H6N6 swine influenza virus in Southern China. Infection, Genetics and Evolution: Journal of Molecular Epidemiology and Evolutionary Genetics in Infectious Diseases, 2011, 11(5): 1174-1177.
[10] WEI S H, YANG J R, WU H S, CHANG M C, LIN J S, LIN C Y, LIU Y L, LO Y C, YANG C H, CHUANG J H, et al. Human infection with avian influenza A H6N1 virus: An epidemiological analysis. The Lancet Respiratory Medicine, 2013, 1(10): 771-778.
[11] YUAN J, ZHANG L, KAN X Z, JIANG L, YANG J K, GUO Z C, REN Q Q. Origin and molecular characteristics of a novel 2013 avian influenza a(H6N1) virus causing human infection in Taiwan. Clinical Infectious Diseases, 2013, 57(9): 1367-1368.
[12] CHEUNG C L, VIJAYKRISHNA D, SMITH G J D, FAN X H, ZHANG J X, BAHL J, DUAN L, HUANG K, TAI H, WANG J, et al. Establishment of influenza A virus (H6N1) in minor poultry species in Southern China. Journal of Virology, 2007, 81(19): 10402-10412.
[13] LEE M S, CHANG P C, SHIEN J H, CHENG M C, CHEN C L, SHIEH H K. Genetic and pathogenic characterization of H6N1 avian influenza viruses isolated in Taiwan between 1972 and 2005. Avian Diseases, 2006, 50(4): 561-571.
[14] HOFFMANN E, STECH J, GUAN Y, WEBSTER R G, PEREZ D R. Universal primer set for the full-length amplification of all influenza A viruses. Archives of Virology, 2001, 146(12): 2275-2289.
[15] ZHANG D, GAO F L, JAKOVLIĆ I, ZOU H, ZHANG J, LI W X, WANG G T. PhyloSuite: An integrated and scalable desktop platform for streamlined molecular sequence data management and evolutionary phylogenetics studies. Molecular Ecology Resources, 2020, 20(1): 348-355.
[16] SUCHARD M A, LEMEY P, BAELE G, AYRES D L, DRUMMOND A J, RAMBAUT A. Bayesian phylogenetic and phylodynamic data integration using BEAST 1.10. Virus Evolution, 2018, 4(1): vey016.
[17] 崔鹏飞, 卢昆鹏, 陈思, 肖丽, 关立峥, 邓国华, 陈化兰. 两株H3N8亚型禽流感病毒(AIV)的生物学特性. 农业生物技术学报, 2016, 24(7): 980-986.
CUI P F, LU K P, CHEN S, XIAO L, GUAN L Z, DENG G H, CHEN H L. Biological Characteristic of Two H3N8 Subtype Avian influenza viruses(AIV). Journal of Agricultural Biotechnology, 2016, 24(7): 980-986. (in Chinese)
[18] GAO Y W, ZHANG Y, SHINYA K, DENG G H, JIANG Y P, LI Z J, GUAN Y T, TIAN G B, LI Y B, SHI J Z, et al. Identification of amino acids in HA and PB2 critical for the transmission of H5N1 avian influenza viruses in a mammalian host. PLoS Pathogens, 2009, 5(12): e1000709.
[19] PINTO R M, BAKSHI S, LYTRAS S, ZAKARIA M K, SWINGLER S, WORRELL J C, HERDER V, HARGRAVE K E, VARJAK M, CAMERON-RUIZ N, et al. BTN3A3 evasion promotes the zoonotic potential of influenza A viruses. Nature, 2023, 619: 338-347.
[20] TADA T, SUZUKI K, SAKURAI Y, KUBO M, OKADA H, ITOH T, TSUKAMOTO K. NP body domain and PB2 contribute to increased virulence of H5N1 highly pathogenic avian influenza viruses in chickens. Journal of Virology, 2011, 85(4): 1834-1846.
[21] MUNSTER V J, BAAS C, LEXMOND P, WALDENSTRÖM J, WALLENSTEN A, FRANSSON T, RIMMELZWAAN G F, BEYER W E P, SCHUTTEN M, OLSEN B, et al. Spatial, temporal, and species variation in prevalence of influenza A viruses in wild migratory birds. PLoS Pathogens, 2007, 3(5): e61.
[22] YAO Z Z, ZHENG H B, XIONG J S, MA L P, GUI R, ZHU G L, LI Y, YANG G X, CHEN G, ZHANG J, CHEN Q J. Genetic and pathogenic characterization of avian influenza virus in migratory birds between 2015 and 2019 in central China. Microbiology Spectrum, 2022, 10(4): e0165222.
[23] KANG H M, JEONG O M, KIM M C, KWON J S, PAEK M R, CHOI J G, LEE E K, KIM Y J, KWON J H, LEE Y J. Surveillance of avian influenza virus in wild bird fecal samples from South Korea, 2003-2008. Journal of Wildlife Diseases, 2010, 46(3): 878-888.
[24] BAHL J, VIJAYKRISHNA D, HOLMES E C, SMITH G J D, GUAN Y. Gene flow and competitive exclusion of avian influenza A virus in natural reservoir hosts. Virology, 2009, 390(2): 289-297.
[25] GU W L, SHI J Z, CUI P F, YAN C, ZHANG Y P, WANG C C, ZHANG Y C, XING X, ZENG X Y, LIU L L, et al. Novel H5N6 reassortants bearing the clade 2.3.4.4b HA gene of H5N8 virus have been detected in poultry and caused multiple human infections in China. Emerging Microbes & Infections, 2022, 11(1): 1174-1185.
[26] YIN X, DENG G H, ZENG X Y, CUI P F, HOU Y J, LIU Y J, FANG J Z, PAN S X, WANG D X, CHEN X H, et al. Genetic and biological properties of H7N9 avian influenza viruses detected after application of the H7N9 poultry vaccine in China. PLoS Pathogens, 2021, 17(4): e1009561.
[27] ZHANG Y C, SHI J Z, CUI P F, ZHANG Y P, CHEN Y, HOU Y J, LIU L L, JIANG Y P, GUAN Y T, CHEN H L, et al. Genetic analysis and biological characterization of H10N3 influenza A viruses isolated in China from 2014 to 2021. Journal of Medical Virology, 2023, 95(2): e28476.
[28] YANG R G, SUN H L, GAO F, LUO K W, HUANG Z, TONG Q, SONG H, HAN Q Q, LIU J Y, LAN Y, et al. Human infection of avian influenza A H3N8 virus and the viral origins: a descriptive study. The Lancet Microbe, 2022, 3(11): e824-e834.
[29] ZENG X Y, HE X W, MENG F, MA Q, WANG Y, BAO H M, LIU Y J, DENG G H, SHI J Z, LI Y B, et al. Protective efficacy of an H5/H7 trivalent inactivated vaccine (H5-Re13, H5-Re14, and H7-Re4 strains) in chickens, ducks, and geese against newly detected H5N1, H5N6, H5N8, and H7N9 viruses. Journal of Integrative Agriculture, 2022, 21(7): 2086-2094.
[30] KANDEIL A, PATTON C, JONES J C, JEEVAN T, HARRINGTON W N, TRIFKOVIC S, SEILER J P, FABRIZIO T, WOODARD K, TURNER J C, et al. Rapid evolution of a(H5N1) influenza viruses after intercontinental spread to North America. Nature Communications, 2023, 14: 3082.
[31] JIN Y F, CUI H, JIANG L N, ZHANG C, LI J J, CHENG H L, CHEN Z H, ZHENG J, ZHANG Y D, FU Y Y, et al. Evidence for human infection with avian influenza a(H9N2) virus via environmental transmission inside live poultry market in Xiamen, China. Journal of Medical Virology, 2023, 95(1): e28242.
[32] ROGERS G N, PAULSON J C. Receptor determinants of human and animal influenza virus isolates: Differences in receptor specificity of the H3 hemagglutinin based on species of origin. Virology, 1983, 127(2): 361-373.
[33] LONG J S, GIOTIS E S, MONCORGÉ O, FRISE R, MISTRY B, JAMES J, MORISSON M, IQBAL M, VIGNAL A, SKINNER M A, BARCLAY W S. Species difference in ANP32A underlies influenza A virus polymerase host restriction. Nature, 2016, 529: 101-104.
[34] MÄNZ B, DORNFELD D, GÖTZ V, ZELL R, ZIMMERMANN P, HALLER O, KOCHS G, SCHWEMMLE M. Pandemic influenza A viruses escape from restriction by human MxA through adaptive mutations in the nucleoprotein. PLoS Pathogens, 2013, 9(3): e1003279.
[35] QU Z Y, MA S J, KONG H H, DENG G H, SHI J Z, LIU L L, SUZUKI Y, CHEN H L. Identification of a key amino acid in hemagglutinin that increases human-type receptor binding and transmission of an H6N2 avian influenza virus. Microbes and Infection, 2017, 19(12): 655-660.
Biological characteristics of H6N1 subtype avian influenza virus from 2019 to 2022 in China
Chen Yuan,Cui PengFei, SHI Jianzhong, Zhang YuanCheng, Yu QingQing, Yan Cheng, Zhang YaPing, Wang CongCong,Zhang Jie, Wang Yan, Deng GuoHua, Chen HuaLan
Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences/State Key Lab for Animal Disease Control and Prevention/National Poultry Laboratory Animal Resource Center, Harbin 150069
【Background】H6 avian influenza virus (AIV) is widely prevalent in southern China, which is one of the most common subtypes of AIVs circulating in poultry in China. H6N1 AIVs frequently undergo gene reassortment events with other wild bird-origin virus, which can be a donor to provide internal gene segments to highly pathogenic AIVs, which may lead to the emergence of novel virus and threaten human health.【Objective】 The aim of this study was to investigate the evolution and biological characteristics of H6N1 AIVs in China, so as to provide valuable data for the prevention and control of avian influenza in China.【Method】From 2019 to 2022, cloacal and throat swabs were collected from live poultry markets and breeding farms across 25 provinces or autonomous regions in China. 7 H6N1 viruses were isolated by inoculating into chicken embryos. The complete genome sequences were determined, followed by analyzing their phylogenetic relationships, receptor binding properties, as well as replication in SPF chickens and BALB/c mice.【Result】The phylogenetic analysis revealed that the genes of the 7 H6N1 AIVs were highly homologous to those of wild bird-origin viruses from North America and Southeast Asia, indicating a complex genetic origin with significant genetic diversity. According to the Bayesian evolution analysis, the HA gene of H6 subtype AIVs had many times of intercontinental transmission in the history, and the Eurasian lineage strains also had a long time of circulation in North America.The HA gene of one strain of the virus was highly homologous to that of the North American strain. Based on the results of Bayesian evolutionary analysis, it was hypothesized that the virus was introduced to China via wild birds after undergoing complex genetic reassortment in wild birds. Analysis of specific amino acid sites revealed that the cleavage site of HA protein was PQIETR↓GLF, which was the signature of low pathogenic AIVs. In addition, one other virus had a Y52H mutation in the NP protein, which was critical in BTN3A3 evasion. Receptor binding analysis demonstrated that some of the H6N1 AIVs bound to both avian-type receptor and human-type receptor, however, their affinity towards human receptors was weaker compared with avian receptors. Infectivity experiments on SPF chickens indicated that flocks was still able to shed virus up through oropharyngeal and cloacal routes after infection with A/chicken/Jiangxi/S40445/2019(H6N1) and that the virus could be transmitted via contact within flocks. Only a few chickens infected with A/duck/Jiangxi/S10941/2019(H6N1) shed virus through their oropharyngeal tract, and the virus could not be transmitted via contact among chickens. The infectivity experiments conducted on mice showed that H6N1 subtype AIVs could replicate in the respiratory organs of infected mice without prior adaptation, but display low pathogenicity levels in mice.【Conclusion】Most of the genes of H6N1 subtype AIV isolated in China from 2019 to 2022 were derived from wild bird-origin viruses, and those migratory birds could introduce the viruses into China via the East Asia-Australasian migratory flyway. Some of the H6 AIVs bound to human-type receptors and replicate in the respiratory organs of mice suggested that H6N1 viruses posed a potential threat to human health.
H6N1; avian influenza virus; intercontinental transmission; reassortment; infectivity

10.3864/j.issn.0578-1752.2024.09.015
2023-10-27;
2023-12-24
国家重点研发计划(2021YFD1800201)
陈源,E-mail:charlesyg1@163.com。通信作者邓国华,Tel:0451-51051806;E-mail:dengguohua01@caas.cn
(责任编辑 林鉴非)

