基于网络药理学和实验验证探讨麦门冬汤治疗特发性肺纤维化的作用机制
马 先,于明玥,周博文,李泽峰,李传慧,辛玲杰,贾新华
(1.山东中医药大学中医学院,山东 济南 250014;2.山东中医药大学第一临床医学院,山东 济南 250014;3.山东大学附属公共卫生临床中心/山东省公共卫生临床中心中西医结合科,山东 济南 250013;4.山东中医药大学附属医院呼吸与危重症医学科,山东 济南 250014)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种慢性进行性间质性肺疾病,病因不明,预后不良[1]。流行病学研究显示[2],IPF 在全球范围内的发生率和患病率介于每万人0.09~1.30 例,并且这一数字随着时间推移呈现增长趋势。在治疗IPF 患者时,尼达尼布和吡非尼酮这两种药物已经获得了批准使用,它们具有减缓肺功能衰退和延缓病情恶化的效果,但同时也存在与副作用和耐药性相关的问题[3,4]。而中医药具有多成分、多靶点、多通路的独特优势,临床治疗特发性肺纤维化疗效可观,有待发掘[5-7]。
然中医病名中未有IPF 的记载,大多数现代学者基于肺纤维化的临床特征和病理进程,将其归类为中医学中的“肺痿”和“肺痹”范畴,病理特点包括“肺燥叶焦”“肺气亏虚”“津枯液亡”“络阻血瘀”[8]。在疾病的发展过程中,肺燥、气虚和阴损相互作用,故中医理论认为本病治宜养阴益气。《金匮要略·肺痞肺痈咳嗽上气病》篇中指出:“大 (火) 逆上气,咽喉不利,止逆下气者,麦门冬汤主之。”在临床实践中,使用麦门冬汤来治疗 IPF 能有效地缓解患者的症状,并且效果较常规治疗方法更佳[9]。但麦门冬汤的现代研究未集中在中药复方上,药物作用靶点对应疾病发病机制不明,且忽略了多信号通路的相互联系和影响[10]。本文拟通过网络药理学结合相应的动物实验研究,探讨麦门冬汤治疗 IPF 的作用机制,以期为中医中药临床治疗肺纤维化提供新的治疗靶点。
1 网络药理学
1.1 麦门冬汤活性成分及相关靶点筛选
利用TCMSP 数据库[11],设置口服生物利用度(OB)不小于30%和药物相似性(DL)不小于0.18作为筛选标准,对麦门冬汤中各个药材进行检索,以识别出各药物中的有效活性成分。对于在TCMSP 数据库中未能检索到的药物,可以借助ETCM数据库(http://www.tcmip.cn/ETCM/index.php/Home/Index/)进行查询,并结合查阅已发表的文献来收集药物成分。接着,使用SwissADME 平台(http://www.swissadme.ch/)进行成分的活性筛选,从而确定药物的有效活性成分。随后,通过SwissTargetPredict 网站(http://www.swisstargetprediction.ch/)执行靶点预测工作。如果在SwissTargetPrediction 网站上无法确认某个成分的靶点信息,可以采用TCMSP 网站提供的靶点数据。随后,通过UniProt 数据库[12]对这些靶点信息进行标准化处理,以获取规范化的成分靶点数据。
1.2 IPF 相关靶点筛选
使用“Idiopathic Pulmonary Fibrosis”作为关键字词,在OMIM 数据库[13]和GeneCards 数据库[14]中查询,以获得与 IPF 相关的靶点信息。
1.3 麦门冬汤与特发性肺纤维化共同靶点Venn 图构建
利用Venn diagrams 的在线绘图服务(http://bioinformatics.psb.ugent.be/webtools/Venn/),对IPF 的相关靶点与麦门冬汤的靶点进行交集分析。通过绘制靶蛋白的Venn 图,筛选出中药与疾病共有的关键靶点。
1.4 蛋白质-蛋白质(PPI)相互作用网络构建及核心靶点的筛选
导入IPF 与麦门冬汤共同靶点至String 数据库[15]以执行蛋白质-蛋白质相互作用(PPI)分析。随后,将得到的PPI 结果输入到Cytoscape 3.9.1 软件中,进行网络的拓扑属性分析,这包括计算每个节点的连接度(Degree)、介度(Betweenness)以及紧密度(Closeness)。基于超过中位数的标准来筛选出核心靶点,如果核心靶点数量较多,将进一步进行筛选,从而构建出核心靶点与成分之间的网络图,并识别出关键的活性成分。
1.5 共同靶点的GO富集分析和KEGG通路分析
将共有靶点导入DAVID 数据库[16]中,以执行GO 及KEGG 通路富集分析。
2 动物实验
2.1 实验动物
30 只SPF 级别的健康雄性SD 大鼠,年龄为7周,体重在(180±20) g 范围内,购于山东济南朋悦实验动物繁育有限公司,室内环境实行12 h 的光照周期和12 h 的黑暗周期进行饲养,提供标准的食物和水源,同时保持室温在大约(22±1)℃和大约40%的相对湿度。本研究通过山东中医药大学附属医院实验动物伦理委员会审查(实验动物伦理审查批件号:2020-45)。本研究所采用的所有实验方案均遵循中国伦理委员会制定的关于实验动物使用的指导准则。
2.2 实验试剂
麦门冬汤组成:麦冬,人参,半夏,大枣,甘草(比例7∶1.5∶1∶1∶1),购自山东中医药大学附属医院,按照人与动物体表面积折算公式[17],大鼠(0.2 kg)等效剂量换算为人类(70 kg)的6.3 倍,计算生药给药剂量为12.6 g 生药/kg 体质量,按照大鼠每100 g 体重给药体积为1 mL,确定药物浓度,将原药材煎煮后浓缩为中药液,按大鼠实际质量灌胃。硫酸博来霉素购自赛默飞世尔科技有限公司;反转录试剂盒购自山东思科捷生物技术有限公司;多聚甲醛购自成都市科隆化学品有限公司。
2.3 实验仪器
高速组织研磨仪(武汉赛维尔生物科技有限公司),酶标检测仪(美国BioTeK 仪器有限公司),荧光定量PCR 仪(美国Bio-rad 科技公司)。
2.4 实验方法
2.4.1 动物分组 在经过一周的适应性饲养之后,30 只大鼠被随机分配到三个不同的组别:空白对照组、模型对照组和麦门冬汤治疗组,每个组别包含10 只大鼠。
2.4.2 动物造模 按照Szapiel 等的方法,通过硫酸博来霉素的气管内滴注来建立大鼠的肺纤维化模型。首先,大鼠通过腹腔注射1.5%的戊巴比妥钠(剂量为30 mg/kg)进行麻醉。麻醉后,大鼠被仰卧固定在倾斜35°的板上,使用75%的医用酒精对颈部皮肤进行常规消毒。然后在颈部中线切开2~3 cm 的皮肤,利用血管钳进行钝性分离肌肉以露出气管。接着,用4 号针头穿过气管软骨环的间隙,向心脏方向刺入气管,并通过空针筒注射约0.3 mL 含有硫酸博来霉素(剂量为7 mg/kg)的溶液。注射完毕后,迅速将鼠板垂直旋转并竖直放置3 min,以便让药物在肺部均匀分布。之后缝合肌肉和皮肤,进行再次消毒,并注射青霉素钠以预防感染。对照组大鼠则只接受等量生理盐水的气管内注射,其他操作与造模组相同。除空白对照组以外,其余各组均被制成肺纤维化模型。
2.4.3 动物给药 各组动物分别于造模第2 天开始灌胃,按照每10 mL/kg 给药,同时抽取与之相等剂量的生理盐水,给予模型对照组和空白对照组灌胃,每日一次,连续给药28 d。
2.4.4 标本采集 在给药28 d 后,通过左心室取血的方法处死大鼠。无菌操作下打开胸膛,取出肺组织,随后将两肺分离;将右肺置于4%多聚甲醛溶液中进行固定,并进行石蜡包埋以备后续的病理学切片分析;左肺则保存于-80℃的冷冻条件下,用于PCR 检测。
2.4.5 肉眼标本观察 肉眼观察各组大鼠双肺外观、肺叶轮廓、体积、颜色、弹性等。
2.4.6 肺组织形态观察 取病理切片,行HE 染色,检测肺组织病理变化。
2.4.7 实时荧光定量PCR(RT-PCR)分析 取大鼠肺组织,Trizol 法抽提总RNA,Nanodrop 和琼脂糖凝胶电泳检测其纯度和浓度。将总RNA 溶液稀释至 200 ng/μL,用MLV 反转录酶体系,反转录成cDNA,然后进行 RT-PCR 反应。反应条件: 95 ℃,10 min;95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸20 s,共40 个循环。分别计算每个样本内参基因平均CT值,目的基因平均CT 值,根据公式“ΔCT=目的基因平均CT 值-内参基因平均CT 值”计算各个样本的ΔCT,进而求出各组数据的平均ΔCT,根据公式“ΔΔCT=处理组ΔCT-空白组ΔCT”计算各组数据的ΔΔCT,比较2-ΔΔct的大小关系 计算各处理组相对的基因转录水平。包括TGF-β1、α-SMA、IL-4、IFN-γ、LC3-Ⅱ、beclin1的mRNA。 引物序列见表1。

表1 PCR 引物序列Tab 1 PCR primer sequences
2.5 统计学分析
使用SPSS 26.0 软件进行数据的统计分析,计量资料以均数±标准差(±s)表示,符合正态分布并且方差齐的情况下,采用独立样本t检验进行比较;若不满足方差齐,则应用校正的t检验。实验结果中,当P<0.05 时,差异具有统计学意义。
3 结果
3.1 麦门冬汤有效活性成分筛选
麦门冬汤中5 味中药的159 种活性成分,其中麦冬23 种,人参17 种,甘草88 种,半夏12 种,大枣19 种,有6 种成分为共有成分,见表2。

表2 麦门冬汤共同化合物成分信息Tab 2 Common compound composition of Maimendo decoction
3.2 中药与疾病共同靶点Venn 图的绘制
在进行检索和筛选后,共识别出4 190 个针对IPF 治疗的潜在靶点。同时,识别出674 个与麦门冬汤相关的靶点。通过取交集,共确定了402 个在IPF 治疗中与麦门冬汤相关的潜在靶蛋白。为了直观展示这些靶蛋白之间的关系,使用了在线韦恩图工具(Venndiagrams)来绘制了靶蛋白的韦恩图,见图1。
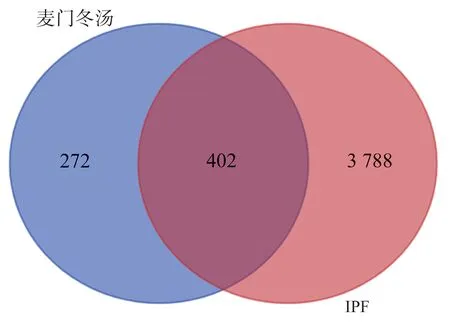
图1 麦门冬汤治疗特发性肺纤维化的交集靶点Venn 图Fig 1 Venn plot of intersection targets of Maimendong decoction in the treatment of idiopathic pulmonary fibrosi s
3.3 “中药-活性成分-疾病-靶点”网络图的构建
通过将麦门冬汤与IPF 的共有靶点信息输入到Cytoscape 3.9.1 软件中进行图形化展示。生成的网络图包含1 个疾病节点、5 种中药成分、以及159 个活性成分节点。“中药-活性成分-疾病-靶点”网络图,见图2。
图2 中药-活性成分-疾病-靶点网络图Fig 2 Network diagram of traditional Chinese medicine-active ingredients-diseases-targets
3.4 PPI 网络拓扑分析及核心靶点的筛选
PPI 网络基于STRING 数据库构建,分析麦门冬汤和特发性肺纤维化的402 个共有靶点,设置默认置信度并隐藏孤立靶点,所得PPI 网络图,共含9 970 条连线。使用NetworkAnalyzer 筛选核心靶点,通过cytoscape3.9.1 插件设置连接度、介度和紧密度,所得麦门冬汤治疗特发性肺纤维化的关键靶点基因为转化生长因子-β1(TGF-β1)、白细胞介素-4(IL-4)、蛋白激酶(AKT1)、肿瘤坏死因子(TNF)、白蛋白(ALB)、白细胞介素-6(IL-6)、血管内皮生长因子-A(VEGFA)、表皮生长因子受体1(EGFR)、白细胞介素-1b(IL-1β)、非受体酪氨酸激酶(SRC)、胱天蛋白酶3(CASP3)、丝裂原活化蛋白激酶(MAPK3)、表皮生长因子(EGF)、基质金属蛋白酶-9(MMP9)、白细胞介素-8(CXCL8)等50 个,见图3。

图3 麦门冬汤治疗特发性肺纤维化的PPI 网络及关键靶点网络图Fig 3 PPI network and key target network diagram of Maimendong decoction in the treatment of idiopathic pulmonary fibrosis
3.5 麦门冬汤核心靶点GO 功能富集和KEGG 通路富集
GO 分析包括生物途径(BiologicalProcess,BP)、细胞组分(CellularComponent,CC)、分子功能(MolecularFunction,MF)。PPI 网络核心靶点的GO、KEGG 富集结果显示,核心靶点的BP 与细胞对氮化合物的反应、炎症反应、细胞凋亡、氧化应激反应等相关;CC 与膜筏、受体复合物、细胞外基质等相关;MF 与蛋白激酶活性、激酶结合、蛋白酪氨酸激酶活性等相关,见图4。KEGG 除了癌症、病毒相关通路外,与PI3K-Akt 信号通路、丝裂原激活蛋白激酶(MAPK)信号通路、cAMP 信号通路、钙信号通路、细胞衰老等信号通路密切相关,见图5。

图4 麦门冬汤核心靶点GO 富集分析柱状图Fig 4 Bar chart of GO enrichment analysis for the core target of Maimendong decoction

图5 麦门冬汤核心靶点KEGG 通路富集分析气泡图Fig 5 Bubble diagram of KEGG pathway enrichment analysis for the core target of Maimendong decoction
3.6 肉眼标本观察
空白对照组大鼠肺外观光滑润泽,呈淡红色,肺叶轮廓清晰,体积大小适中,组织柔软,富有弹性。模型对照组大鼠肺外观见大量瘢痕,组织结构破坏,呈苍白色或红黑色,肺叶轮廓不清晰,体积缩小,弹性变差,质地较硬。麦门冬汤治疗组大鼠肺外观少量瘢痕组织,呈暗红色,肺叶轮廓较清晰,体积大小适中,弹性一般。与模型对照组比较,麦门冬汤治疗组大鼠双肺外观、颜色、肺叶轮廓、体积弹性有所改善。见图6。

图6 麦门冬汤对博来霉素肺纤维化大鼠肺纤维化程度的影响Fig 6 Effect of Maimendong decoction on the degree of pulmonary fibrosis in rats with bleomycin induced pulmonary fibrosis
3.7 肺组织形态的观察
在空白对照组的大鼠中,肺组织的结构保持完好,未观察到显著的形态学改变。而在模型对照组的大鼠中,肺泡的结构受损,表现为肺泡间隔增宽、肺泡结构破损不完整,并伴随着炎症细胞的浸润以及纤维细胞和纤维组织的过度增生。在麦门冬汤治疗组的大鼠中,肺泡结构有轻微的紊乱,仍可见到一定程度的炎症细胞渗透和纤维细胞及组织的增生,但这些病理变化相较于模型对照组有了明显减轻,详见图7。
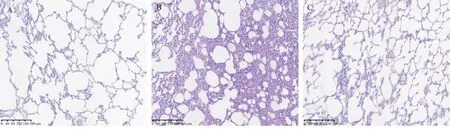
图7 各组大鼠肺组织H&E 染色结果(×100)Fig 7 H&E staining results of lung tissue in each group of rats(×100)
3.8 麦门冬汤对大鼠TGF-β1、α-SMA、IL-4、IFN-γ、LC3-Ⅱ、beclin1 mRNA 的影响
定量PCR 结果显示,与空白对照组相比,模型对照组的TGF-β1、α-SMA、IL-4mRNA 表达水平显著上升(P<0.05),LC3-Ⅱ、beclin1、IFN-γmRNA表达水平显著下降(P<0.05);与模型对照组相比,麦门冬汤治疗组可显著下调TGF-β1、α-SMA、IL-4的mRNA 相对表达水平(P<0.05),显著上调LC3-Ⅱ、beclin1、IFN-γmRNA 的相对表达水平(P<0.05),差异具有统计学意义,见图8、表3。

图8 麦门冬汤对大鼠TGF-β1、α-SMA、IL-4、IFN-γ、LC3-Ⅱ、beclin1 mRNA 的影响Fig 8 Maimendong decoction on TGF-β1,α- SMA, IL-4, IFN- γ, LC3-Ⅱ and beclin1 mRNA in rats
表3 麦门冬汤对大鼠TGF-β1、α-SMA、IL-4、IFN-γ、LC3-Ⅱ、beclin1 mRNA 的影响(n=3,±s)Tab 3 Maimendong decoction on TGF-β1,α- SMA, IL-4, IFN- γ,LC3-Ⅱ and beclin1 mRNA in rats(n=3,±s)
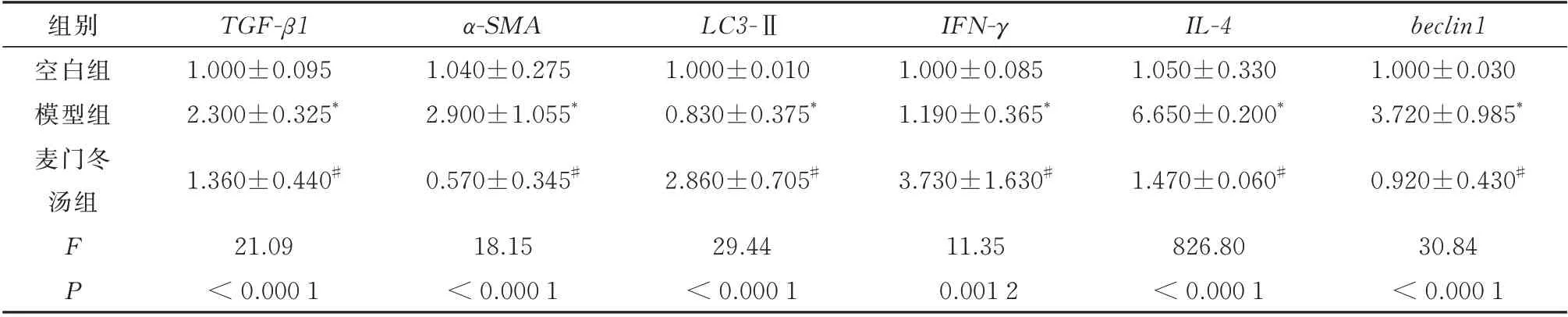
表3 麦门冬汤对大鼠TGF-β1、α-SMA、IL-4、IFN-γ、LC3-Ⅱ、beclin1 mRNA 的影响(n=3,±s)Tab 3 Maimendong decoction on TGF-β1,α- SMA, IL-4, IFN- γ,LC3-Ⅱ and beclin1 mRNA in rats(n=3,±s)
注:与空白组相比,*P<0.05;与模型组相比,#P<0.05。
组别TGF-β1α-SMA LC3-ⅡIFN-γIL-4beclin1空白组模型组麦门冬汤组1.000±0.095 2.300±0.325*1.360±0.440#1.040±0.275 2.900±1.055*0.570±0.345#1.000±0.010 0.830±0.375*2.860±0.705#1.000±0.085 1.190±0.365*3.730±1.630#1.050±0.330 6.650±0.200*1.470±0.060#1.000±0.030 3.720±0.985*0.920±0.430#30.84< 0.000 1 FP 21.09< 0.000 1 18.15< 0.000 1 29.44< 0.000 1 11.35 0.001 2 826.80< 0.000 1
4 讨论
4.1 麦门冬汤成分分析
通过药物-活性成分-疾病-靶点网络,共筛选得到槲皮素、山奈酚、人参皂苷等159 种治疗IPF 的潜在活性成分。槲皮素能够通过抑制 TGF-β1 信号传导缓解肺纤维化[18],并与核转录因子-κB(NF-κB)信号通路、SphK1/S1P 信号通路等有关[19]。山奈酚通过靶向TGF-β 下调Smad2 和Smad3 磷酸化,抑制成纤维细胞胶原合成、增殖和活化治疗纤维增生性疾病[20]。人参皂苷在降低胶原产生和增强细胞对氧化损伤的防御能力方面表现出显著效果,具有抗肺纤维化的潜在能力,这种效果与TGF-β 的抑制作用有关[21,22]。以上研究提示:槲皮素、山奈酚、人参皂苷通过多通路作用于TGF-β 等靶点来发挥抗纤维化作用。
4.2 麦门冬汤主要靶点分析
GO 富集分析表明,麦门冬汤治疗IPF 可能涉及对氮化合物的反应、炎症反应、细胞凋亡以及氧化应激反应等多个生物学途径。通过对PPI 网络进行拓扑学分析,预测出TGF-β1、IL-4、AKT1、TNF、ALB、IL-6、VEGFA、EGFR、IL1-β、SRC、CASP3、MAPK3、EGF、MMP9、CXCL8 等50 个核心靶点。前人已通过实验验证麦门冬汤调节p-AKT、AKT及VEGF 表达[23]。其中,TGF-β1 具有促进成纤维细胞激活与增殖的作用,这会引起细胞外基质的堆积。TGF-β1 的表达水平上升与多种纤维化疾病的发生有关,并且其表达的多寡往往与疾病的严重性成正比。因此,针对TGF-β1 及其信号通路的抑制策略在治疗肺纤维化以及其他纤维化疾病方面显示出了巨大的疗效潜力[24,25]。2 型免疫促进损伤后组织再生和纤维化,其特征是产生IL-4,IL-5,IL-9和IL-13,表达失调会导致许多不同器官系统中病理性纤维化的发展[26]。基于上述研究结果,可以推测TGF-β1 和IL-4 可能是治疗IPF 的关键靶点,它们有望成为针对IPF 防治的分子机制研究的重点。
4.3 麦门冬汤主要通路分析
KEGG 富集分析表示,PPI 的核心靶点主要通过PI3K-Akt 信号通路、MAPK 信号通路、cAMP 信号通路、钙信号通路等信号通路发挥作用。PI3K-AKT 信号通路介导自噬影响多种疾病,多个实验表明,PI3K/Akt/mTOR 信号通路能够抑制支气管上皮细胞自噬,促进肺部炎症和纤维化[27-29],并与TGF-β1-PI3K-Akt 信号通路相关[30]。MAPK 家族,包含c-Jun N 末端激酶、p38 MAPK 以及细胞外信号相关激酶,这些激酶参与调控多种细胞功能,并在平衡调节自噬与细胞凋亡过程中扮演关键角色[31],并受TGF-β1 调节促进IPF 的纤维化过程[32]。由以上研究可知,麦门冬汤可能通过抑制PI3K-Akt信号通路、MAPK 信号通路等信号通路介导细胞自噬,延缓肺纤维化进程。
4.4 实验验证分析
自噬,是一种基本的细胞稳态过程,可响应细胞内或细胞外因素诱导,降解和回收细胞蛋白并去除受损的细胞器。LC3 蛋白质家族作为自噬体形成的结构成分起作用,是最好的表征形式,也是最广泛的自噬标志物。LC3 的胞质形式(LC3-Ⅰ)转化为脂化形式(LC3-Ⅱ)表明自噬体形成[33]。自噬体形成前,beclin 1 需与自噬前体结合参与启动自噬过程[34]。在IPF 中,自噬是一种通过调节胶原蛋白降解和自噬相关细胞死亡来控制肺部纤维化发展的保护机制[35]。IPF 患者的肺上皮细胞和肺成纤维细胞,与用TGF-β1 激活的成纤维细胞,及博来霉素诱导的IPF 小鼠中自噬途径均有所减少[36]。实验数据表明,与空白组相比,模型组与麦门冬汤组LC3-Ⅱ mRNA 和beclin1mRNA 水平降低;与模型组相比,麦门冬汤组LC3-ⅡmRNA 和beclin1mRNA 水平增加,表明自噬能够改善博来霉素诱导的大鼠肺纤维化,麦门冬汤可通过增强自噬,抑制肺纤维化的发展。
此外,自噬还参与巨噬细胞极化的调节[37]。巨噬细胞可分为M1 表型和M2 表型,M1 和M2 巨噬细胞表型分别与促炎和促纤维化特征相对应。M1巨噬细胞活化通过细胞外基质基质降解金属蛋白酶和促炎细胞因子清除病原微生物并促进炎症,M2巨噬细胞活化通过抑制炎症反应和/或直接调节肺纤维化疾病的发展和进展,以及分化为表达胶原蛋白的纤维细胞样细胞的能力[38]。自噬抑制巨噬细胞M2 表型极化,M2 表达的标志物包括IL-4、TGF-β1,增加了M1 表达的标志物如IFN-γ。本实验数据表明,与空白组相比,模型组与麦门冬汤组IL-4mRNA、TGF-β1mRNA、IFN-γmRNA 水平升高;与模型组相比,麦门冬汤组IL-4mRNA、TGF-β1mRNA 水平降低,IFN-γ mRNA 水平升高,表明巨噬细胞参与肺损伤和修复具有促进和抑制纤维化的双重作用,麦门冬汤可以通过增强自噬调节巨噬细胞极化改善博来霉素诱导大鼠的肺纤维化。IFN-γ/IL-4 比例失调也提示其可能与Th1/Th2 细胞失衡有关[39],表明麦门冬汤纠正Th1/Th2 失衡来调控肺泡炎症及肺纤维化发展进程。
TGF-β1 长期以来一直被认为是涉及多个器官(包括皮肤,肝脏,肾脏和肺)的组织纤维化的中枢介质[40]。在IPF 的发展中,TGF-β1 同样起着核心作用。TGF-β1 通过MAPK 和ERK 信号通路等信号通路促进IPF 的纤维化过程[32]。因此,TGF-β1及其信号通路一直是开发抗纤维化药物的有吸引力的治疗靶点[41]。本实验数据表明,与空白组相比,模型组与麦门冬汤组TGF-β1mRNA、α-SMAmRNA 水平升高;与模型组相比,麦门冬汤组TGF-β1mRNA、α-SMAmRNA 水平降低,表明TGF-β1能够促进博来霉素诱导的大鼠肺纤维化,麦门冬汤可通过抑制TGF-β1 表达,抑制肺纤维化的发展。
并且,TGF-β1 介导自噬反应的调节[42]。成纤维细胞到肌成纤维细胞分化(FMD)是肺纤维化的重要特征,其中促纤维化细胞因子TGF-β1 起关键作用,而自噬作用在于维持正常的肺成纤维细胞的命运。TGF-β1 通过减少自噬通量介导FMD,促进肺纤维化进程,增强自噬可改善TGF-β1 介导的肺纤维化[43]。数据表明,与空白组相比,模型组和麦门冬汤组LC3-ⅡmRNA 和beclin1mRNA 水平降低,TGF-β1mRNA 水平升高;与模型组相比,麦门冬汤组LC3-ⅡmRNA 和beclin1mRNA 水平升高,TGF-β1mRNA 水平降低,表明麦门冬汤可通过增强自噬减弱TGF-β1 驱动的级联反应改善博来霉素诱导肺纤维化大鼠的治疗效果。
总结来看,网络药理学的分析表明,麦门冬汤治疗IPF 的机制涉及其多成分、多靶点和多途径的特性,尤其在调节细胞自噬、炎症反应和巨噬细胞极化等生物学过程上发挥关键作用。动物实验证实麦门冬汤能够降低IPF 模型大鼠肺组织中TGF-β1、α-SMA、IL-4mRNA 水平,增加LC3-Ⅱ、beclin1、IFN-γ mRNA水平,缓解肺纤维化。然而,由于IPF 的发病机制较为复杂,加之本实验的样本量有限,并未对网络药理学所预测的关键靶点进行全面的验证,网络药理学的结果仍可以为未来深入的机制性研究提供坚实的理论基础。
作者贡献度说明:
马先、于明玥、周博文、李泽峰:执笔撰写,李传慧、辛玲杰、贾新华:审校。
所有作者声明不存在利益冲突关系。

