基于HIF-1α/EGFR/MAPK1信号通路探讨龟鹿二仙胶对少弱精子症大鼠的保护作用
刘卓琳 冯芷莹 王康宇 黄家望 时佳宁 张成 李玲 何清湖
本文引用: 劉卓琳, 冯芷莹, 王康宇, 黄家望, 时佳宁, 张 成, 李 玲, 何清湖.基于HIF-1α/EGFR/MAPK1信号通路探讨龟鹿二仙胶对少弱精子症大鼠的保护作用[J]. 湖南中医药大学学报, 2024, 44(4): 572-579.
〔摘要〕 目的 探讨龟鹿二仙胶调控缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)/表皮生长因子受体(epidermal growth factor receptor, EGFR)/和丝裂原活化蛋白激酶(mitogen-activated protein kinase 1,MAPK1)信号通路对少弱精子症(oligoasthenozoospermia,OAS)大鼠的保护作用。方法 将48只SD雄性大鼠随机分为正常组,模型对照组,龟鹿二仙胶低剂量(0.65 g/kg)组、中剂量(1.25 g/kg)组、高剂量(2.5 g/kg)组和左卡尼汀组,每组8只。除正常组外,其他组均采用腺嘌呤灌胃给药进行造模。造模成功后进行灌胃给药进行干预,连续给药4周,记录大鼠一般情况,给药4周后进行取材处理。腹主动脉采血,ELISA法检测血清睾酮(testosterone,T)、雌二醇(estradiol,E2)、促卵泡激素(follicle-stimulating hormone,FSH)、促黄体生成激素(luteinizing hormone,LH)和催乳素(prolactin,PRL);分离肾组织,计算肾指数;分离右侧附睾,运用自动精子分析仪检测各组大鼠精子浓度和精子活力;HE染色观察睾丸组织病理改变;用试剂盒检测大鼠睾丸组织活性氧(reactive oxygen species,ROS)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)水平;免疫组化检测大鼠睾丸组织HIF-1α、EGFR和MAPK1的蛋白表达。结果 与模型对照组相比,不同剂量的龟鹿二仙胶均可显著增加大鼠的体质量(P<0.01),降低大鼠的肾指数(P<0.01),提高精子浓度和精子活力(P<0.01),改善大鼠的精子质量,并能有效减轻模型大鼠睾丸组织损伤程度,其中与龟鹿二仙胶低剂量组相比,龟鹿二仙胶高剂量组大鼠体质量、精子密度和精子活力均显著上升(P<0.05)。ELISA结果显示,与模型对照组相比,不同剂量龟鹿二仙胶能显著升高T和E2水平(P<0.05),且显著降低FSH、LH和PRL水平(P<0.05)。ROS、SOD和GSH-Px检测结果显示,与模型对照组相比,龟鹿二仙胶低、中、高剂量组ROS水平显著降低(P<0.05),龟鹿二仙胶中、高剂量组和左卡尼汀组SOD和GSH-Px活性显著升高(P<0.05)。免疫组化结果显示,与模型对照组相比,龟鹿二仙胶中、高剂量组和左卡尼汀组大鼠睾丸组织HIF-1α、EGFR、MAPK1水平显著降低(P<0.05)。结论 龟鹿二仙胶可能是通过HIF-1α/EGFR/MAPK1信号通路调节氧化应激来改善OAS。
〔关键词〕 少弱精子症;龟鹿二仙胶;HIF-1α/EGFR/MAPK1信号通路;精子活力;氧化应激
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.04.007
Protective effects of Guilu Erxian Glue on rats with oligoasthenospermia based on HIF-1α/EGFR/MAPK1 signaling pathway
LIU Zhuolin1, FENG Zhiying2, WANG Kangyu2, HUANG Jiawang1, SHI Jianing2, ZHANG Cheng1, LI Ling2*, HE Qinghu3,4*
1. College of Integrated Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. College of Chinese Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 3. Andrology Laboratory, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 4. College of Chinese Medicine, Hunan University of Medicine, Huaihua, Hunan 418000, China
〔Abstract〕 Objective To explore the protective effects of Guilu Erxian Glue (GLEXG) on rats with oligoasthenospermia (OAS) by regulating the hypoxia inducible factor-1α/epidermal growth factor receptor/mitogen-activated protein kinase 1 (HIF-1α/EGFR/MAPK1) signaling pathway. Methods Forty-eight male SD rats were randomized into normal, model control, low-dose GLEXG (0.65 g/kg), medium-dose GLEXG (1.25 g/kg), high-dose GLEXG (2.5 g/kg), and L-carnitine groups, with eight rats in each group. All groups except the normal group were administered adenine by gavage to create the model After successful modeling, the rats were intervened by intragastric administration for continuous four weeks, during which the general condition of the rats was recorded. After four weeks of administration, the rats were processed for sample collection. Blood was collected from the abdominal aorta. Serum testosterone (T), estradiol (E2), follicle-stimulating hormone (FSH), luteinizing hormone (LH), and prolactin (PRL) levels were measured by ELISA. Renal tissues were separated to calculate the renal index. The right epididymis was separated, and the sperm concentration and motility of each group were checked by automatic sperm analyzer. The pathological changes of testicular tissue were observed by HE staining. Reactive oxygen species (ROS), superoxide dismutase (SOD), and glutathione peroxidase (GSH-Px) levels in rat testicular tissue were examined by respective assay kits. Protein expressions of HIF-1α, EGFR, and MAPK1 in rat testicular tissue were checked by immunohistochemistry. Results Compared with the model control group, different doses of GLEXG significantly increased the body mass of rats (P<0.01), decreased their renal index of rats (P<0.01), improved sperm concentration and motility (P<0.01), thereby enhancing the sperm quality of rats and effectively reducing the degree of testicular tissue damage in the model rats. Compared with the low-dose GLEXG group, the high-dose group showed significant increase in body mass, sperm density, and sperm motility (P<0.05). ELISA results showed that compared with model control group, different doses of GLEXG significantly increased T and E2 levels (P<0.05), and significantly decreased FSH, LH, and PRL levels (P<0.05). The results of ROS, SOD, and GSH-Px indicated that compared with the model control group, ROS levels in low-, medium-, and high-dose GLXEG groups were significantly lower (P<0.05), while SOD and GSH-Px activities in medium- and high-dose GLXEG, and L-carnitine groups were significantly higher (P<0.05). Immunohistochemical results showed that compared with the model control group, the levels of HIF-1α, EGFR, and MAPK1 in rat testicular tissue of medium-, high-dose GLXEG and L-carnitine groups were significantly lower (P<0.05). Conclusion GLEXG may improve OAS by regulating oxidative stress through HIF-1α/EGFR/MAPK1 signaling pathway.
〔Keywords〕 oligoasthenospermia; Guilu Erxian Glue; HIF-1α/EGFR/MAPK1 signaling pathway; sperm motility; oxidative stress
近年来,我国先后实施了单独二孩、全面二孩、三胎开放政策,但是全国总和生育率仍然呈现出逐年缓慢下降的趋势,并未随之上升[1]。除经济和社会发展等方面的客观因素外,男性不育症是生育率降低的重要影响因素之一,而不育症中少弱精子症又占了约3/4的比例[2-3]。
少弱精子症(oligoasthenozoospermia,OAS)是指精子浓度<15×106/mL或精子总数<39×106/mL和精子总活动力<40%或前向运动率<32%,以精子数量及活力降低為主要特征,是造成男性不育或生育力下降的主要原因之一,其发生率占男性不育患者的70%左右[4]。OAS的发病原因十分复杂,包括附睾等器官的炎症引起精浆变异、精索静脉曲张、微量元素缺乏、睾丸发育受阻、精液量不足以及体内产生抗精子抗体等病因[5]。目前OAS主要通过促性腺激素、雌激素受体调节剂、芳香酶抑制剂、维生素和补充剂等化学药物进行治疗,一般以经验性治疗为主,治疗上存在不良反应、疗效不确切等问题,具有一定局限性[6]。氧化应激是一种由氧和活性氧(reactive oxygenspecies,ROS)引发的细胞损伤增加相关的状态,已经是全球公认的导致男性不育症的一个至关重要的原因。过量的ROS会导致机体内抗氧化防御机制的失衡,从而引发氧化应激,造成精子数量和精子活力的下降,甚至丧失[7-9]。
中药在改善OAS的精子质量方面显示出了其独特的优势,可改善全身新陈代谢,协调神经与内分泌、生殖系统功能,近年来已引起国内外学者的广泛关注[10-11]。基于OAS的主要病机是肾气虚弱、精血不足,其治疗主旨也基本围绕补肾进行。本课题组前期研究[12-14]表明,龟鹿二仙胶能较为明显改善OAS大鼠的生精细胞活性,恢复睾丸支持细胞的分泌功能,提高大鼠的生精功能,提高精子的质量和数量。龟鹿二仙胶最早由《医便》记载,主要由龟甲、鹿角、枸杞子、人参4味中药成分组成,具有益气壮阳、滋阴填精的功效,是一种改善男性生殖功能障碍的经典方剂,在临床应用中对肾精不足型精液异常患者的治疗取得了令人满意的效果[15]。但目前关于龟鹿二仙胶治疗OAS的研究尚少,且分子机制尚不明确,基于此,本研究建立OAS大鼠模型,观察腺嘌呤处理后的OAS大鼠睾丸组织病理变化及氧化应激情况,探讨龟鹿二仙胶对OAS的保护作用和机制,以期为龟鹿二仙胶治疗OAS提供实验依据和基础。
1 材料
1.1 动物来源
SPF级SD大鼠,雄性,48只,体质量220~240 g,购于湖南斯莱克景达实验动物有限公司,质量许可证号为430727221102014186,饲养于湖南中医药大学实验动物中心SPF级动物房。饲养温度20~26 ℃,湿度30%~70%,动物照度15~20 lx。本实验经湖南中医药大学实验动物伦理委员会审查通过,批号为LLBH-202212060003。
1.2 药物
龟鹿二仙胶由龟甲胶(湖南东健药业有限公司,批号:20170901,国药准字:Z43020570)、鹿角胶(湖南东健药业有限公司,批号:20160903,国药准字:Z43020572)、枸杞子(恒修堂药业有限公司,批号:2110027,执行标准:《中华人民共和国药典》2020年版一部)、人参(湖南三湘中药饮片有限公司,批号:2020071606,执行标准:《中华人民共和国药典》2015年版一部)组成;左卡尼汀口服溶液(东北制药集团股份有限公司,批号:191041,国药准字:H19990372)。
1.3 试剂
腺嘌呤(批号:C10233004)、阿拉伯胶(批号:A889414)均购自上海麦克林公司;乌拉坦(上海源叶生物公司,批号:Z17J10Y93206);大鼠睾酮(testosterone,T)ELISA试剂盒(批号:NM0480TH0135)、雌二醇(estradiol, E2) ELISA试剂盒(批号:NM05BP6R1717)、促卵泡激素(follicle-stimulating hormone,FSH)ELISA试剂盒(批号:NM0784604866)、促黄体生成激素(lutei?nizing hormone,LH)ELISA试剂盒(批号:NM06TFBN3282)、催乳素(prolactin,PRL)ELISA试剂盒(批号:E-EL-R3006)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)比色法测试盒(批号:NM01T?LZP7845)、ROS荧光法测试盒(批号:KL054B-046842)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)比色法测试盒(批号:E-BC-K096-M)、山羊抗兔IgG(H+L)(批号:AK02R0448813)均购自武汉伊莱瑞特公司;HIF-1α抗体(北京博奥森生物技术有限公司,批号:080221),稀释倍数均为1∶100;ERK1/2抗体(武汉三鹰生物技术有限公司,批号:51068-1-AP),稀释倍数均为1∶20 000;MAPK1(美国Abcam公司,批号:ab32081),稀释倍数均为1∶2 000。
1.4 仪器
自动精子分析仪(南宁松景天伦生物科技有限公司,型号:迈朗ML-800III.型);多功能酶标仪(美国 Bio-Tek,型号:Synergy HTX);透射电子显微镜(日本日立公司,型号:HT7800);电热恒温培养箱(上海新苗医疗器械制造有限公司,型号:DNP-9166B6S);高速冷冻离心机(贝克曼库尔特美国股份有限公司,型号:Microfuge 20R);电热恒温水浴锅(常州市国旺仪器制造有限公司,型号:DK-8D);石蜡切片机(德国徕卡仪器有限公司,型号:02387)。
2 方法
2.1 龟鹿二仙胶的制备
参考《医便》《医方考》《张氏医通》,以龟甲胶∶鹿角胶∶枸杞子∶人参=4∶8∶3∶2的比例制备水煎剂。首先取相应比例的鹿角胶和龟板胶进行烊化,同时取相应比例的枸杞子和人参以蒸馏水煎煮,然后将两者混合后煎煮成相应浓度药液,0~4 ℃冰箱保存备用。
2.2 动物模型制备和分组
将大鼠随机分为正常组(8只)和造模组(40只)。参考YU等[16]的方法,结合预实验结果,先将助溶剂阿拉伯胶干粉与腺嘌呤干粉按1∶10比例充分搅拌后用纯水配制成混悬液。模型组大鼠每天灌胃给予300 mg/kg腺嘌呤,正常组大鼠给予纯水,连续4周,评估大鼠OAS模型是否成功建立。
模型建立成功后,将造模组大鼠随机分为5组:模型对照组,龟鹿二仙胶低剂量(0.65 g/kg)、中剂量(1.25 g/kg)组、高剂量(2.5 g/kg)组和左卡尼汀组。按照动物体表面积换算法,大鼠左卡尼汀临床给药剂量为0.323 g·kg-1,龟鹿二仙胶低、中、高剂量分别为0.65、1.25、2.5 g·kg-1(相当于临床成人等效剂量的0.5、1、2倍),正常组和模型对照组给予等量纯水,连续灌胃4周后处理动物,收集样本备用。
2.3 大鼠一般情况观察
观察大鼠的一般情况,包括毛发、活动度以及精神状态等方面。并在造模前和取材前,对大鼠体质量进行记录。
2.4 大鼠肾指数计算及精子质量检测
末次灌胃24 h后,以20%乌拉坦6 mL·kg-1腹腔注射麻醉,行腹主动脉采血,采血完毕后分别从大鼠腹腔和阴囊下方用镊子快速夹住结缔组织,分离肾组织、睾丸与附睾及其周围的脂肪、血管、韧带等其他组织,将肾组织并称重,计算肾指数,肾指数=大鼠处死时双侧肾质量(mg)/大鼠处死前体质量(g)。将右侧附睾取出用PBS冲洗后置于1 mL预热的精子获能液中,眼科剪充分剪碎后用移液枪轻轻吹打,置于37 ℃培养箱中孵育5 min,使精子游离出来,精子悬液按1∶24的比例稀释,取10 μL精子悬液于精子计数板中,用自动精子分析仪检测精子密度和活动率。
2.5 大鼠血清性激素水平检测
大鼠麻醉后,于腹主动脉采血约8 mL置于采血管中,将其编号,静置2 h后于3000 r·min-1(1006.2×g)条件下离心15 min,抽取上清液(即血清),按照ELISA试剂盒说明书检测血清性激素(T、E2、FSH、LH、PRL)水平。
2.6 睾丸组织氧化应激水平测定
以“2.4”同样方法取出右侧睾丸组织。(1)根据ROS测定试剂盒说明书选取新鲜大鼠睾丸组织制备单细胞悬液,用300目尼龙网过滤除去组织团块,收集滤过细胞,滴加稀释好的DCFH-DA工作液(1∶1000),37 ℃避光孵育1 h,1 000×g离心10 min除去未进入细胞内的DCFH-DA,洗涤3次后于荧光酶标仪下检测(Ex/Em=500 nm/525 nm);(2)根据SOD测定试剂盒说明书选取新鲜大鼠睾丸组织制备10%匀浆上清液,生理盐水稀释100倍后取20 μL按试剂盒说明书操作表操作,37 ℃孵育20 min,于酶标仪下检测(450 nm处读数);(3)根据GSH-Px测定试剂盒说明书选取新鲜大鼠睾丸组织,制备10%匀浆上清液,生理盐水稀释60倍后按试剂盒说明书进行酶促反应和显色反应操作,充分混匀后静置5 min,于酶标仪下检测(412 nm处读数)。
2.7 睾丸组织HE染色
以“2.4”项同样方法取出右侧睾丸,用PBS冲洗后放入多聚甲醛固定,切片备用。60 ℃烤片1~2 h,切片脱蜡至水:先将切片置于二甲苯中10 min,2次,然后依次在100%、95%、85%和75%乙醇中每级放置5 min,再用蒸馏水浸洗5 min;苏木素染5~10 min,蒸馏水冲洗,PBS返蓝;伊红染3~5 min,蒸馏水冲洗;梯度乙醇(95%~100%)脱水,每级5 min(或者直接把片子烤干)。取出后置于二甲苯10 min,2次,中性树胶封片、显微镜观察。
2.8 睾丸组织免疫组化
用4%多聚甲醛固定大鼠睾丸组织,乙醇梯度脱水,二甲苯透明,浸渍蜡,石蜡切片,脱蜡,抗原提取,一级抗体孵育,PBS洗涤3次,滴加二级抗体,30 min后洗涤,滴加链霉素-亲和素-生物素复合物,30 min之后洗涤,加入DAB溶液进行显色,30 min后洗涤,苏木精复染,然后脱水,透明,密封,在显微镜下观察睾丸组织染色,染色呈棕黄色,为阳性,使用Image Pro Plus 6.0分析图像信号并计算每个视野的平均光密度值(IOD/面积)。
2.9 统计学分析
采用SPSS 21.0统计软件进行处理,数据以“x±s”表示,组间比较采用独立样本t检验。多组比较,方差齐采用单因素方差分析,组间多重比较采用LSD法;方差异质采用Mann-Whitney U检验比较两组间的差异。定量数据采用秩和检验进行分析,多样本比较采用完全随机设计。以P<0.05为差异具有统计学意义。
3 结果
3.1 龟鹿二仙胶对少弱精子症大鼠一般情况及肾指数的影响
与正常组比较,模型对照组大鼠逐渐出现毛发暗淡无光泽、伴脱落,并且精神萎靡不振,蜷缩于角落等情况,同时伴随体质量显著下降(P<0.01),肾指数显著上升(P<0.01)。与模型对照组比较,龟鹿二仙胶低、中、高剂量组和左卡尼汀组大鼠毛发枯萎黯淡程度稍减轻,活动度和精神状态改善,体质量均显著上升(P<0.01),且肾指数均显著下降(P<0.01),其中与龜鹿二仙胶低剂量组相比,龟鹿二仙胶中、高剂量组大鼠体质量显著升高(P<0.05)。详见图1A—1B。
3.2 龟鹿二仙胶对少弱精子症大鼠精子质量的影响
与正常组比较,模型对照组大鼠精子密度和精子活力均明显下降(P<0.01)。与模型对照组比较,龟鹿二仙胶低、中、高剂量组和左卡尼汀组大鼠精子密度和精子活力均显著升高(P<0.01)。龟鹿二仙胶组间比较发现,高剂量组较低剂量组大鼠精子密度和精子活力显著升高(P<0.05)。详见图1C—1D。
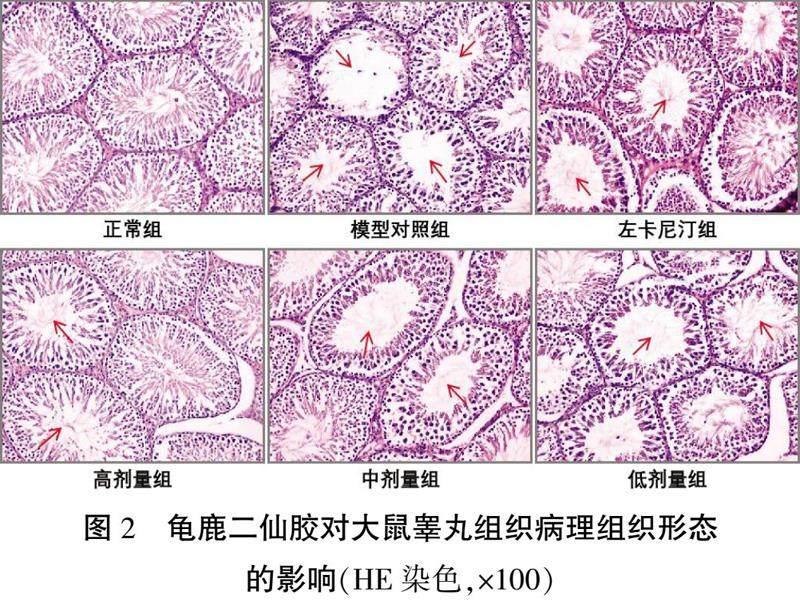
3.3 龟鹿二仙胶对少弱精子症大鼠睾丸组织病理组织形态的影响
HE染色显示,模型对照组大鼠睾丸曲细精管轮廓塌陷、萎缩、变形、不呈椭圆形,生精小管上皮明显变薄,各级生精细胞排列紊乱稀疏,数量明显减少,管腔内精子明显减少。龟鹿二仙胶治疗可以显著改善睾丸组织的这些病理损伤,其中高剂量组大鼠的病理损伤改善效果更好。详见图2。
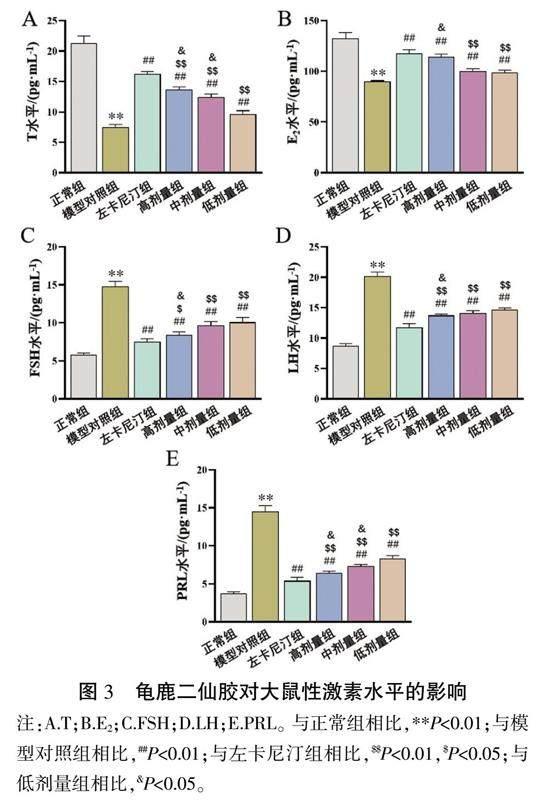
3.4 龟鹿二仙胶对少弱精子症大鼠性激素水平的影响
与正常组相比,模型对照组大鼠T和E2水平显著降低(P<0.01),FSH、LH和PRL水平显著升高(P<0.01);与模型对照组相比,龟鹿二仙胶治疗组和左卡尼汀组大鼠T和E2水平显著升高(P<0.01),FSH、LH和PRL水平显著下降(P<0.01)。与左卡尼汀组相比,龟鹿二仙胶中、低剂量组大鼠T和E2水平显著下降(P<0.01),龟鹿二仙胶高剂量组大鼠T水平显著下降(P<0.05),龟鹿二仙胶高、中、低剂量组大鼠FSH、LH和PRL水平显著上升(P<0.05)。详见图3。
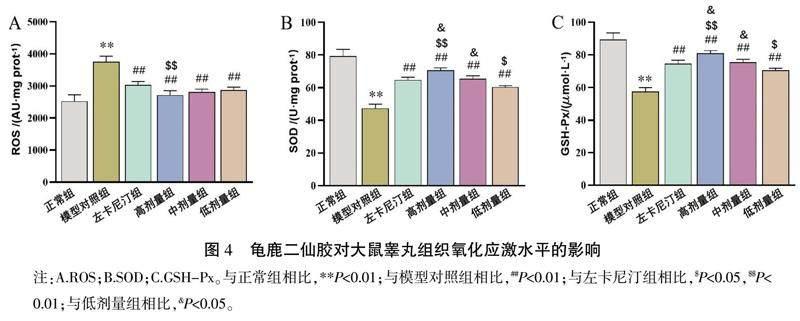
3.5 龟鹿二仙胶对少弱精子症大鼠睾丸组织氧化应激水平的影响
与正常组相比,模型对照组ROS水平显著升高(P<0.05),SOD和GSH-Px活性显著降低(P<0.01);与模型对照组相比,龟鹿二仙胶低、中、高剂量组ROS水平显著降低(P<0.01),龟鹿二仙胶中、高剂量组和左卡尼汀组SOD和GSH-Px活性显著升高(P<0.01),龟鹿二仙胶低剂量组差异无明显统计学意义;与左卡尼汀组相比,龟鹿二仙胶高剂量组大鼠ROS水平显著降低(P<0.01),SOD、GSH-Px水平显著升高(P<0.01),龟鹿二仙胶低剂量组大鼠SOD和GSH-Px水平显著降低(P<0.05)。详见图4。
3.6 龟鹿二仙胶对少弱精子症大鼠睾丸组织HIF-1α、EGFR和MAPK1蛋白表达的影响
免疫组化结果显示,与正常组大鼠睾丸组织相比,模型对照组大鼠睾丸组织中HIF-1α、EGFR、MAPK1表达水平升高(P<0.05);与模型对照组相比,龟鹿二仙胶中、高剂量组和左卡尼汀组大鼠睾丸组织HIF-1α、EGFR、MAPK1水平显著降低(P<0.05),龟鹿二仙胶低剂量组差异无明显统计学意义。详见图5。
4 讨论
OAS病因复杂,目前病因及发病机制尚不明确,但据相关资料显示,近年来其发病率逐年升高且可能呈持续增加的趋势,给患者的身心造成了极大的伤害和负担,同时严重影响了患者的生活质量[17]。中医学认为OAS与古籍中“精少”“精冷”“精清”类似,其主要病机多为肾中精气受损,致肾阴、肾阳平衡失调,从而形成阴阳俱损的表现[18]。中药在治疗男性不育症方面具有令人满意的效果,且中药具有便于服用、患者依从性好、不良反应少、价格成本相对低、不易产生耐药性等特点,同时中药具有多成分、多靶点、多途径、协同作用的优势。龟鹿二仙胶作为阴阳并补之剂,补阴而无凝滞之弊、补阳而无燥热之害,具有温肾壮阳、益精填髓功效[19]。龟甲胶和鹿角胶均归肝、肾二经,《古今名医方论·龟鹿二仙膏》云“龟得天地之阴气最厚,善通任脉,鹿得天地之阳气最全,善通督脉”,两药并作竹破竹补之用,能滋阴血、补肾阳,人参大补元气而生津,枸杞子益精生血,四药合用,可生精、益气、养血[20]。现代药理学研究证实,龟鹿二仙胶具有抗氧化应激、抗炎症反应、促进血小板生成、促进骨恢复等作用[21]。本研究表明,中、高剂量龟鹿二仙胶能显著改善腺嘌呤诱导的OAS大鼠的精子质量和精子活力,同时可以调节其性激素水平和氧化应激水平恢复正常,并能修复少弱精子大鼠的睾丸损伤。
结合前期网络药理学研究结果[22],本课题组认为龟鹿二仙胶可能是通过HIF-1α、EGFR、MAPK1等多成分、多靶点、多信号通路的相互作用调节OAS大鼠睾丸组织性激素和氧化应激水平达到保护作用。低水平的ROS在维持男性生殖功能中承担重要角色,但过量的ROS会导致氧化应激状态,破坏精子细胞蛋白质、脂质和DNA,从而导致生殖功能受损,引起精子降低和丧失[23-24]。SOD是睾丸组织内一种重要的抗氧化酶,GSH-Px是机体内清除氧自由基的一种重要过氧化物分解酶,睾丸组织中SOD活性及GSH-Px水平可以反映其氧化应激损伤水平[25]。许多研究表明,HIF-1α能够阻止低氧条件下过多ROS的产生以对抗氧化应激[26]。HIF-1α是一种氧调节的转录激活剂,属于缺氧诱导因子的一个亚基,在细胞对缺氧的反应中起着关键作用。临床研究表明,缺氧会对精子质量和睾丸激素水平造成不良影响,而由缺氧引起的精母细胞凋亡是导致精子生成障碍的关键因素[27]。EGFR是一种具有酪氨酸激酶活性的膜表面糖蛋白受体。有研究表明,基于分子对接,某些中药活性成分可以通过与EFGR结合,调控MAPK信号通路的表达,从而减轻相关炎症反应[28]。MAPK信号通路是真核生物信号传递网络中的重要途径之一,是细胞增殖、分化、细胞凋亡以及正常条件和病理条件下应激反应的关键信号通路。有研究表明,山柰酚可以通过下调MAPK信号通路来降低氧化应激和炎症反应[29]。我们在实验研究中发现,经腺嘌呤造成OAS模型后,大鼠睾丸组织中ROS水平升高,SOD和GSH-Px水平降低,过量的ROS造成了大鼠睾丸组织的氧化应激损伤状态。模型对照组大鼠的精子数量和精子活力水平显著降低,且睾丸组织受损,说明氧化应激状态可能导致精子相关活性物质的破坏和生殖系统的损害。随后,我们对前期预测作用靶点及相关信号通路进行验证,发现模型对照组大鼠睾丸组织中HIF-1α、EGFR、MAPK1蛋白表达均显著升高。而当给予不同剂量的龟鹿二仙胶进行干预后,OAS大鼠的上述情况得到不同程度的逆转。中、高剂量龟鹿二仙胶的干预明显改善了OAS大鼠精子质量和睾丸组织的损伤,同时降低了HIF-1α、EGFR、MAPK1蛋白表达水平,说明龟鹿二仙胶能够促进机体抗氧化,降低腺嘌呤在少弱精子大鼠的睾丸中诱导的氧化应激,从而提高精子活力,改善精子质量,且其可能是通过调节HIF-1α和MAPK等多条信号通路发挥作用。低剂量龟鹿二仙胶的干预对OAS大鼠没有显著的治疗作用,这可能是因为低剂量龟鹿二仙胶仅为临床等效剂量的0.5倍,导致其药效作用不足。因此,龜鹿二仙胶可能是通过HIF-1α/EGFR/MAPK1信号通路调节氧化应激来改善OAS,从而发挥治疗效果。
本研究通过动物实验研究,初步探讨了龟鹿二仙胶治疗OAS的潜在分子作用机制。本研究旨在为龟鹿二仙胶临床治疗应用于治疗OAS提供实验依据。本课题组后续将进行更深入对其他主要调控靶点展开研究,以期探索其更为明确的分子机制。
参考文献
[1] 薛 珑, 甄号召, 王 健. 经济发展水平、生育政策与生育率[J]. 统计与决策, 2023, 39(15): 79-84.
[2] EISENBERG M L, ESTEVES S C, LAMB D J, et al. Male infertility[J]. Nature Reviews Disease Primers, 2023, 9(1): 49.
[3] WAGNER A O, TURK A, KUNEJ T. Towards a multi-omics of male infertility[J]. The World Journal of Men's Health, 2023, 41(2): 272-288.
[4] PU R Y, LIU J, ZHANG A P, et al. Modeling methods for busulfan-induced oligospermia and asthenozoospermia in mice: A systematic review and meta-analysis[J]. Journal of Assisted Reproduction and Genetics, 2023, 40(1): 19-32.
[5] AGARWAL A, BASKARAN S, PAREKH N, et al. Male infertility[J]. Lancet, 2021, 397(10271): 319-333.
[6] METHORST C, FAIX A, HUYGHE E. Medical treatments for male infertility[J]. Progres En Urologie: Journal De L'Association Francaise D'urologie et De La Societe Francaise D'urologie, 2023, 33(13): 653-680.
[7] BARATI E, NIKZAD H, KARIMIAN M. Oxidative stress and male infertility: Current knowledge of pathophysiology and role of antioxidant therapy in disease management[J]. Cellular and Molecular Life Sciences, 2020, 77(1): 93-113.
[8] EVANS E P P, SCHOLTEN J T M, MZYK A, et al. Male subfertility and oxidative stress[J]. Redox Biology, 2021, 46: 102071.
[9] HUSSAIN T, KANDEEL M, METWALLY E, et al. Unraveling the harmful effect of oxidative stress on male fertility: A mechanistic insight[J]. Frontiers in Endocrinology, 2023, 14: 1070692.
[10] 李 玲, 黃家望, 冯芷莹, 等. 基于铁死亡途径探讨龟鹿二仙胶治疗少弱精子症的作用及机制[J]. 中草药, 2023, 54(20): 6722-6733.
[11] ZHAO H Y, ZHAO T T, YANG J H, et al. Epimedium protects against dyszoospermia in mice with Pex3 knockout by exerting antioxidant effects and regulating the expression level of P16[J]. Cell Death & Disease, 2022, 13(1): 69.
[12] 陆包伟, 刘露梅, 王 能, 等. 龟鹿二仙胶对糖尿病大鼠生殖损伤的保护作用及机制[J]. 中国实验方剂学杂志, 2022, 28(19): 1-8.
[13] 胡海林, 刘子毓, 何清湖, 等. 龟鹿二仙膏对阳虚型少弱精子症大鼠的改善作用及CFTR蛋白表达的影响[J]. 中医药信息, 2021, 38(6): 15-20.
[14] 刘子毓, 何清湖, 孙贵香, 等. 两种剂型龟鹿二仙胶对于腺嘌呤诱导肾阳虚型少弱精子症大鼠的干预作用[J]. 世界科学技术: 中医药现代化, 2021, 23(5): 1384-1389.
[15] 沈 童, 刘芬芬, 周亚博, 等. 龟鹿二仙胶源流考辨与研究进展[J]. 世界中医药, 2022, 17(17): 2517-2523.
[16] YU Z Z, CHEN J, SHOU P Q, et al. Effects of micronutrients on the reproduction of infertility rat model induced by adenine[J]. International Journal of Clinical and Experimental Medicine, 2014, 7(9): 2754-2762.
[17] 管鹏飞, 徐新宇, 应志康, 等. 中医药治疗弱精子症研究现状概述[J]. 山东中医药大学学报, 2022, 46(4): 544-548.
[18] 黄念文, 李海松, 毕焕洲, 等. 基于肠道菌群探讨补肾益精法治疗少弱精子症的作用机制[J]. 中国实验方剂学杂志, 2024, 30(5): 170-175.
[19] 陆包伟, 盛 文, 丁 劲, 等. 龟鹿二仙胶对阳虚型肾病大鼠肾脏的保护作用[J]. 时珍国医国药, 2023, 34(2): 257-260.
[20] DING J, SHENG W, BO W, et al. Guilu Erxian glue mitigates oxidative damage in mouse GC-1spermatogonial cells by inhibiting autophagy via the Keap1/Nrf2 pathway[J]. Journal of Traditional Chinese Medical Sciences, 2023, 10(4): 484-492, 527.
[21] 高 毅, 樊劲冲, 陈俭波. 龟鹿二仙胶的临床研究进展[J]. 中国中医药现代远程教育, 2023, 21(10): 199-202.
[22] 丁 劲, 何清湖, 周兴, 等. 基于网络药理学和分子对接探讨龟鹿二仙胶治疗少、弱精子症作用机制[J]. 世界科学技术: 中医药现代化, 2021, 23(12): 4490-4504.
[23] TAKESHIMA T, USUI K, MORI K, et al. Oxidative stress and male infertility[J]. Reproductive Medicine and Biology, 2021, 20(1): 41-52.
[24] AYAD B, OMOLAOYE T S, LOUW N, et al. Oxidative stress and male infertility: Evidence from a research perspective[J]. Frontiers in Reproductive Health, 2022, 4: 822257.
[25] HASSANI-BAFRANI H, NAJARAN H, RAZI M, et al. Berberine ameliorates experimental varicocele-induced damages at testis and sperm levels; evidences for oxidative stress and inflammation[J]. Andrologia, 2019, 51(2): e13179.
[26] HUANG X Y, ZHANG Y L, QI B Y, et al. HIF-1α: Its notable role in the maintenance of oxygen, bone and iron homeostasis (Review)[J]. International Journal of Molecular Medicine, 2022, 50(6): 141.
[27] WANG Z X, ZHU C C, SONG Y Y, et al. SIRT3 inhibition suppresses hypoxia-inducible factor 1α signaling and alleviates hypoxia-induced apoptosis of type B spermatogonia GC-2 cells[J]. FEBS Open Bio, 2023, 13(1): 154-163.
[28] DONG Y, ZHENG Y F, ZHU L H, et al. Hua-tan-Sheng-jing decoction treats obesity with oligoasthenozoospermia by up-regulating the PI3K-AKT and down-regulating the JNK MAPK signaling pathways: At the crossroad of obesity and oligoasthenozoospermia[J]. Frontiers in Pharmacology, 2022, 13: 896434.
[29] LIU Z Y, YAO X Q, SUN B H, et al. Pretreatment with kaempferol attenuates microglia-mediate neuroinflammation by inhibiting MAPKs-NF-κB signaling pathway and pyroptosis after secondary spinal cord injury[J]. Free Radical Biology & Medicine, 2021, 168: 142-154.
〔基金項目〕国家自然科学基金项目(81973863);湖南省大学生创新创业训练计划项目(2022-2864) 。
〔通信作者〕*何清湖,男,教授,博士研究生导师,E-mail:Hqh19651111@163.com;李 玲,女,教授,硕士研究生导师,E-mail:liling1049@hnucm.edu.cn。

