血必净注射液对LPS诱导的急性肺损伤大鼠炎症反应及细胞凋亡的影响
赖桂花 谭金曲 李萌萌 付成效 曾亚华 王婷 王娟 廖念 周君 屈萌艰


本文引用: 賴桂花, 谭金曲, 李萌萌, 付成效, 曾亚华, 王 婷, 王 娟, 廖 念, 周 君, 屈萌艰. 血必净注射液对LPS诱导的急性肺损伤大鼠炎症反应及细胞凋亡的影响[J]. 湖南中医药大学学报, 2024, 44(4): 538-544.
〔摘要〕 目的 观察血必净注射液对脂多糖(lipopolysaccharide, LPS)诱导的急性肺损伤大鼠炎症反应及细胞凋亡的影响。方法 将30只雄性SD大鼠随机分为正常组(10只)和造模组(20只),造模组造模后(尾静脉注射LPS)随机分为模型组(10只)和血必净注射液组(10只)。采用肺组织湿重/干重评估肺组织水肿程度,ELISA检测血清炎症因子IL-6、IL-1β、IL-4和IL-18的水平,HE染色观察大鼠肺组织病理损伤情况,TUNEL染色观察肺组织细胞凋亡情况,RT-PCR和Western blot检测凋亡因子胱天蛋白酶-3(Caspase-3)和胱天蛋白酶-8(Caspase-8)的mRNA含量和蛋白水平。结果 与正常组比,模型组大鼠肺组织湿重/干重升高(P<0.01),IL-6、IL-1β、IL-4和IL-18升高(P<0.001),肺组织出现损伤和炎症浸润,细胞凋亡率升高(P<0.001),Caspase-3和Caspase-8的mRNA、蛋白表达升高(P<0.01或P<0.001)。与模型组比,血必净注射液组大鼠肺组织湿重/干重下降(P<0.05),IL-6、IL-1β、IL-4和IL-18降低(P<0.05或P<0.01),肺组织损伤和炎症浸润情况明显改善,细胞凋亡率下降(P<0.001),Caspase-3和Caspase-8的mRNA和蛋白表达降低(P<0.01或P<0.001)。结论 血必净注射液可改善急性肺损伤大鼠的肺组织损伤和炎症反应,其机制可能与抑制细胞凋亡有关。
〔关键词〕 急性肺损伤;血必净注射液;炎症反应;细胞凋亡;胱天蛋白酶-3;胱天蛋白酶-8
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.04.002
Effects of Xuebijing Injection on inflammatory response and cell apoptosis in rats with LPS-induced acute lung injury
LAI Guihua1,2,3, TAN Jinqu1,2,3, LI Mengmeng1,2,3, FU Chengxiao4, ZENG Yahua1,2,3, WANG Ting1,2,3,
WANG Juan1,2,3, LIAO Nian4, ZHOU Jun1,2,3, QU Mengjian1,2,3*
1. Rehabilitation Medicine Center, the First Hospital of University of South China, Hengyang, Hunan 421001, China;
2. Department of Rehabilitation, the First Hospital of University of South China, Hengyang, Hunan 421001, China;
3. Acupuncture & Rehabilitation Laboratory, the First Hospital of University of South China, Hengyang, Hunan 421001, China; 4. Department of Pharmacy, the First Hospital of University of South China, Hengyang, Hunan 421001, China
〔Abstract〕 Objective To observe the effects of Xuebijing Injection (XBJI) on inflammatory response and cell apoptosis in rats with lipopolysaccharide (LPS)-induced acute lung injury (ALI). Methods A total of 30 male SD rats were randomized into normal group (n=10) and modeling group (n=20) which was subdivided randomly into model group (n=10) and XBJI group (n=10) after modeling (injection of LPS into the tail vein). The degree of pulmonary edema was evaluated using the wet/dry weight ratio (W/D) of the lung tissue, the serum levels of inflammatory factors IL-6, IL-1β, IL-4, and IL-18 were determined by ELISA, the pathological damage of rat lung tissue was observed by HE staining, the condition of cell apoptosis was observed by TUNEL staining, and the mRNA content and protein levels of apoptotic factors Caspase-3 and Caspase-8 were measured by RT-PCR and Western blot. Results Compared with the normal group, the model group showed an increase in the rat lung tissue W/D (P<0.01), levels of IL-6, IL-1β, IL-4, and IL-18 (P<0.001), cell apoptosis rate (P<0.001), as well as the mRNA and protein expressions of Caspase-3 and Caspase-8 (P<0.01 or P<0.001); besides, the lung tissue was damaged with inflammatory cell infiltration. Compared with the model group, the XBJI group exhibited a decrease in the lung tissue W/D (P<0.05), levels of IL-6, IL-1β, IL-4, and IL-18 (P<0.05 or P<0.01), cell apoptosis rate (P<0.001), as well as the mRNA and protein expressions of Caspase-3 and Caspase-8 (P<0.01 or P<0.001); additionally, the damage to the lung tissue and inflammatory cell infiltration were significantly alleviated. Conclusion XBJI can relieve the lung tissue injury and inflammatory response in ALI rats, the mechanism of which may be related to inhibiting cell apoptosis.
〔Keywords〕 acute lung injury; Xuebijing Injection; inflammatory response; cell apoptosis; Caspase-3; Caspase-8
急性肺损伤(acute lung injury, ALI)是临床常见的急性弥漫性肺部疾病,主要表现为严重低氧血症和肺水肿等,可进一步发展为急性呼吸窘迫综合征和急性呼吸衰竭,病死率高达50%[1]。ALI的病因和发病机制复杂,严重感染、创伤、休克等是导致ALI发生的重要原因,其核心病机是肺内炎症细胞过度激活,并释放大量炎症因子,导致炎症级联反应[2-3]。研究表明,细胞凋亡在ALI的发病过程中发挥重要作用,包括肺泡上皮细胞和内皮细胞凋亡引起的肺泡毛细血管屏障损伤,以及中性粒细胞凋亡对肺部炎症微环境的改变等,这些凋亡过程大多与胱天蛋白酶-3(Caspase-3)和胱天蛋白酶-8(Caspase-8)等凋亡因子密切相关,抑制细胞凋亡可能是改善ALI炎症反应的有效途径[4]。
目前,ALI临床常用的治疗方法包括机械通气、糖皮质激素药物、血管扩张剂药物、体外膜肺氧合和其他支持治疗等,但这些治疗并不能降低ALI的病死率,且存在一些不良反应、治疗费用高[5]。因此,寻找高效、安全、经济的治疗方法仍是ALI的研究重点。近年来,中医药治疗ALI的研究逐渐增多,其整体论治、标本兼顾的独特优势,在防治ALI方面发挥了重要的作用。中医学认为,ALI的病因病机以热毒、瘀血为主,治疗上应以清热解毒、活血化瘀为主。血必净注射液是中国急救医学奠基者王今达教授以血府逐瘀汤为基础方,结合自身临床经验研制而成,在临床上用于脓毒症及ALI等严重炎症性疾病,疗效确切且安全性好[6]。目前,关于血必净注射液抑制ALI炎症反应的具体机制尚未完全明确。因此,本研究通过建立脂多糖(lipopolysaccharide, LPS)所致的ALI大鼠模型,进一步评价血必净注射液对ALI的治疗作用,并从细胞凋亡的角度来阐述血必净注射液治疗ALI的可能作用机制,为其进一步的临床应用提供客观依据。
1 材料与方法
1.1 动物
8周龄清洁级SD雄性大鼠30只,购自长沙市天勤生物技术公司,生产许可证号:SCXK(湘)2022-0011。于南华大学实验动物中心饲养,室温21~25 ℃,相对湿度45%~65%,昼夜规律12 h/12 h,3只/笼,活动不受限,饲料及饮水充足,本实验严格遵循《实验动物管理条例》和南华大学附属第一医院医学伦理委员会的相关规定(伦理批准号:202307210047)。
1.2 主要实验仪器和试剂
台式冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R);荧光定量RCP仪、PCR板(美国Thermo公司,型号:PIKOREAL96、SPL0960);电泳仪、电泳槽、转膜仪(北京六一生物科技有限公司,型号:DYY-2C、DYCZ-24DN、DYCZ-40D);生物样品均质仪(杭州奥盛仪器有限公司,型号:BioPrep-24);旋涡混合器(海门市其林贝尔仪器制造有限公司,型号:GL-88B);磁力搅拌器(上海仪电科学仪器股份有限公司,型号:JB-13);荧光显微镜(德国Motic公司,型号:BA410T)。LPS(北京索莱宝科技有限公司,批号:3230506003);血必净注射液(天津红日药业股份有限公司,10 mL×5支,批号:2302261);Caspase-3、Caspase-8、β-actin一抗(美国Proteintech公司,批号:66470-2-Ig、13423-1-AP、66009-1-Ig);二抗(长沙艾碧维生物科技有限公司,批号:AWS0001);mRNA逆转录试剂盒(康为世纪生物科技股份有限公司,批号:CW2569);TUNEL试剂盒[翌圣生物科技(上海)股份有限公司,批号:40306ES50],HE染色试剂盒(北京索莱宝科技有限公司,批号:G1120);IL-6、IL-1β、IL-4和IL-18 ELISA试剂盒(江苏晶美生物科技有限公司,批号:F4025、F4018、F4035、F4038)等。
1.3 方法
1.3.1 造模与分组 将30只大鼠随机分为正常组和造模组,造模后随机分为模型组和血必净注射液组,每组10只。造模方法[7]:大鼠用大鼠固定器固定实验大鼠,选取大鼠尾静脉1/3处,使用乙醇消毒,扩张局部血管,1 mL注射器抽取已配制的LPS溶液(根据人和动物的体表面积计算剂量)5 mg/kg,浓度5 mg/mL,斜45°进针后平行进针,回抽见静脉血后缓慢注入LPS溶液,正常组尾静脉注射等体积生理盐水。
1.3.2 藥物干预 造模1 h后,血必净注射液组尾静脉缓慢注射血必净8 mL/kg(根据人和动物的体表面积计算法)[8],1次/d,连续治疗3 d,正常组和模型组同时间点注射等体积生理盐水。
1.3.3 标本采集和保存 治疗结束后,采用1%戊巴比妥钠(40 mg/kg)腹腔注射,对各组大鼠进行麻醉,先取大鼠眼眶血4 mL,离心后置于-80 ℃冰箱内保存,然后开胸暴露肺部,取肺组织,取右上肺计算肺组织湿重(W)/干重(D)比值,左肺进行HE染色及肺组织病理评估,右下肺置于液氮罐中低温保存,用于RT-PCR和Western blot测定。
1.3.4 观察指标
(1)肺组织W/D测定
取待测肺组织,用滤纸吸干肺组织表面水分,然后用锡箔纸包裹,并精确称取,其质量标记为肺组织W;将肺组织置于60 ℃烤箱中烘烤72 h后,测定其质量标记为肺组织D,计算肺组织W/D,评估肺组织水肿程度。
(2)ELISA检测血清炎症因子的含量
取大鼠血液样本于无菌离心管中,室温静置1 h,将血液用离心机以4 ℃、4 000 r/min离心(离心半径10 cm)10 min,取上清进行实验检测。实验前20 min,从冰箱中取出ELISA试剂盒,平衡至室温,严格按照试剂盒说明书检测大鼠血清中炎症因子的含量。
(3)肺组织HE染色和病理评分
待测肺组织经固定、脱水、透明、包埋制成石蜡块,用切片机将石蜡块切成4 μm的薄片置于载玻片上,按照HE染色试剂盒说明书对肺组织切片进行染色,中性树胶封片后,于显微镜下观察肺组织损伤情况,借助NIS-Elements 4.6软件对肺组织损伤情况进行评分。评分方法:对肺损伤后出现的肺泡充血、肺水肿、炎症细胞浸润及肺泡壁增厚程度4个病理改变表征进行分级评分,其中无损伤记为0分、轻度损伤记为1分、中度损伤记为2分、重度损伤记为3分、极重度损伤记为4分,各表征的评分之和为肺损伤病理评分。
(4)肺组织细胞凋亡TUNEL染色
大鼠肺组织石蜡切片脱蜡至水,加入蒸馏水浸洗5 min,随后用Proteinase K工作液,37 ℃反应20 min;按照TUNEL试剂盒说明书操作染色,缓冲甘油封片后,置于荧光显微镜下采集图像,计算细胞凋亡率,其中阳性细胞呈绿色荧光,正常细胞呈蓝色荧光。每张切片随机选取5个视野,计算各组大鼠肺组织的细胞凋亡率。细胞凋亡率=凋亡细胞(绿色荧光)/总细胞×100%。
(5)RT-PCR技术检测Caspase-3和Caspase-8的mRNA含量
用Trizol试剂盒提取肺组织的总RNA,以组织总mRNA为模板,逆转录制备cDNA,在NCBI上搜索目的基因的序列,运用primer 5软件设计引物,由北京擎科生物科技股份有限公司合成引物,相应引物进行RT-PCR反应,以β-actin作为内参,根据2-△△Ct公式计算Caspase-3和Caspase-8的mRNA相对表达量,引物序列见表1。
(6)Western blot检测Caspase-3和Caspase-8的蛋白表达
取大鼠肺组织加入RIPA裂解液,提取蛋白,BCA法测定蛋白浓度,蛋白定量后上样电泳转膜,转膜后使用5%脱脂奶粉封闭处理1 h,分别加入Caspase-3和Caspase-8一抗(1∶2 000比例稀释),4 ℃孵育过夜,二抗(1∶5 000比例稀释)室温孵育1 h,PBS缓冲液洗涤3次,用ECL发光液避光显影,使用Image J图像分析软件计算条带的灰度值。
1.4 统计学方法
采用SPSS 28.0软件对数据进行统计学分析,用GraphPad Prism 8进行数据可视化,计量资料采用“x±s”表示,若多组均数比较符合正态分布,采用单因素方差分析,其中两两比较采用LSD法(方差齐)和Games-Howell法(方差不齐);若多组均数不符合正态分布,则采用多样本秩和检验(Kruskal-Wallis H检验)。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织W/D
与正常组比,模型组大鼠肺组织W/D增高(P<0.01),提示LPS造模后ALI大鼠有明显的肺水肿;血必净注射液干预后,ALI大鼠肺组织W/D明显降低(P<0.05),提示血必净注射液可明显缓解ALI大鼠的肺水肿程度。详见表2。
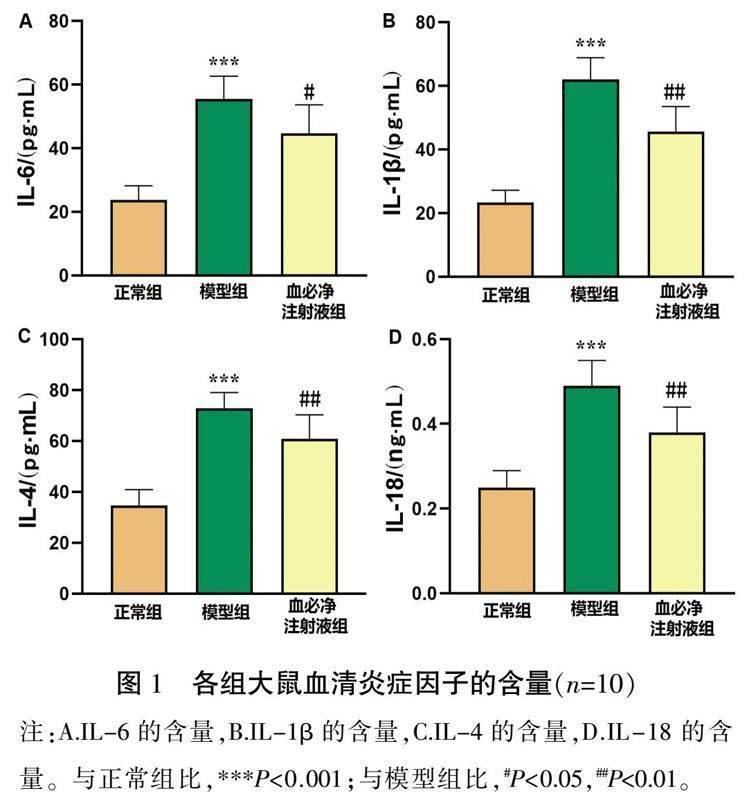
2.2 各组大鼠血清炎症因子的含量
与正常组比,模型组大鼠炎症因子IL-6、IL-1β、IL-4和IL-18的含量明显增多(P<0.001)。与模型组比,血必净注射液组大鼠中IL-6、IL-1β、IL-4和IL-18的含量减少,差异有统计学意义(P<0.05,P<0.01)。详见图1。
2.3 各组大鼠肺组织病理损伤情况及评分
HE染色显示:正常组肺组织中肺泡结构正常,肺泡腔室清晰可见,肺泡壁细长且结构清晰,未见到明显的充血/出血和炎症细胞聚集。与正常组比,模型组大鼠肺组织中,肺泡上皮细胞和肺毛细血管内皮细胞损伤,肺泡壁毛细血管扩张充血,肺泡腔炎症细胞浸润,部分肺泡结构消失、融合,肺泡壁和间隔明显增厚。与模型组比,血必净注射液组大鼠肺组织充血减少,大部分肺泡结构清晰可见,肺泡腔内炎症细胞数量减少,详见图2。病理损伤评分显示:与正常组比,模型组大鼠肺组织病理评分升高(P<0.001);与模型组比,血必净注射液组大鼠肺组织病理评分降低(P<0.01),详见表3。
2.4 各组大鼠肺组织细胞凋亡情况
正常组大鼠肺组织细胞凋亡率为8.96%±1.33%,模型组大鼠肺组织细胞凋亡率为58.51%±5.73%,模型組明显高于正常组(P<0.001)。血必净注射液组大鼠细胞凋亡率为19.52%±3.08%,明显低于模型组(P<0.001)。详见图3。
2.5 各组大鼠肺组织Caspase-3和Caspase-8的mRNA含量
与正常组比,模型组大鼠肺组织中Caspase-3和Caspase-8的mRNA含量增多(P<0.001);与模型组比,血必净注射液组大鼠肺组织Caspase-3和Caspase-8的mRNA含量降低(P<0.001)。详见表4。
2.6 各组大鼠肺组织Caspase-3和Caspase-8的蛋白表达水平
与正常组比,ALI大鼠肺组织中Caspase-3和Caspase-8的蛋白表达上升(P<0.01或P<0.001);与模型组比,血必净注射液组大鼠肺组织Caspase-3和Caspase-8的蛋白表达明显下降(P<0.01或P<0.001)。详见图4。
3 讨论
中医学并无“急性肺损伤”病名,临床上根据呼吸窘迫、呼吸衰竭等症状,将急性肺损伤归属于“喘证”“喘脱”“暴喘”等范畴。中医学认为,热、毒、痰、瘀为ALI的重要病机。《温热论》云:“温邪上受,首先犯肺。”[9]肺居高位,易受外邪侵袭,其中热邪犯肺为主导,热邪伤津耗气,炼液为痰,痰浊黏滞,积久成毒,影响气机运行,气机运行不畅,导致血行缓慢,血液运行障碍,易产生瘀血[10]。因此,热毒犯肺、痰瘀阻滞是ALI的主要病机,治疗上应以清热解毒、活血化瘀为关键。血必净注射液具有清热解毒、活血化瘀的功效,由红花、赤芍、川芎、丹参、当归组成。药理学研究表明,其活性成分红花黄色素、芍药苷、川芎嗪、丹参素、阿魏酸等在抑制肺部炎症反应、调节免疫、调控凋亡、保护血管内皮以及改善局部血液循环等方面均具有积极作用[11]。临床研究表明,血必净注射液干预ALI及脓毒症等严重肺部炎症疾病疗效确切且安全性好[12],已被纳入多项指南、共识及国家级诊疗方案中推荐应用。此外,一项联合血必净注射液治疗重症病毒性肺炎的回顧性研究显示,血必净注射液可有效改善重症病毒性肺炎的临床体征,抑制炎症反应,改善循环[13]。由此可见,血必净注射液治疗肺部感染疾病,尤其伴有严重的炎症反应,具有较好的临床疗效。
可靠的ALI动物模型是实验研究的重要载体。目前,ALI造模方法包括爆炸、海水等物理因素和LPS、石墨粉、百草枯、盐酸等非物理因素诱导[14]。其中,LPS诱导的ALI模型是国内外研究者目前常用的模型(76.63%),LPS是存在于革兰氏阴性菌外膜的糖脂,其病理机制是LPS可聚集和激活肺内的中性粒细胞,其释放的氧自由基、弹性蛋白酶等进一步诱导巨噬细胞等免疫细胞释放大量炎症介质,进而引起炎症级联反应,最终导致ALI的发生[15]。LPS诱导的ALI动物模型重复性好、易于操作,且造模时间短、成功率高,并有利于研究细菌感染引起的炎症反应,适用于ALI发病机制和药效机制的研究[16]。因此,本研究选用LPS诱导的ALI模型来评价血必净注射液的治疗作用。实验研究结果表明,经LPS造模后的SD大鼠肺部存在明显的组织病理损伤、水肿及炎症细胞浸润情况,提示ALI模型构建成功。而血必净注射液干预后,能够明显抑制ALI大鼠的炎症反应,改善ALI肺损伤,提示血必净注射液对于LPS引起的ALI大鼠具有较好的治疗作用。过度炎症反应在ALI中起着关键的作用,可直接或间接导致肺泡上皮和微血管内皮的损伤,是LPS所致ALI发生的根本原因。IL-6、IL-1β、IL-4和IL-18是机体重要的炎症介质,可诱导中性粒细胞在肺部聚集,从而加重炎症反应。实验研究表明,大鼠经LPS诱导后,能够引起IL-4和IL-18的异常升高[17-18];而临床相关研究表明,IL-6、IL-1β和IL-18可作为预测ALI病死率的重要生物标志物[19]。因此,选取以上4个炎症因子作为评价ALI炎症反应的重要指标。与文献研究一致,本实验结果显示:ALI大鼠血清中IL-6、IL-1β、IL-4和IL-18的含量显著升高,而经血必净注射液干预后,各炎症因子含量明显降低,表明血必净注射液可有效抑制LPS所引起的肺部急性炎症反应。
细胞凋亡又称程序性细胞死亡,研究表明,细胞凋亡与ALI的严重程度密切相关,肺泡上皮细胞、内皮细胞、中性粒细胞和肺泡巨噬细胞等的异常凋亡,均可能导致ALI中上皮屏障功能受损和某些间充质细胞重构[20]。此外,凋亡细胞在肺组织中过度积累后,可释放更多的炎症介质,进一步加重肺部炎症反应,并损伤肺组织,抑制细胞凋亡可有效抑制炎症反应,并促进损伤肺组织恢复,表明抑制凋亡可能是一种有效的ALI治疗策略。Caspase家族高特异性效应蛋白酶的激活是细胞凋亡的一个特征,其中,死亡执行蛋白酶Caspase-3是凋亡蛋白酶级联反应过程中的关键因子,同时也是凋亡过程的最终执行者[21]。Caspase-8作为细胞凋亡的分子开关,可能在ALI的发病机制中起关键作用[22]。研究表明,在LPS诱导的ALI动物和细胞模型中,细胞凋亡因子Caspase-3和Caspase-8调控的炎症反应明显增强[23]。本实验结果也显示,ALI大鼠肺组织细胞凋亡率明显升高,凋亡因子Caspase-3和Caspase-8升高,提示细胞凋亡在ALI的发病机制中具有重要的作用,经血必净注射液干预后,肺组织的细胞凋亡率及Caspase-3、Caspase-8的表达显著降低,表明血必净注射液能有效抑制LPS诱导的细胞凋亡,进而发挥治疗ALI的作用。
综上所述,血必净注射液对LPS诱导的ALI大鼠肺组织损伤和炎症反应,具有较好的改善作用,其作用机制可能与抑制肺组织细胞凋亡有关,但其确切的调控机制仍需进一步实验研究。以上实验结果为血必净注射液的进一步临床应用提供了实验依据,后期需要进一步对血必净注射液的其他调控机制进行深入探索。
参考文献
[1] HSIEH P C, WU Y K, YANG M C, et al. Deciphering the role of damage-associated molecular patterns and inflammatory responses in acute lung injury[J]. Life Sciences, 2022, 305: 120782.
[2] LONG M E, MALLAMPALLI R K, HOROWITZ J C. Pathogene?sis of pneumonia and acute lung injury[J]. Clinical Science, 2022, 136(10): 747-769.
[3] LI Y R, JIANG Y N, ZHANG H, et al. Research on acute lung injury inflammatory network[J]. International Journal of Clinical Pharmacology and Therapeutics, 2023, 61(9): 394-403.
[4] JU M J, LIU B F, HE H Y, et al. MicroRNA-27a alleviates LPS-induced acute lung injury in mice via inhibiting inflammation and apoptosis through modulating TLR4/MyD88/NF-κB pathway[J]. Cell Cycle, 2018, 17(16): 2001-2018.
[5] MOKR D. Acute lung injury-from pathophysiology to treatment[J]. Physiological Research, 2020, 69(Suppl 3): S353-S366.
[6] ZHANG M, ZHENG R, LIU W J, et al. Xuebijing injection, a Chinese patent medicine, against severe pneumonia: Current research progress and future perspectives[J]. Journal of Integrative Medicine, 2023, 21(5): 413-422.
[7] CHEN H, BAI C X, WANG X D. The value of the lipopolysaccharide-induced acute lung injury model in respiratory medicine[J]. Expert Review of Respiratory Medicine, 2010, 4(6): 773-783.
[8] LIU M W, SU M X, ZHANG W, et al. Protective effect of Xuebijing injection on paraquat-induced pulmonary injury via down-regulating the expression of p38 MAPK in rats[J]. BMC Complementary and Alternative Medicine, 2014, 14: 498.
[9] 叶天士. 温热论[M]. 北京: 人民卫生出版社, 2007: 15.
[10] 卢 悦, 张平平, 王东强, 等. 急性肺损伤中医病因病机的探讨[J]. 中国中医急症, 2020, 29(2): 280-282.
[11] 丁伟超, 陈 娟, 廖浩宇, 等. 基于网络药理学和体外实验研究血必净注射液治疗脓毒症相关ARDS的作用机制[J]. 中国中药杂志, 2023, 48(12): 3345-3359.
[12] LIU S Q, YAO C, XIE J F, et al. Effect of an herbal-based injection on 28-day mortality in patients with sepsis: The EXIT-SEP randomized clinical trial[J]. JAMA Internal Medicine, 2023, 183(7): 647-655.
[13] 李丹华, 韩甜甜, 张战锋. 联合血必净注射液治疗重症病毒性肺炎的回顾性研究[J]. 时珍国医国药, 2023, 34(5): 1161-1163.
[14] D'ALESSIO F R. Mouse models of acute lung injury and ARDS[J]. Methods in Molecular Biology, 2018, 1809: 341-350.
[15] 付静怡, 汪 雷, 杨 异. 急性肺损伤动物模型建立的研究进展[J]. 上海交通大学学报(医学版), 2021, 41(5): 690-694.
[16] 彭美红, 卢芳国. 基于数据挖掘的非物理因素致急性肺損伤动物模型分析[J]. 中国实验方剂学杂志, 2023, 29(23): 158-165.
[17] CHEN X L, LI J, XU G G, et al. Rapamycin enhances IFN-γ and IL-4 production in co-culture of gδ T and dendritic cells from mice with lipopolysaccharide-induced acute lung injury[J]. Genetics and Molecular Research: GMR, 2016, 15(2): 2016.
[18] KANDIKATTU H K, UPPARAHALLI VENKATESHAIAH S, KU?MAR S, et al. IL-18-mediated neutrophil recruitment promotes ac?
ute lung injury in inflammation-mediated chronic pancreatitis[J]. Molecular Immunology, 2023, 155: 100-109.
[19] BUTT Y, KURDOWSKA A, ALLEN T C. Acute lung injury: A clinical and molecular review[J]. Archives of Pathology & Laboratory Medicine, 2016, 140(4): 345-350.
[20] REN Y C, QIN S, LIU X X, et al. Hyperoxia can induce lung injury by upregulating AECII autophagy and apoptosis via the mTOR pathway[J]. Molecular Biotechnology, 2023.
[21] CHOUDHARY G S, AL-HARBI S, ALMASAN A. Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis[J]. Methods in Molecular Biology, 2015, 1219: 1-9.
[22] FRITSCH M, GüNTHER S D, SCHWARZER R, et al. Caspase-8 is the molecular switch for apoptosis, necroptosis and pyroptosis[J]. Nature, 2019, 575: 683-687.
[23] JIANG R D, XU J Q, ZHANG Y Z, et al. Ligustrazine alleviate acute lung injury through suppressing pyroptosis and apoptosis of alveolar macrophages[J]. Frontiers in Pharmacology, 2021, 12: 680512.
〔基金项目〕湖南省自然科学基金青年项目(2023JJ40595);湖南省卫生健康委员会项目(202103100165)。
〔通信作者〕*屈萌艰,女,博士,主管技师,E-mail:524995799@qq.com。

