冠心病抗炎治疗的临床研究进展
庄文文 杜明亮 惠慧 郑晓群
【摘要】炎症是导致冠心病发生和发展的重要因素,抗炎治疗成为进一步降低冠心病残余风险的希望,然而目前临床上并无规范的抗炎治疗策略。近年来多项大规模的随机、双盲对照试验为寻找冠心病的抗炎治疗策略指引了方向。现结合近年来循证证据就冠心病抗炎治疗的进展做一综述。
【关键词】冠心病;抗炎治疗;残余炎症风险
【DOI】10.16806/j.cnki.issn.1004-3934.2024.03.017
Clinical Research Progress in Anti-Inflammatory Therapy of Coronary Heart Disease
ZHUANG Wenwen,DU Mingliang,HUI Hui,ZHENG Xiaoqun
(Department of Coronary Heart Disease,Dalian Central Hospital,Dalian 116032,Liaoning,China)
【Abstract】Inflammation can lead to the development of coronary heart disease(CHD),and anti-inflammatory therapy has become the hope to further reduce the residual risk of CHD.However,there is no standard anti-inflammatory therapy strategy in clinical practice.In recent years,a number of large-scale randomized,double-blind,placebo-controlled clinical studies have guided the search for anti-inflammatory therapy for CHD.This article reviews the progress of anti-inflammatory therapy for CHD based on evidence-based research in recent years.
【Keywords】Coronary heart disease;Anti-inflammatory treatment;Residual inflammation risk
冠心病指冠状动脉粥样硬化引起管腔狭窄或闭塞,导致心肌缺血、缺氧或坏死,大量的循证证据已证实胆固醇浓度升高(主要由低密度脂蛋白颗粒转运)会促进动脉粥样硬化(atherosclerosis,AS)的发生和发展,降低胆固醇水平能延缓斑块进展,降低不良心血管事件的发生率,在冠心病的二级预防中起到基石作用[1]。过去30年通过强化降脂治疗,冠心病的死亡率已大幅降低[2],即便如此,仍存在不可忽视的残余风险。研究者此前更多的将目光聚焦于降脂治疗相关的“残余胆固醇风险”,而忽视了“残余炎症风险(residual inflammation risk,RIR)”在动脉粥样硬化性心血管疾病患者中的作用[3]。越来越多的研究[4]表明,炎症是AS的关键驱动因素,在其发生和发展中起重要作用。炎症导致血管内皮受损及修复功能障碍,低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)通过受损的内皮进入管壁内膜,氧化修饰成氧化低密度脂蛋白加重内皮损伤,巨噬细胞通过清道夫受体吞噬氧化低密度脂蛋白,转变为泡沫细胞,形成最早的粥样硬化病变脂质条纹,随着时间的推移,通过与该区域的炎症分子和平滑肌细胞的相互作用,脂肪条纹最终会发展,导致冠状动脉内斑块形成,这些相互作用引起下游炎症的级联反应,最终促进斑块的进展及破裂,引起急性冠脉综合征[5-6]。可以说,没有胆固醇就没有AS,没有血管壁的炎症,也就难以启动AS。AS“炎症假说”的理论为冠心病的治疗提供了新的方向,但将抗炎治疗由理论转化为临床应用任重而道远。
1 炎症与冠心病
1.1 高敏C反应蛋白
PROVE-IT研究[7]发现,在LDL-C<1.8 mmol/L的患者中,高敏C反应蛋白(high sensitivity C-reactive protein,hs-CRP)≥2 mg/L的患者不良心血管事件发生率更高,证实了“越低越好”不仅适用于LDL-C,同样适用于炎症因子。JUPITER研究[8]提出他汀类药物对冠心病患者的获益部分来源于其抗炎效应,研究纳入血脂“正常”,但存在RIR,即hs-CRP≥2 mg/L的人群,应用瑞舒伐他汀(20 mg/d)治疗,结果显示使用他汀类药物治疗显著降低了hs-CRP水平并减少了心血管事件的发生。近期Lancet上发表的针对3项临床随机研究的分析[9]表明,与LDL-C相比,hs-CRP能反映机体的炎症水平,可更好地预测未来的心血管事件和死亡风险。上述研究初步证实炎症与心血管疾病的相关性,筛选具有RIR的患者是冠心病抗炎治疗成功的关键。
1.2 NOD样受体热蛋白结构域相关蛋白3炎症小体通路
有研究[10]表明,AS斑块炎症的主要驱动因素是NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体复合物,在斑块结构中,中性粒细胞、单核细胞和巨噬细胞暴露于各种刺激因素(如胆固醇晶体),这些因素均会激活NLRP3炎症小体复合物,继而促进炎症细胞因子[如白细胞介素(interleukin,IL)-1β、IL-18]的分泌。NLRP3炎癥小体复合物由3个成分组成[11]:(1) NLRP3;(2)凋亡相关点状蛋白;(3)胱天蛋白酶-1。IL能启动和调节炎症反应,典型的IL是IL-1,其有两种亚型(即IL-1α和IL-1β),前者主要在细胞内和局部发挥作用,而后者则在局部和全身都发挥作用。NLRP3炎症小体通过激活胱天蛋白酶-1将IL-1β前体剪切为具有活性的IL-1β,这些细胞因子的释放会激活各种炎症细胞并产生IL-6,从而刺激肝脏产生C反应蛋白(C-reactive protein,CRP),并放大血管壁内的炎症反应[11]。在血管壁内,IL-1β可诱导各种细胞因子、趋化因子和黏附分子的表达,以招募白细胞和促进白细胞黏附到血管内皮细胞,此外IL-1β可通过正反馈回路放大其表达,使炎症反应呈指数增加[12]。如上所述,IL-1β是驱动IL-6信号通路的炎症反应的核心上游细胞因子,IL-6是一种来源于T淋巴细胞、巨噬细胞和脂肪细胞的细胞因子,主要用于刺激CRP和纤维蛋白原的产生,从而促进内皮功能障碍,加速AS。此外,高水平的IL-6可能与健康男性心肌梗死风险的增加相关[13]。IL家族的另一成员IL-18在结构上类似于IL-1β,也被胱天蛋白酶-1激活,IL-18在AS斑块中表达,尤其是在不稳定或有症状的病变中的表达水平更高[14]。由此可见,NLRP3炎症小体及其下游细胞因子IL-1β、IL-18、IL-6与冠心病的炎症反应息息相关,因此NLRP3炎症小体通路是冠心病抗炎治疗的潜在靶点。
大量的流行病学数据显示局部和全身炎症都可促进冠状动脉斑块向不稳定以及破裂的趋势发展,IL-6是hs-CRP更上游的炎症标志物,也是NLRP3炎症小体、IL-1β和IL-18的下游炎症标志物,它与未来发生心血管事件的风险密切相关[15]。孟德尔随机化研究支持IL-6在AS血栓形成中的潜在因果作用,但IL-6水平降低是否与血管事件减少直接相关的数据仍不足[16]。一项关于冠心病患者与NLRP3炎症小体激活以及IL-1β和IL-18水平之间的关系研究[17]表明,IL-1β主要表达于冠状动脉管腔、血管外膜内皮细胞和巨噬细胞,参与及促进冠状动脉粥样硬化的过程;血清IL-18水平也与冠心病患者的心血管死亡呈正相关。Zheng等[18]研究了NLRP3炎症小体与冠心病患者之间的联系,发现在接受冠状动脉旁路移植术的患者中,通过免疫组化测定的NLRP3表达与冠状动脉粥样硬化的严重程度(通过Gensini评分测定)高度相关(P≤0.05)。有研究[19]比较冠心病患者与非冠心病患者外周血单个核细胞中NLRP3炎症小体水平以及血浆IL-1β和IL-18水平,结果显示冠心病患者的上述指标均高于非冠心病患者,支持NLRP3炎症小体激活与冠心病发生和发展的相关性。上述这些研究结果对冠心病的抗炎治疗提供了方向。
2 冠心病抗炎治疗的研究进展
2.1 卡那单抗
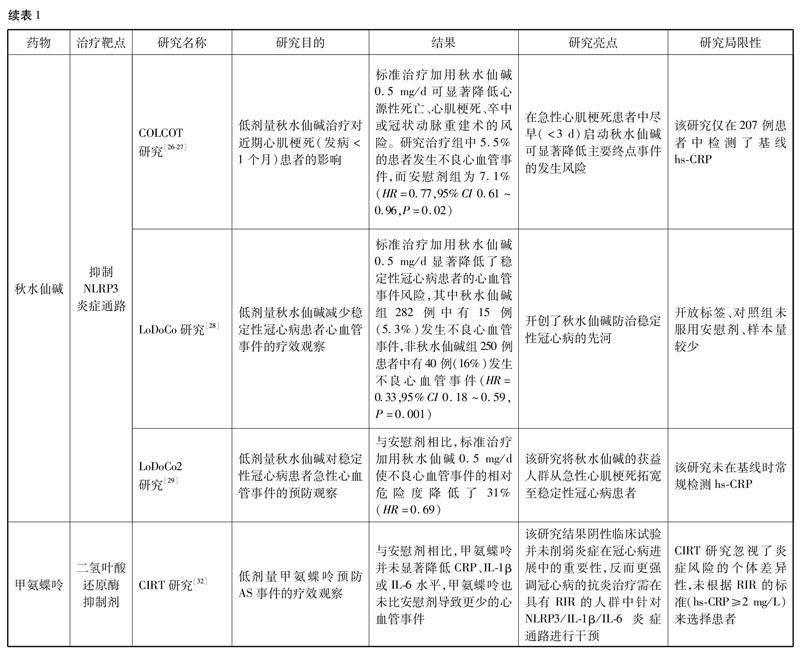
卡那单抗是一种靶向IL-1β炎症途径的单克隆抗体,已被批准用于罕见自身免疫病的治疗。以IL-1β为靶点的抗炎治疗能否降低冠心病患者的炎症反应,就此问题CANTOS研究[20]入选了10 061例既往患有心肌梗死且合并RIR的患者,在标准冠心病二级预防治疗的基础上,随机接受卡那单抗(50、150或300 mg,每3个月皮下注射1次)和安慰剂,主要终点事件为非致死性心肌梗死、非致死性卒中和心血管死亡,随访3.7年(中位时间)后发现,与安慰剂相比,卡那单抗在不影响血脂水平的情况下,显著降低炎症标志物hs-CRP水平(50 mg组:26%;150 mg组:37%;300 mg组:41%),并降低了主要终点事件的发生率(50 mg组:7%;150 mg组:15%;300 mg组:14%)。CANTOS研究是首个证实单纯抗炎治疗可减少心血管事件的大规模临床试验,一方面证实抗炎治疗需选择具有RIR的冠心病患者,另一方面证实NLRP3炎症小体通路是冠心病抗炎治疗的有效靶点。
2.2 托珠单抗
CANTOS研究为冠心病的抗炎治疗带来了曙光,但该研究的大部分参与者仍有相当大的心血管事件复发的风险,该风险与IL-18水平有关,卡那单抗对IL-1β的选择性抑制未能降低IL-18水平,而NLRP3炎癥小体的激活导致IL-1β和IL-18同时激活,因此仅抑制IL-1β仍有一定的RIR。IL-6位于NLRP3炎症小体、IL-1β和IL-18的下游,与未来心血管事件的风险密切相关,越来越多的研究希望通过选择性抑制IL-6来降低炎症风险[16]。托珠单抗是一种重组人源化抗IL-6受体的单克隆抗体,目前用于类风湿关节炎的治疗,然而MEASURE试验[21]发现托珠单抗显著升高了总胆固醇、LDL-C及甘油三酯的水平,有悖于冠心病的胆固醇学说,因此其抗炎效应并不适合推广至冠心病患者。
2.3 泽韦奇单抗
泽韦奇单抗(ziltivekimab)是一种直接拮抗IL-6配体的全人源单克隆抗体,RESCUE研究[22]探讨泽韦奇单抗能否降低心血管风险高危患者的炎症和血栓标志物水平。该研究纳入了264例中度至重度慢性肾脏病合并hs-CRP≥2 mg/L的患者,随机分配至泽韦奇单抗组(7.5、15或30 mg,每4周1次皮下注射)和安慰剂组,结果发现泽韦奇单抗显著降低了hs-CRP等与AS相关的炎症和血栓标志物水平。在此基础上,正在进行的Ⅲ期临床研究旨在证明泽韦奇单抗在动脉粥样硬化性心血管疾病合并慢性肾脏病和系统性炎症受试者中的有效性及安全性。
2.4 VIA-2291
VIA-2291是一种选择性5-脂氧合酶抑制剂,它是参与花生四烯酸级联反应并催化白三烯(leukotriene,LT) 合成的关键酶,LT是由花生四烯酸代谢的5-脂氧合酶通路衍生的炎症介质,在AS的发病机制中起着关键作用。5-脂氧合酶包括两种主要活性类型,即不含半胱氨酸的二羟基LTB4和半胱氨酰LT(LTC4、LTD4和LTE4)[23]。LTB4主要用于招募炎症细胞(T淋巴细胞、单核细胞和粒细胞),以促进白细胞黏附到血管内皮,增加血管通透性和平滑肌细胞增殖;LTC4、LTD4和LTE4通过增加血管收缩、血栓形成、血管通透性和动脉平滑肌细胞的增殖来促进AS。通过表达LTB4和半胱氨酸LT受体亚型的细胞表面受体,LT合成酶在AS病变中表达,并能在血管壁内发挥强大的促炎作用[13]。
有一项研究[24]纳入191例急性冠脉综合征患者,除标准的冠心病治疗外,每天给予25、50或100 mg VIA-2291,与安慰剂组对比,在治疗12周后治疗组中所有患者LTB4水平均降低(P<0.000 1),尤其是在100 mg治疗组中90%以上的患者LTB4水平显著降低。该研究还应用冠状动脉CT血管成像(computed tomography angiography,CTA)研究了VIA-2291对冠状动脉斑块体积的影响。其中60例受试者接受了2次冠状动脉CTA检查(初始和治疗24周),结果发现18例对照组中有5例(27.8%)、42例治疗组中有2例(4.8%)发现了新生的冠状动脉斑块(P=0.01)。与接受安慰剂相比,接受VIA-2291治疗24周时,hs-CRP水平降低了67%(P<0.01)。心外膜脂肪组织已被证明与冠状动脉粥样硬化的进展相关,被认为是不良心血管事件的预测因子。Almeida等[25]研究了VIA-2291对近期急性冠脉综合征患者心外膜脂肪组织体积的影响,发现与安慰剂组相比,治疗组(即使用VIA-2291 25、50或100 mg)可显著减少心外膜脂肪组织和心包脂肪组织(P=0.001)。在亚组分析中,治疗组总AS斑块体积的减少与心外膜脂肪组织体积的减少呈正相关(P=0.04)。
2.5 秋水仙碱
秋水仙碱作为经典的抗炎药物,目前的临床适应证为痛风、心包炎和家族性地中海热。秋水仙碱通过抑制微管形成进而抑制炎症细胞生成,也可减少黏附分子、炎症因子和炎症小体,导致包括NLRP3炎症通路在内的各种炎症途径下调。COLCOT研究[26]入选了4 745例新近(30 d内)发生的心肌梗死患者,每日口服秋水仙碱0.5 mg或安慰剂,平均随访22.6个月,结果发现,秋水仙碱组不良心血管事件发生风险下降了22.6%(HR=0.77,95%CI 0.61~0.96,P=0.02),在药物不良反应方面,两组差异无统计学意义(16.0% vs 15.8%,P=0.89),但秋水仙碱组重症肺炎的发生率略高(0.9% vs 0.4%,P=0.03)。COLCOT和CANTOS研究的成功有两个共同特点:(1)二者均作用于NLRP3炎症小体通路——卡那单抗特异性阻断NLRP3炎症小体通路的IL-1β,秋水仙碱通过抑制微管形成,非特异性地抑制NLRP3炎症小体的激活;(2)CANTOS和COLCOT研究纳入的患者均存在RIR,CANTOS研究人群基线hs-CRP为4.2 mg/L,COLCOT研究虽仅在207例患者中检测了基线hs-CRP,但其hs-CRP中位数为4.28 mg/L,结果类似于CANTOS研究。COLCOT研究证实秋水仙碱能降低冠心病患者的炎症反应,该研究的二次分析探讨了秋水仙碱治疗的启动时间是否影响心血管预后,结果发现,3 d内启动秋水仙碱治疗的患者,显著降低了主要终点事件的发生风险,因此,建议心肌梗死后患者应尽早(<3 d)在医院内给予秋水仙碱治疗[27]。
秋水仙碱不仅可抑制急性炎症反应,也可靶向治疗稳定性冠心病阶段的RIR。LoDoCo系列研究开创了秋水仙碱防治稳定性冠心病的先河,Nidorf等[28]开展的LoDoCo研究,共入组532例稳定性冠心病患者,在使用标准二级预防药物的基础上,试验组口服秋水仙碱0.5 mg,每日1次,随访3年(中位时间)后,试验组不良心血管事件的发生率明显降低(HR=0.33,95%CI 0.18~0.59,P<0.001)。针对LoDoCo研究存在的开放标签、对照组未服用安慰剂、样本量较少的弊端,Nidorf等[29]又开展了随机、双盲的LoDoCo2研究,这项试验招募了5 522例稳定性冠心病患者,随机分配至秋水仙碱组或安慰剂组,平均随访时间为28.6个月,结果发现,低剂量秋水仙碱可显著降低稳定性冠心病患者心血管事件的风险,启动秋水仙碱治疗初期患者即出现获益,随着治疗时间延长获益更加显著。然而该药的高不良反应率是其在临床上广泛应用的重要障碍,因此临床上需结合患者情况,充分权衡获益与风险,决定是否启用秋水仙碱治疗[30]。
2.6 甲氨蝶呤
甲氨蝶呤是一種改善风湿性疾病的药物,广泛应用于类风湿关节炎、银屑病、关节炎的患者,也有研究将其用于心血管疾病。它通过各种方式干扰免疫反应,机制如下[13]:首先,它提供叶酸类似物,竞争性抑制二氢叶酸还原酶,以减少四氢叶酸的合成,随后抑制嘌呤和嘧啶的合成,从而抑制DNA和RNA的产生,具有抗增殖和抑制免疫的作用。此外,四氢叶酸的减少会导致同型半胱氨酸的减少。同型半胱氨酸可刺激血管平滑肌细胞中mRNA和CRP的表达,参与激活炎症反应和促进AS的发生。
研究表明,炎症是类风湿关节炎患者冠状动脉粥样硬化进展的独立预测因子,因此甲氨蝶呤可使类风湿关节炎患者罹患心血管疾病和心血管死亡的风险降低。在一项对10项研究的荟萃分析[31]中显示(评估甲氨蝶呤在类风湿关节炎、银屑病和多发性关节炎中的应用),甲氨蝶呤使罹患心血管疾病的风险降低21%(n=10,95%CI 0.73~0.87,P<0.001),心肌梗死风险降低18%(n=5,95%CI 0.71~0.96,P=0.01)。基于上述研究,CIRT研究[32]试图确定低剂量甲氨蝶呤在预防AS事件中的疗效。该试验为随机、双盲(甲氨蝶呤的目标剂量为每周15~20 mg),在4 786例既往有心肌梗死或多支冠状动脉疾病病史的2型糖尿病或代谢综合征的患者中进行,结果发现与安慰剂相比,甲氨蝶呤并未显著降低CRP、IL-1β或IL-6水平,甲氨蝶呤也未比安慰剂导致更少的心血管事件。此外,与安慰剂相比,甲氨蝶呤与口腔溃疡、口腔疼痛、体重减轻、白细胞减少、转氨酶升高和癌症(特别是非基底细胞皮肤癌)增加相关。
2.7 其他一些药物的应用研究进展
阿那白滞素是一种重组IL-1受体拮抗剂,可阻断IL-1β与其在T细胞受体上的结合。有研究[33]表明,阿那白滞素可抑制AS病变的发展。二期临床试验[34]表明,阿那白滞素可有效降低CRP和IL-6水平。吉伏组单抗是一种单克隆抗体,可选择性地与IL-1β结合,形成复合物,阻止IL-1β与其受体结合,从而阻断IL-1信号级联的炎症反应,其在缓解AS进展方面显示出了良好的效果[33]。
冠心病抗炎药物治疗的相关研究总结见表1。
3 小结
抗炎治疗是对百年胆固醇学说的补充而非挑战。在冠心病的抗炎治疗领域,探索才刚刚开始。目前研究结果显示秋水仙碱、卡那单抗以及VIA-2291在冠心病抗炎治疗方面有一定成效,期待未来寻找到更安全、有效和经济的冠心病抗炎治疗策略,使抗炎治疗成为冠心病患者的常规二级预防用药,从而进一步降低冠心病患者的残余风险。
利益冲突 所有作者均声明无利益冲突
作者贡献声明 庄文文、杜明亮:收集整理文献、起草文章;郑晓群、惠慧:对文章的知识性内容作批评性审阅
参考文献
[1]Ference BA,Ginsberg HN,Graham I,et al.Low-density lipoproteins cause atherosclerotic cardiovascular disease.1.Evidence from genetic,epidemiologic,and clinical studies.A consensus statement from the European Atherosclerosis Society Consensus Panel[J].Eur Heart J,2017,38(32):2459-2472.
[2]Malakar AK,Choudhury D,Halder B,et al.A review on coronary artery disease,its risk factors,and therapeutics[J].J Cell Physiol,2019,234(10):16812-16823.
[3]Ridker PM,MacFadyen JG,Thuren T,et al.Residual inflammatory risk associated with interleukin-18 and interleukin-6 after successful interleukin-1β inhibition with canakinumab:further rationale for the development of targeted anti-cytokine therapies for the treatment of atherothrombosis[J].Eur Heart J,2020,41(23):2153-2163.
[4]Libby P.Inflammation in atherosclerosis—No longer a theory[J].Clin Chem,2021,67(1):131-142.
[5]Ruparelia N,Choudhury R.Inflammation and atherosclerosis:what is on the horizon[J].Heart,2020,106(1):80-85.
[6]Boland J,Long C.Update on the inflammatory hypothesis of coronary artery disease[J].Curr Cardiol Rep,2021,23(2):6.
[7]Ridker PM,Morrow DA,Rose LM,et al.Relative efficacy of atorvastatin 80 mg and pravastatin 40 mg in achieving the dual goals of low-density lipoprotein cholesterol<70 mg/dL and C-reactive protein<2 mg/L:an analysis of the PROVE-IT TIMI-22 trial[J].J Am Coll Cardiol,2005,45(10):1644-1648.
[8]Ridker PM,Danielson E,Fonseca FA,et al.Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein[J].N Engl J Med,2008,359(21):2195-2207.
[9] Ridker PM,Bhatt DL,Pradhan AD,et al.Inflammation and cholesterol as predictors of cardiovascular events among patients receiving statin therapy:a collaborative analysis of three randomised trials[J].Lancet,2023,401(10384):1293-1301.
[10] Paramel Varghese G,Folkersen L,Strawbridge RJ,et al.NLRP3 inflammasome expression and activation in human atherosclerosis[J].J Am Heart Assoc,2016,5(5):e003031.
[11] Silvis MJM,Demkes EJ,Fiolet ATL,et al.Immunomodulation of the NLRP3 inflammasome in atherosclerosis,coronary artery disease,and acute myocardial infarction[J].J Cardiovasc Transl Res,2021,14(1):23-34.
[12] Libby P.Interleukin-1 Beta as a target for atherosclerosis therapy:biological basis of CANTOS and beyond[J].J Am Coll Cardiol,2017,70(18):2278-2289.
[13] Eghtedari B,Roy SK,Budoff MJ.Anti-inflammatory therapeutics and coronary artery disease[J].Cardiol Rev,2023,31(2):80-86.
[14]Kaplanski G.Interleukin-18:biological properties and role in disease pathogenesis[J].Immunol Rev,2018,281(1):138-153.
[15]Libby P,Tabas I,Fredman G,et al.Inflammation and its resolution as determinants of acute coronary syndromes[J].Circ Res,2014,114(12):1867-1879.
[16]Interleukin-6 Receptor Mendelian Randomisation Analysis(IL6R MR) Consortium,Swerdlow DI,Holmes MV,et al.The interleukin-6 receptor as a target for prevention of coronary heart disease:a mendelian randomisation analysis[J].Lancet,2012,379(9822):1214-1224.
[17]Blankenberg S,Tiret L,Bickel C,et al.Interleukin-18 is a strong predictor of cardiovascular death in stable and unstable angina[J].Circulation,2002,106(1):24-30.
[18]Zheng F,Xing S,Gong Z,et al.NLRP3 inflammasomes show high expression in aorta of patients with atherosclerosis[J].Heart Lung Circ,2013,22(9):746-750.
[19]Satoh M,Tabuchi T,Itoh T,et al.NLRP3 inflammasome activation in coronary artery disease:results from prospective and randomized study of treatment with atorvastatin or rosuvastatin[J].Clin Sci(Lond),2014,126(3):233-241.
[20] Ridker PM,Everett BM,Thuren T,et al.Antiinflammatory therapy with canakinumab for atherosclerotic disease[J].N Engl J Med,2017,377(12):1119-1131.
[21]McInnes IB,Thompson L,Giles JT,et al.Effect of interleukin-6 receptor blockade on surrogates of vascular risk in rheumatoid arthritis:MEASURE,a randomised,placebo-controlled study[J].Ann Rheum Dis,2015,74(4):694-702.
[22]Ridker PM,Devalaraja M,Baeres FMM,et al.IL-6 inhibition with ziltivekimab in patients at high atherosclerotic risk(RESCUE):a double-blind,randomised,placebo-controlled,phase 2 trial[J].Lancet,2021,397(10289):2060-2069.
[23]王大震,俞夢越.冠心病抗炎治疗通路现状与展望[J].心血管病学进展,2022,43(7):586-589,599.
[24]Tardif JC,L'allier PL,Ibrahim R,et al.Treatment with 5-lipoxygenase inhibitor VIA-2291 (Atreleuton) in patients with recent acute coronary syndrome[J].Circ Cardiovasc Imaging,2010,3(3):298-307.
[25]Almeida SO,Ram RJ,Kinninger A,et al.Effect of 5-lipoxygenase inhibitor,VIA-2291(Atreleuton),on epicardial fat volume in patients with recent acute coronary syndrome[J].J Cardiovasc Comput Tomogr,2020,14(4):343-348.
[26]Tardif JC,Kouz S,Waters DD,et al.Efficacy and safety of low-dose colchicine after myocardial infarction[J].N Engl J Med,2019,381(26):2497-2505.
[27]Bouabdallaoui N,Tardif JC,Waters DD,et al.Time-to-treatment initiation of colchicine and cardiovascular outcomes after myocardial infarction in the Colchicine Cardiovascular Outcomes Trial(COLCOT)[J].Eur Heart J,2020,41(42):4092-4099.
[28]Nidorf SM,Eikelboom JW,Budgeon CA,et al.Low-dose colchicine for secondary prevention of cardiovascular disease[J].J Am Coll Cardiol,2013,61(4):404-410.
[29]Nidorf SM,Fiolet ATL,Eikelboom JW,et al.The effect of low-dose colchicine in patients with stable coronary artery disease:the LoDoCo2 trial rationale,design,and baseline characteristics[J].Am Heart J,2019,218:46-56.
[30]DAmario D,Cappetta D,Cappannoli L,et al.Colchicine in ischemic heart disease:the good,the bad and the ugly[J].Clin Res Cardiol,2021,110(10):1531-1542.
[31]Micha R,Imamura F,Wyler von Ballmoos M,et al.Systematic review and meta-analysis of methotrexate use and risk of cardiovascular disease[J].Am J Cardiol,2011,108(9):1362-1370.
[32]Ridker PM,Everett BM,Pradhan A,et al.Low-dose methotrexate for the prevention of atherosclerotic events[J].N Engl J Med,2019,380(8):752-762.
[33]Beckers CML,Simpson KR,Griffin KJ,et al.Cre/lox Studies identify resident macrophages as the major source of circulating coagulation factor -A[J].Arterioscler Thromb Vasc Biol,2017,37(8):1494-1502.
[34]Smith HW,Marshall CJ.Regulation of cell signalling by uPAR[J].Nat Rev Mol Cell Biol,2010,11(1):23-36.
收稿日期:2023-06-19
共同第一作者:莊文文,杜明亮
通信作者:郑晓群,E-mail:drxiaoqun@163.com