乌头酸脱羧酶1对BCG诱导巨噬细胞炎症反应的调控作用研究
戴 帆,刘占有,张旭阳,李 武*
(1.宁夏大学西部特色生物资源保护与利用教育部重点实验室,银川 750021;2.宁夏大学生命科学学院,银川 750021)
结核病(tuberculosis,TB)是由结核分枝杆菌(MycobacteriumTuberculosis,Mtb)感染引起的一种慢性呼吸道疾病[1-3]。尽管目前对TB的研究已经很成熟,但是随着耐多药结核菌株(multidrug resistant strains of TB,MDR-TB)的出现、艾滋病共感染及新型冠状病毒的大流行,使得TB的发病机制越发复杂多样,一定程度上增加了TB的治疗难度。Mtb是一种兼性胞内寄生菌,通过气溶胶传播感染宿主巨噬细胞,感染初期,Mtb通过释放大量的细胞壁成分及代谢产物诱导巨噬细胞进入程序性死亡状态,宿主细胞通过增强局部炎症反应和免疫细胞聚集来清除入侵的Mtb,与此同时Mtb也会通过抑制吞噬溶酶体融合、启动自身休眠机制等来逃逸巨噬细胞清除[4-6]。
据报道,轻度炎症反应在识别病原微生物、抵御和清除病原体入侵等方面具有重要作用,病原体刺激巨噬细胞启动代谢重编程,在巨噬细胞活化过程中会表达某些代谢酶[7]。三羧酸(tricarboxylic acid,TCA)循环是细胞能量代谢的枢纽,有研究发现TCA循环过程中的关键酶在炎症反应中发挥重要功能,这对于研究一些疾病具有重要意义[8-10]。乌头酸脱羧酶1(aconitate decarboxylase1,ACOD1),也称免疫应答基因(immune response genes 1,IRG1),ACOD1最初在 LPS(50 ng·mL-1)刺激的小鼠巨噬细胞系(RAW264.7细胞)中以2.3 ku的cDNA形式被发现[11]。因ACOD1含有糖胺聚糖(glycosaminoglycan,GAG)附着位点的一致序列,所以具有促进炎症部位白细胞浸润、定位及分泌巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)等作用,推测ACOD1可能具有免疫调节功能[12-14]。一方面ACOD1参与催化顺乌头酸脱羧生成衣康酸(itaconate)介导抗炎反应[15-16]。另一方面金黄色葡萄球菌(Staphylococcusaureus,S.aureus)、铜绿假单胞菌(Pseudomonasaeruginosa,P.aeruginosa)刺激会增加ACOD1的表达,病原菌通过利用衣康酸来诱导自身生物膜的形成,促进病原菌的生存[17-18]。因此认为ACOD1在感染中发挥双重作用,能引发不同的免疫反应。Toll样受体(Toll-like receptor,TLR)是一种模式识别受体,通过识别入侵细菌的病原相关分子模式(pathogen-associated molecular pattern,PAMP)或损伤相关分子模式(damage-associated molecular pattern,DAMP)来调控炎症和其他的先天免疫反应[19-20]。TLR4通路是炎症反应的典型代表,首先PAMPs和DAMPs激活TLR4,随后通过招募髓系分化因子88(myeloid differentiation factor 88,MyD88)介导IκB磷酸化来激活核因子κB(nuclear factor kappa-B,NF-κB)调节先天性免疫,NF-κB激活后,通过移位到细胞核与DNA结合位点结合,诱导产生重要的免疫介质,如促炎因子(TNF-α、IL-1β)、活性氧(reactive oxygen species,ROS)等参与炎症反应[19,21]。
在本试验中,作者使用BCG诱导小鼠巨噬细胞RAW264.7发生炎症反应。首先检测BCG感染下ACOD1及TNF-α、IL-1β的表达变化,随后基于小干扰RNA(si-ACOD1)技术,构建si-ACOD1结合BCG感染模型,进一步检测TLR4/MyD88/NF-κB通路蛋白(TLR4、MyD88、TRAF6、p-NF-κB p65、NF-κB p65、p-IκBα、IκBα)和细胞因子(TNF-α、IL-1β、COX2、iNOS、IL-4、IL-6、IL-10、TGF-β、IFN-α等)的变化情况,探讨ACOD1对BCG诱导巨噬细胞炎性反应的调控机制,以期为TB的发生机制提供新研究思路。
1 材料与方法
1.1 细胞系与菌株来源
本试验所用到的小鼠巨噬细胞RAW264.7购自中国科学院上海细胞研究所;BCG购自上海生物制品研究所。
1.2 试验试剂
胎牛血清(FBS)、DMEM高糖培养基均购自Gibco公司;SDS电泳缓冲液、10×TG buffer缓冲液购自上海百赛生物技术有限公司;全蛋白提取试剂盒、BCA蛋白定量试剂盒购自南京凯基生物技术有限公司;ACOD1抗体购自Abcam公司;β-actin抗体、羊抗兔和羊抗鼠IgG抗体购自Abmart公司;其他所用抗体均来自Proteintech公司;HRP化学发光试剂盒购自北京原业伯乐生物发展科技有限公司;反转录及qRT-PCR试剂均购自ABclonal,引物由上海生物工程有限公司合成;ACOD1腺病毒干扰载体(siRNA-ACOD1)由上海吉玛制药技术有限公司合成。
1.3 细胞与菌株培养
小鼠巨噬细胞RAW264.7使用含10%胎牛血清的DMEM培养基在37 ℃,5% CO2的恒温培养箱中培养,当细胞融合度达80%左右传代,选择第三代以后对数生长期的细胞进行试验。
BCG接种在分枝杆菌即用型液体完全培养基中,于37 ℃,5% CO2恒温培养箱培养4~6周,待BCG培养至OD600 nm=1.5后进行传代,其中以OD600 nm=0.1表示BCG的感染复数(MOI)为10,按照MOI=10的BCG感染巨噬细胞RAW264.7。
1.4 试验分组设置
试验BCG MOI处理组分为2组,即对照组(Control)和BCG MOI感染组,以感染时间为12 h感染巨噬细胞,其中MOI依次设置为5、10、15、20;BCG时间处理组分为2组,即对照组(Control)和BCG时间感染组,感染时间分别为6、12、18、24 h。
试验分为4组,分别是对照组(Control)、BCG感染组(BCG)、ACOD1敲减组(si-ACOD1)和ACOD1敲减结合BCG感染组(si-ACOD1+BCG)。其中,Control组是不经过任何处理的正常状态的RAW264.7细胞;BCG组是细胞贴壁约80%左右,经BCG处理12 h;si-ACOD1组和si-ACOD1+BCG组转染siRNA-ACOD1,转染24 h后si-ACOD1+BCG组使用BCG处理12 h。
1.5 小干扰RNA构建与转染
在NCBI核酸数据库中查找鼠源ACOD1蛋白编码序列,由上海吉玛制药技术有限公司设计合成了三条干扰序列(表1),进行干扰效率验证。将生长状态良好的RAW264.7细胞按1×106个接种于六孔板,待细胞融合度为60%左右做干扰处理,转染试剂与小干扰RNA按照1∶1(10 μL∶10 μL)的比例转染,转染时间24 h。

表1 小干扰RNA序列Table 1 The sequence of small interfere RNA
1.6 qRT-PCR检测
采用TRIZOL法提取总RNA,RNA浓度使用NanoDrop仪器(NanoDrop Technologies)测定,按照反转录试剂说明书进行反转录得到cDNA原液。根据试验所需进行稀释,之后进行qRT-PCR分析。其中引物信息见表2,以β-actin作为荧光检测PCR的内参进行归一化处理,使用 2-ΔΔCt方法计算mRNA 表达的相对倍数变化。
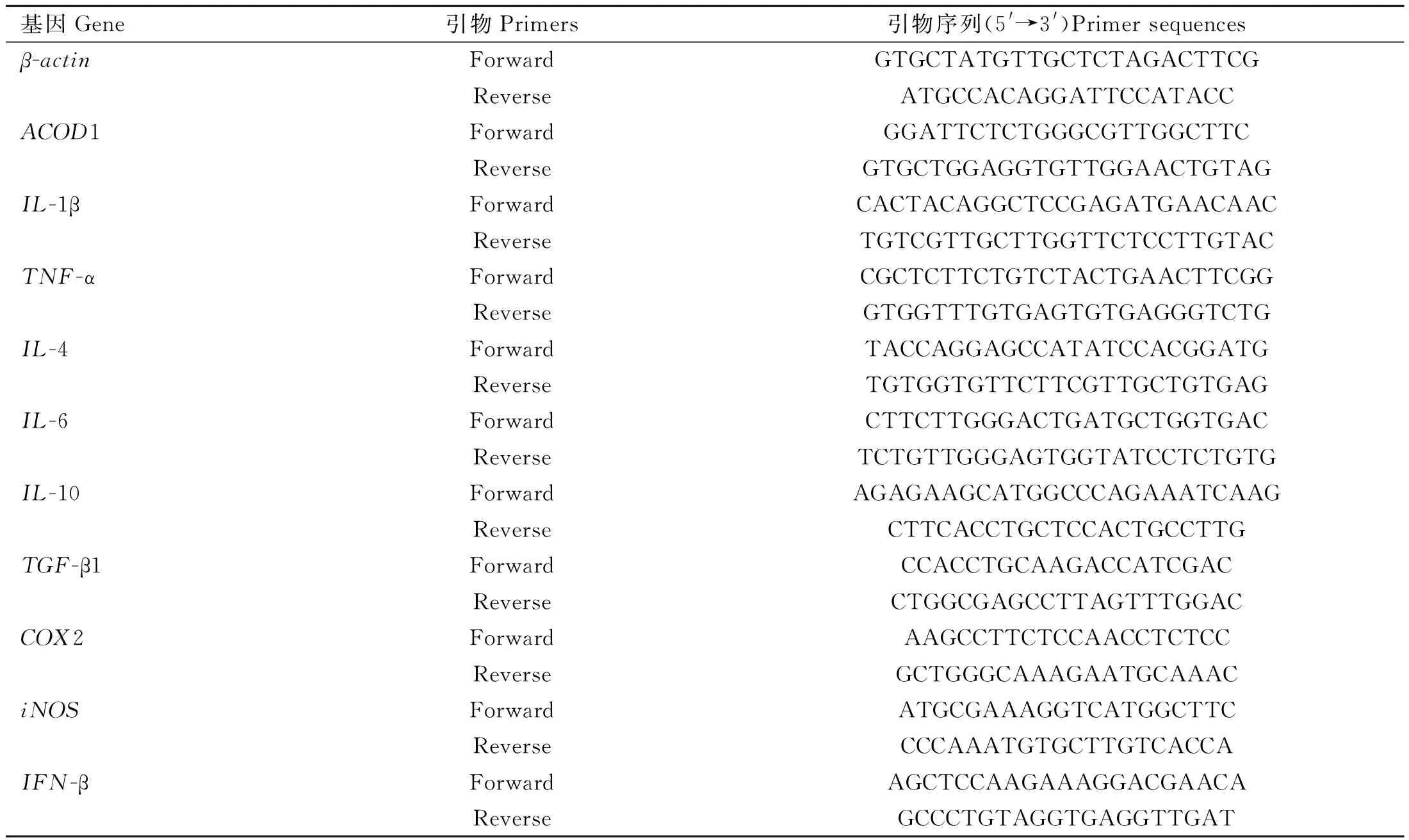
表2 qRT-PCR引物设计Table 2 Gene specific primers for qRT-PCR
1.7 全蛋白提取
使用全蛋白提取试剂盒提取总蛋白,BCA蛋白定量试剂盒对所提蛋白进行蛋白浓度测定。随后将蛋白依次进行以下操作:SDS-PAGE凝胶电泳、转膜、5%脱脂奶粉室温封闭、摇床4 ℃过夜孵育兔抗鼠的一抗,如内参蛋白β-actin和目的蛋白ACOD1、IL-1β、TNF-α,通路蛋白MyD88、TRAF6、NF-κB p65、p-NF-κB p65、IκBα、p-IκBα以及鼠抗兔的TLR4一抗;随后3% TBST洗膜5~6次,室温孵育辣根过氧化物酶(HRP)标记的相应山羊抗免IgG和山羊抗鼠IgG二抗;3% TBST同样洗膜5~6次;最后使用Amersham Image Quant 600仪器曝光处理,采用Image J软件对蛋白质条带进行定量分析。
1.8 免疫荧光染色
在12孔板中每孔放入无菌的10 mm盖玻片,随后每孔加入1 mL含10% FBS的DMEM培养基,以1×105个接种RAW264.7细胞,待细胞贴壁后按照试验设计处理12孔板。首先弃掉12孔板中的培养基,使用无菌PBS缓慢冲洗3次,5 min·次-1;4%多聚甲醛常温固定20 min;无菌PBS缓慢冲洗3次,5 min·次-1;0.5% TritonX-100通透15 min;无菌PBS缓慢冲洗3次,5 min·次-1;3% BSA常温封闭1 h;4 ℃过夜孵育免抗鼠ACOD1抗体,每孔500 μL;第二天弃掉一抗,使用无菌PBS缓慢冲洗3次,5 min·次-1;加入山羊抗免IgG荧光二抗(用PBS稀释,1∶500)500 μL避光孵育1 h;无菌PBS缓慢冲洗3次,5 min·次-1;准备DAPI、载玻片、封片剂等封片处理,随后在激光共聚焦显微镜下观察表达情况。
1.9 数据分析
2 结 果
2.1 BCG诱导巨噬细胞RAW264.7 内ACOD1表达上调
为了探究BCG感染是否会引起ACOD1的表达变化,试验通过Western blot和qRT-PCR方法检测BCG在不同MOI下ACOD1的表达变化。结果显示,与Control组相比,BCG感染会引起细胞内ACOD1表达显著上调(P<0.01)(图1A~F);且在MOI=10、感染时间为12 h时,ACOD1表达极显著(P<0.01)高于Control组。表明BCG可以诱导巨噬细胞RAW264.7内ACOD1高表达。
2.2 BCG诱导巨噬细胞RAW264.7炎性因子表达上调
前期研究表明炎症反应发生时细胞因子IL-1β、TNF-α的表达显著上调,而本试验通过Western blot方法对BCG感染巨噬细胞RAW264.7后细胞内IL-1β、TNF-α的表达情况进行进一步验证。结果显示,BCG会以时间和浓度依赖性的方式上调IL-1β与TNF-α的表达(P<0.01)(图2A~F)。表明BCG可以诱导巨噬细胞RAW264.7发生炎症反应。

A. Western blot检测BCG(MOI=10)感染不同时间后TNF-α、IL-1β蛋白表达量;D.Western blot检测BCG不同MOI下TNF-α、IL-1β蛋白表达量;B~C、E~F.TNF-α、IL-1β蛋白表达量灰度分析结果。*. P<0.05,**. P<0.01,***. P<0.001A. Western blot detection the expression of TNF-α and IL-1β protein levels of BCG infect in different time; D. Western blot detection the expression of TNF-α and IL-1β protein levels following BCG infection in different MOI; B-C, E-F. Bar graph analysis of the expression of TNF-α and IL-1β in mRNA and protein levels. *. P<0.05,**. P<0.01,***. P<0.001图2 BCG感染RAW264.7巨噬细胞后相关蛋白的表达量Fig.2 The expression of relative proteins of inflammation by BCG-infected
2.3 小干扰ACOD1的筛选验证
本试验前期已经证明BCG可以诱导巨噬细胞RAW264.7细胞内ACOD1高表达。为进一步证明ACOD1在BCG诱导巨噬细胞RAW264.7中的具体作用,试验设计合成了3条关于ACOD1的小干扰。通过荧光显微镜检测其转染效率(图3A),采用Western blot和qRT-PCR技术检测si-ACOD1转染进RAW264.7细胞后的表达效果(图3B~D)。结果发现转染24 h转染效率最佳,其中#2小干扰敲减效果最好(P<0.001),后续试验均以#2 si-ACOD1进行试验。
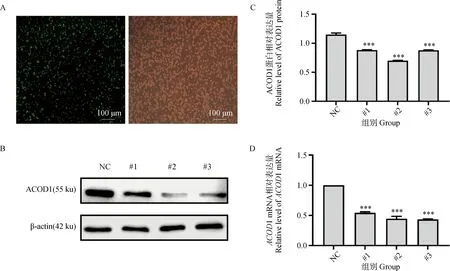
A.荧光显微镜观察siRNA-ACOD1转染效率(100×),比例尺:100 μm;B.用三种不同靶向的siRNA-ACOD1转染RAW264.7细胞24 h后,Western blot检测ACOD1蛋白的表达情况;C.ACOD1蛋白表达量灰度分析结果;D. qRT-PCR检测ACOD1 mRNA表达量。*. P<0.05,**. P<0.01,***. P<0.001A. Immunofluorescence observation of ACOD1 protein expression level after knockdown (100×); B-D. RAW264.7 cells were transfected with three different targeting siRNA-ACOD1 for 24 h, and knockdown was verified by Western blot and qRT-PCR. *. P<0.05,**. P<0.01,***. P<0.001图3 ACOD1小干扰RNA的验证Fig.3 Validation of interference efficiency of small interfering RNA targeting ACOD1
2.4 si-ACOD1下调BCG感染后RAW264.7细胞内ACOD1的表达
试验构建ACOD1小干扰结合BCG感染模型,采用Western blot、qRT-PCR与免疫荧光技术验证ACOD1的表达变化。结果显示,与Control组相比,BCG感染组ACOD1表达极显著上调(P<0.001);与BCG感染组相比,si-ACOD1+BCG 组ACOD1表达极显著下调(P<0.001)(图4A~C),免疫荧光试验验证了上述试验结果(图4D)。以上研究结果说明ACOD1干扰结合BCG感染细胞模型构建成功。
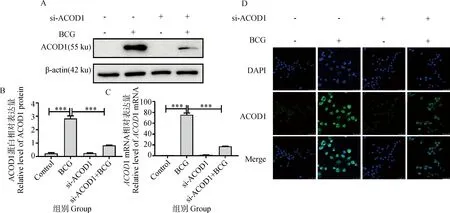
用siRNA-NC(阴性对照)或siRNA-ACOD1转染RAW264.7细胞24 h,然后用BCG感染12 h。A. Western blot检测敲减结合BCG感染后ACOD1敲减效果;B.ACOD1蛋白表达量灰度分析结果;C. qRT-PCR检测ACOD1 mRNA表达量;D. 免疫荧光检测敲减结合BCG感染后ACOD1敲减效果。*.P<0.05,**.P<0.01,***.P<0.001RAW264.7 cells were transfected with siRNA-NC (Negative control) or siRNA-ACOD1 for 24 h and then infected with BCG for 12 h. A. Western blot was used to detect the knockdown effect of ACOD1 in combination with BCG infection; B. Grayscale analysis results of ACOD1 protein expression level; C. qRT-PCR was used to detect the expression level of ACOD1 mRNA; D. Immunofluorescence detection of knockdown combined with BCG infection in ACOD1 knockdown effect. *. P<0.05,**.P<0.01,***.P<0.001图4 ACOD1敲减结合BCG感染巨噬细胞模型的建立Fig.4 ACOD1 knock-down combined with BCG infection
2.5 si-ACOD1参与BCG诱导的细胞因子表达
试验前期已经证明BCG可以诱导巨噬细胞RAW264.7炎症反应发生,为进一步验证ACOD1在BCG引起的炎症反应中的具体作用,本试验通过qRT-PCR技术验证BCG感染巨噬细胞后细胞因子的表达变化。结果显示,与Control组相比,BCG感染后促炎细胞因子TNF-α、IL-1β、IL-6、COX2和iNOS的表达极显著上调(P<0.001)(图5A~E),IFN-α无显著差异(图5F),抑炎细胞因子IL-4表达极显著下调(P<0.001)、IL-10表达极显著上调(P<0.001)(图5G~H),但是对于TGF-β无显著差异(图5I);与BCG感染组相比,si-ACOD1结合BCG感染组中促炎细胞因子极显著下调(P<0.001),抑炎相关因子IL-4、IL-10极显著上调(P<0.001),TGF-β无显著差异;因此,结果提示BCG可以引起巨噬细胞炎症发生,且ACOD1在炎症反应过程可能促进炎症反应发生。
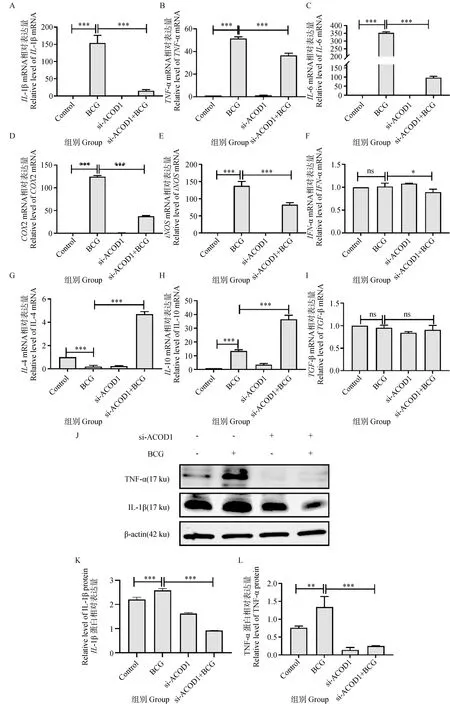
(图5续 Continued)A~I. qRT-PCR检测BCG感染结合ACOD1敲减对炎症相关细胞因子mRNA的影响;J. Western blot检测ACOD1敲减结合BCG感染后TNF-α、IL-1β蛋白表达量;K~L. TNF-α、IL-1β蛋白表达量灰度分析结果。*.P<0.05,**.P<0.01,***.P<0.001A-I. Grayscale analysis the expression of cytokines was detected by qRT-PCR; J. Western blot detection the expression of TNF-α and IL-1β protein levels; K-L. Grayscale analysis of Western blot detection results of TNF-α and IL-1β protein. *.P<0.05,**.P<0.01,***.P<0.001图5 si-ACOD1结合BCG感染对细胞因子影响Fig.5 The expression of cytokines level by BCG infection in RAW264.7
2.6 si-ACOD1通过TLR4/ MyD88/NF-κB通路发挥作用
本研究通过Western blot试验检测BCG感染巨噬细胞RAW264.7后p-NF-κB p65、NF-κB p65、p-IκBα、IκBα的变化,验证ACOD1对NF-κB信号通路的影响(图6A)。结果表明:与Control组相比,BCG感染组TLR4、MyD88、p-IκBα、p-NF-κB p65表达极显著上调(P<0.01),TRAF6显著上调(P<0.05)(图6A~F);与BCG感染组相比,si-ACOD1结合BCG感染组TLR4、MyD88、TRAF6表达极显著下调,p-NF-κB p65极显著下调,p-IκBα无显著差异变化。综上表明:ACOD1可以通过TLR4/MyD88/NF-κB信号通路调控BCG诱导的炎症反应。
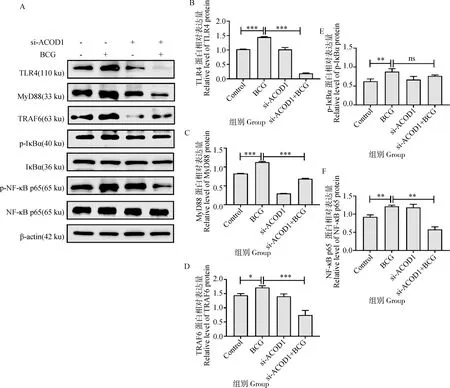
A.Western blot检测si-ACOD1结合BCG对TLR4/MyD88/NF-κB通路蛋白表达量情况;B~F.si-ACOD1结合BCG感染ACOD1蛋白表达量灰度分析结果。*.P<0.05,**.P<0.01,***.P<0.001A. ACOD1 cells were transfected with siRNA-ACOD1 for 24 h, and then infected with BCG and cultured for 12 h. The expression of TLR4, MyD88, TRAF6, IκBα, p-IκBα, NF-κB p65, p-NF-κB p65 were detected by Western blot; B-F. Grayscale analysis of Western blot detection results. *.P<0.05,**.P<0.01,***.P<0.001图6 si-ACOD1结合BCG感染对信号通路的影响Fig.6 Effect of ACOD1 knockdown on TLR4/MyD88/NF-κB signaling pathway induced by BCG infection
3 讨 论
巨噬细胞是宿主启动免疫防御的第一道防线,炎症感染初期,巨噬细胞通过释放细胞因子和趋化因子发挥吞噬、抗原递呈等作用,细胞因子和趋化因子会招募其他免疫细胞至炎症部位进一步清除病原菌[13,22]。ACOD1被认为是病原菌刺激下高度上调的基因之一,在抵御病原微生物入侵中发挥重要作用[23]。作者的研究发现,BCG诱导巨噬细胞RAW264.7发生炎症反应,并上调ACOD1表达。
多项研究表明,ACOD1敲除的小鼠存活率普遍较差,细菌负荷与病毒易感性增加,中性粒细胞产生失衡,组织损伤严重并伴有细胞因子风暴,说明ACOD1对机体有免疫保护作用[24-25]。但是也有研究发现,利什曼原虫(Leishmania)、呼吸道合胞病毒(respiratory syncytial virus,RSV)等感染细胞或组织,ACOD1表达的上调促进了促炎细胞因子及ROS的表达,下调抑炎细胞因子IL-10表达,病原菌通过利用ACOD1诱导产生的衣康酸来诱导自身生物膜形成,帮助自身生存以及加重组织细胞肺损伤[17,26-28];此外,ACOD1对内毒素耐药巨噬细胞和单核细胞的免疫抑制作用可能导致免疫麻痹和危及生命的继发感染[12]。综上表明,ACOD1在感染中起到双重作用,引发不同的免疫反应[29]。ACOD1异常表达与机体炎症、抗菌过程等密切相关,为此ACOD1通路变化将会影响机体免疫相关信号的表达以及各种疾病的发生[11]。作者通过小干扰RNA技术构建了si-ACOD1结合BCG感染模型,选用Western blot、qRT-PCR、免疫荧光等技术检测BCG感染后细胞因子的表达情况,结果表明,si-ACOD1结合BCG感染可以下调由BCG感染引起的促炎因子的表达,上调抑炎因子IL-4、IL-10的表达,作者还研究了INF-α与TGF-β的作用,同时si-ACOD1可以下调由BCG感染引起的COX2与iNOS表达,说明ACOD1可以促进由BCG感染引起的RAW264.7细胞炎症。但是ACOD1究竟是如何参与到BCG感染引起的炎症反应中的,其具体机制尚未完全研究清楚。与作者发现相反的是,Mtb感染小鼠及骨髓巨噬细胞同样可以诱导ACOD1表达,但ACOD1是通过激活衣康酸或者诱导负调节因子A20的产生来抑制TLR触发的NF-κB通路激活,进而抑制细胞因子及ROS产生,缓解炎症反应[25,30]。
有研究表明:ACOD1上调与TLR的激活有关,该信号通路调节广泛的炎症反应[19]。NF-κB转录因子家族参与病原体感染、组织损伤和肿瘤炎症,静息状态下,p50与p65会以二聚体形式存在细胞质中;NF-κB被激活后,磷酸化修饰的IKKα/γ降解IκB亚基,活化p65等转录激活因子从细胞质转移到细胞核,促进IL-6、IL-8、IL-12、GM-CSF、M-CSF等的合成及释放[22,31-32]。在本研究中,ACOD1通过激活TLR4/MyD88/NF-κB通路蛋白活化表达来上调促炎细胞因子表达,敲减ACOD1可以下调由BCG感染引起的TLR4、MyD88、TRAF6、p-NF-κB p65蛋白的表达。此外有研究发现,LPS刺激巨噬细胞,ACOD1通过抑制p65和IRF3的活化来抑制TLR4触发的促炎细胞因子和IFN-β产生[15]。这与作者的研究相反,作者的研究表明ACOD1在BCG感染引起的炎症中起到正向调节作用,促进炎症反应发生。
4 结 论
本研究得出以下结论,BCG感染诱导巨噬细胞中ACOD1发生高表达,敲减ACOD1可以抑制BCG诱导的巨噬细胞中促炎细胞因子的产生,这种抑制可能通过TLR4/ MyD88/NF-κB信号通路发挥作用,研究清楚ACOD1在BCG感染中发挥的作用,可能为研究Mtb的发病机制提供一种新的思路,对遏制结核分枝杆菌的传播具有十分重要的意义。

