同位素内标法—超高效液相色谱/串联质谱法测定六堡茶中苦参碱和氧化苦参碱残留量
石金娥
张洪禹3
辛若竹4
丁 梅4
奚广生1,2
(1. 梧州学院食品与制药工程学院,广西 梧州 543002;2. 梧州学院六堡茶现代产业学院,广西 梧州 543002;3. 梧州学院体育健康学院,广西 梧州 543002;4. 梅河口市食品药品检验检测中心,吉林 梅河口 135000)
六堡茶为黑茶的一种,以“红、浓、陈、醇”著称。与其他茶树一样,六堡茶茶树每年也会受小绿叶蝉、茶尺蠖、茶毛虫、茶丽纹象甲等虫害的侵袭[1-3]。茶园中常用苦参碱、印楝素、鱼藤酮、藜芦碱等植物源农药防治小绿叶蝉、茶尺蠖等虫害[4-7],植物源农药已成为茶园病虫害绿色防控的新趋势[8-10]。其中苦参碱和氧化苦参碱属于喹诺里西啶类生物碱,为高效、广谱植物源杀虫剂[11],联合使用更具速效和持久毒杀效果[12-15]。但一定剂量的苦参碱和氧化苦参碱会导致神经、肝损伤等[16]。
GB/T 19630—2019中有机产品可以施用苦参碱和氧化苦参碱等植物源农药,但GB 2763—2021中却未对茶叶中苦参碱和氧化苦参碱的施用残留量及检测方法做出任何规定。目前,有关苦参碱检测的研究较多,而氧化苦参碱的研究却鲜见报道[17],主要涉及的检测技术有GC技术[18]、LC技术[19]、GC/MS技术[20-21]、HPLC-MS/MS技术等[22-23],多采用外标法或基质外标法为主要定量方法,且多数方法回收率不高[24-26]。
研究拟结合苦参碱和氧化苦参碱的性质,通过优化色、质谱条件及样品前处理过程,采用同位素内标法定量,建立UPLC-MS/MS法测定六堡茶中苦参碱和氧化苦参碱残留量的测定方法,为茶叶中苦参碱和氧化苦参碱残留量检测以及风险评估提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
甲醇、甲酸、乙腈、甲酸铵:色谱纯,美国MREDA公司;
浓氨水、无水硫酸钠:化学纯,北京化工厂;
QEChERS提取盐 (1.5 g NaAc,6 g MgSO4)、QuEChERS净化管1(15.1 mg GCB,147.7 mg PSA,887.2 mg MgSO4)、QuEChERS净化管2(200 mg GCB,400 mg C18,400 mg PSA,1 200 mg MgSO4):美国Agilent公司;
0.2 μm滤膜:美国Pall公司;
苦参碱、氧化苦参碱标准物质:纯度≥98.9%,美国 Cerilliant 公司;
苦参碱-D3、氧化苦参碱-D3:纯度≥98%,加拿大Trc公司;
六堡茶样品:不同年份、不同季节的六堡茶16批次(2012年春茶、2012年秋茶、2012年老树茶、2014年夏茶、2014年秋茶、2016年社前茶、2016年明前茶、2018年春茶、2018年秋茶、2020年春茶、2020年秋茶、2020年老茶婆、2020年金花茶、2022年春茶、2022年秋茶、2022年老茶婆),市售。
1.1.2 主要仪器设备
超高效液相色谱—串联质谱仪:TSQ Endura型,美国 Thermo Fisher公司;
涡旋混合器:IKA型,欧莱博科学仪器有限公司;
超声波清洗器:DQ-110E型,瑞莱博科技有限公司;
离心机:Allegra 64 型,美国Beckman公司;
氮吹仪:TTL-DC型,联泰科技发展有限公司。
1.2 方法
1.2.1 标准溶液配制
(1) 标准储备液:以甲醇为溶剂分别配制苦参碱、氧化苦参碱、苦参碱-D3、氧化苦参碱-D3标准储备液(1 mg/mL),于-18 ℃避光保存。
(2) 混合标准使用液:取苦参碱和氧化苦参碱标准储备液,用50%的甲醇溶液(含0.1%甲酸)配制,得到质量浓度分别为10,100 μg/L的苦参碱和氧化苦参碱混合标准使用液。
(3) 内标使用液:取苦参碱-D3和氧化苦参碱-D3标准储备液,用50%甲醇溶液(含0.1%甲酸)配制,得到苦参碱-D3质量浓度为10 μg/mL,氧化苦参碱-D3质量浓度为1 μg/mL。
(4) 混合标准工作溶液:分别吸取10 μg/L的混合标准使用液10,50,100 μL及100 μg/L的混合标准使用液50,100,200,500,800 μL于样品瓶中,加内标使用液10 μL,用含0.1%甲酸的甲醇溶液(V甲酸∶V甲醇为1∶1)定容至1.0 mL,混匀。配制的混合标准工作溶液质量浓度分别为0.1,0.5,1.0,5.0,10.0,20.0,50.0,80.0 μg/L。其中苦参碱-D3质量浓度为100 μg/L,氧化苦参碱-D3质量浓度为10 μg/L。
1.2.2 样品前处理 称取0.5 g(精确至0.01 g)试样于50 mL玻璃离心管中,加入50 μL内标混合使用液,加入10 mL含0.2%氨水的乙腈水溶液(V氨水∶V乙腈为4∶1),涡旋60 s,超声10 min,加入5 g无水Na2SO4,再次涡旋2 min,离心5 min(9 500 r/min,4 ℃)。吸取5.0 mL上清液于QuEChERS净化管1中,涡旋2 min,离心5 min(5 000 r/min,4 ℃)。将2.00 mL上述液体转移至另一支10 mL玻璃离心管中,氮吹近干(40 ℃水浴),加入1.0 mL含0.1%甲酸的50%甲醇溶液溶解残渣,涡旋1 min,过0.22 μm滤膜,上机测定。
1.2.3 液相色谱条件 色谱柱为Kinetex®2.6 μm Biphenyl 100 Å(100 mm×3.0 mm)或等效柱;柱温35 ℃;流动相A泵为水相 (0.1%甲酸),B泵为甲醇相 (0.1%甲酸),流速0.35 mL/min;进样量5 μL;洗脱程序见表1。
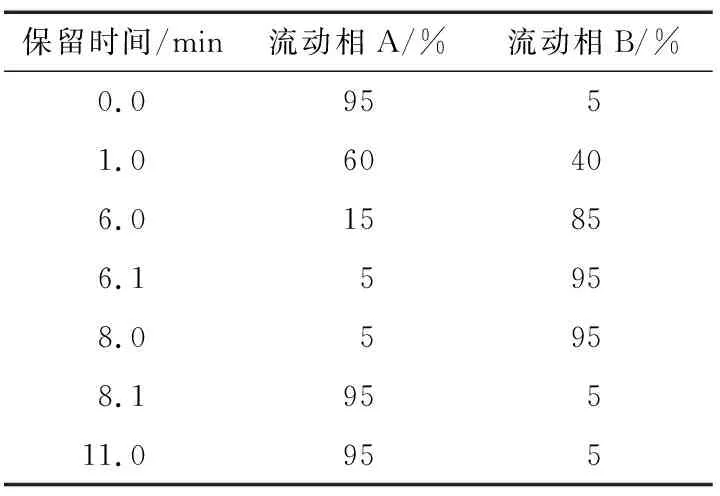
表1 流动相配比及洗脱条件
1.2.4 质谱条件 电离方式为电喷雾离子源正离子模式,多反应监测模式采集;电喷雾电压5 500 V;气帘气压力207 kPa;辅助气压力483 kPa;雾化气压力345 kPa;离子源温度500 ℃;碰撞气6 mL/min;离子对、保留时间等参数见表2。
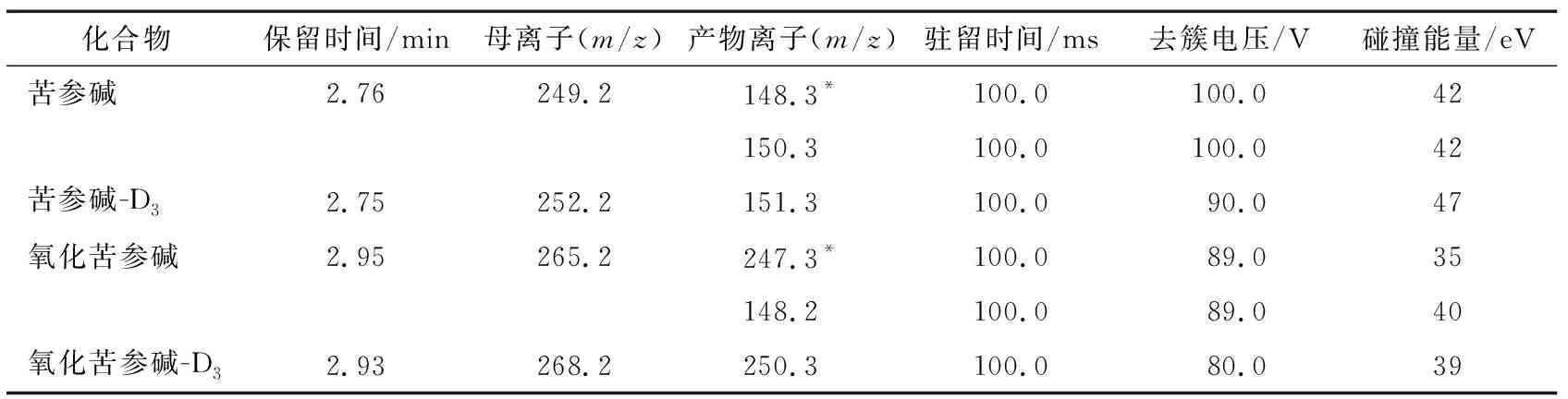
表2 去簇电压、离子对及碰撞能量值†
1.2.5 线性范围测定 按优化后的参数和条件对标准工作液系列进行测定,以苦参碱标准溶液中待测组分峰面积与相应氧化苦参碱内标物峰面积的比值为纵坐标,苦参碱标准溶液中待测组分浓度与相应氧化苦参碱内标物浓度的比值为横坐标,绘制内标—校准工作曲线。
1.2.6 定量限及检出限测定 向基质中添加一定浓度的目标物及内标物,以3倍信噪比(S/N=3)对应的目标物浓度计算检出限,以10倍信噪比(S/N=10)对应的目标物浓度计算定量限。
1.2.7 回收率和精密度测定 向基质中定量添加目标物及内标物,按建立的方法测定6次,并计算方法回收率和精密度。
2 结果与分析
2.1 前处理条件优化
2.1.1 提取溶剂选择 因苦参碱和氧化苦参碱为碱性水溶性化合物[23],考虑茶叶基质(含鞣酸等酸性物质)的特殊性,仅对中性和碱性提取体系进行考察。分别对水复溶+1%氨水乙腈提取、水复溶+含0.2%氨水的乙腈水溶液(V氨水∶V乙腈为4∶1)提取和直接用含0.2%氨水的乙腈水溶液(V氨水∶V乙腈为4∶1)提取3种方式进行回收率考察。试验发现,直接用80%乙腈水溶液(含0.2%氨水)对茶叶样品进行提取的回收率最高,可能是水的前期参与会使茶叶溶出大量的酸性物质,这些酸性物质会与苦参碱发生反应[25],导致回收率较低;但直接用80%乙腈水溶液(含0.2%氨水)提取时,因过量的氨水可以中和茶叶基质中的酸性物质,保护了苦参碱,从而有利于提取效率的提升。当直接用80%乙腈水溶液(含0.2%氨水)提取时,苦参碱回收率为93.8%~103.7%,氧化苦参碱回收率为92.0%~104.7%,结果均满意。
2.1.2 净化方法优化 分别选用无水硫酸钠和QuEChERS盐为提取盐,用80%乙腈水溶液(含0.2%氨水)对加标样品进行提取,选择QuEChERS净化管1、QuEChERS净化管2进行净化,考察净化方式对回收率的影响。由表3可知,当以无水硫酸钠为提取盐QuEChERS净化管1净化时,苦参碱和氧化苦参碱的回收率较好,其余组合回收率均较低,可能是QuEChERS净化管2中大量的石墨化炭黑(GCB)对苦参碱和氧化苦参碱有较强的吸附[24],导致苦参碱和氧化苦参碱的回收率偏低。

表3 净化方法对回收率的影响
2.2 仪器条件优化
2.2.1 色谱条件优化 分别以0.1%甲酸水—甲醇、0.1%甲酸水—0.1%甲酸—甲醇、0.1%甲酸水—0.1%甲酸—乙腈、5 mmol/L甲酸铵溶液(含0.1%甲酸)—0.1%甲酸—甲醇为流动相,考察不同配比的流动相对目标物的洗脱效果,结果见表4。由表4可知,以甲醇为主体的流动相使得苦参碱和氧化苦参碱的响应值和分离效果均较好,且甲酸浓度增加后,响应效果更显著;甲酸铵的存在同样能得到较高的响应值和较好的分离效果,但从配制便捷的角度考虑,优先选择0.1%甲酸水—0.1%甲酸—甲醇为流动相。
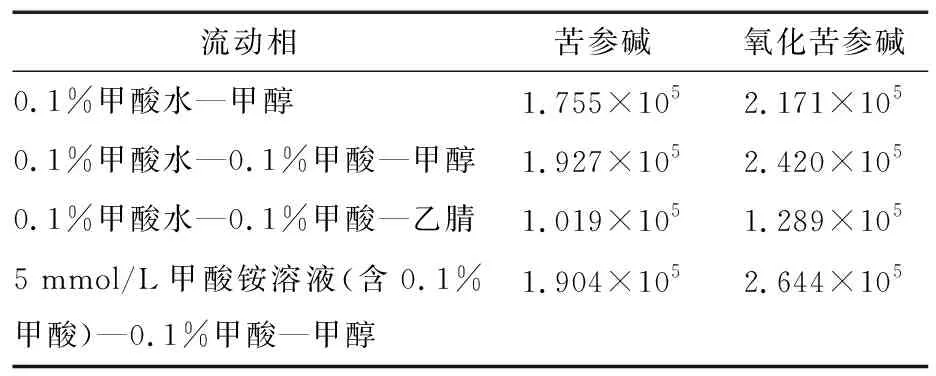
表4 流动相对苦参碱和氧化苦参碱响应值的影响
2.2.2 质谱条件优化 按试验条件进样分析,进一步验证所选离子对的响应值和稳定性,最终确定了4种目标物的离子对,苦参碱和氧化苦参碱及内标物溶液的MRM色谱图如图1所示。
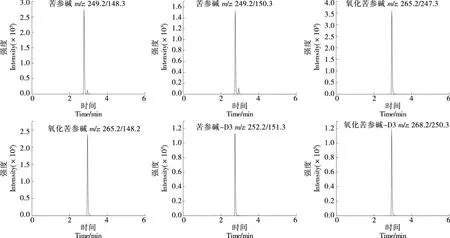
图1 苦参碱、氧化苦参碱及内标物的MRM色谱图
2.3 方法的校准曲线和检出限
由表5可知,苦参碱和氧化苦参碱在0.1~80.0 ng/mL质量浓度范围内线性关系良好,相关系数均>0.999 6。以3倍信噪比(S/N=3)对应的加标量为检出限,10倍信噪比(以S/N=10)对应的加标量为定量限,测得苦参碱和氧化苦参碱的检出限均为1.0 μg/kg,定量限均为3.0 μg/kg。

表5 校准曲线及线性范围
2.4 方法的精密度和加标回收率
茶叶样品按5个浓度水平加标,分别测定6次,其回收率及相对标准偏差见表6。由表6可知,苦参碱的相对标准偏差为1.7%~4.8%,回收率为93.8%~103.7%;氧化苦参碱的相对标准偏差为2.1%~5.3%,回收率为92.0%~104.7%;均满足GB/T 27404—2008的要求,说明试验方法准确可靠。
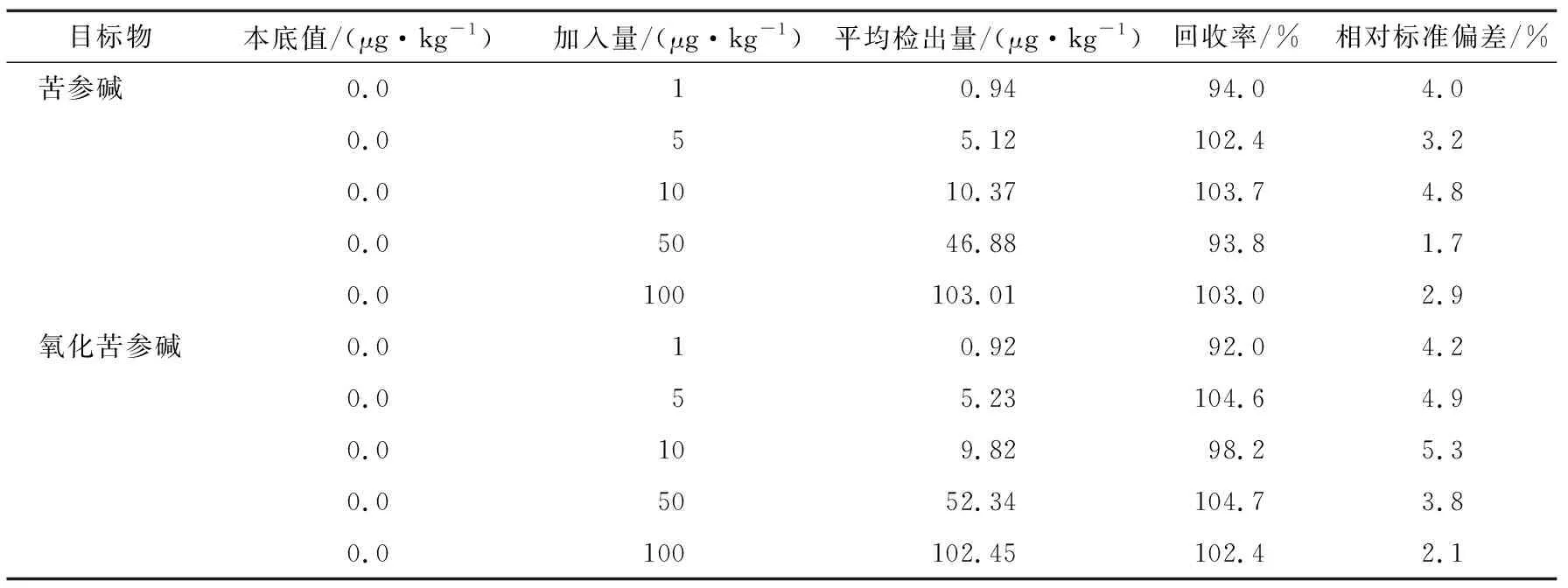
表6 精密度及回收率结果
2.5 样品测试
对采购的16种不同年份、不同季节的六堡茶进行测定,结果显示,苦参碱和氧化苦参碱均未检出,说明在苦参碱和氧化苦参碱类生物类农药考察中,六堡茶具有较高的安全性。
3 结论
通过对色谱、质谱条件及样品前处理过程的不断优化,建立了一种内标法测定六堡茶中苦参碱和氧化苦参碱残留量的方法。该方法缩短了茶叶中苦参碱和氧化苦参碱的前处理周期,提高了检测效率,且该方法具有良好的线性范围和较高的回收率,灵敏度、准确度、精密度均满足GB/T 27404—2008要求。对市售六堡茶进行摸底,结果显示六堡茶中均未检出苦参碱和氧化苦参碱。后续将以六大茶类为研究对象,确认该方法在六大茶类中的适用性,同时对市售六大茶类在施用苦参碱和氧化苦参碱杀虫剂的安全性进行考察,以期该方法有更广泛的适用性。

