炎性微环境下TGF-β1通过TGF-β1/Smad3通路促进BMSCs成骨分化
刘翠翠 吴亚星 张淑婷 李向鑫 张 静
牙周组织长期处于慢性、持续性炎性状态将造成牙槽骨的病理性吸收,最终导致牙齿松动甚至脱落,应用干细胞修复缺损牙槽骨打破了以往治疗的瓶颈[1~3]。然而,在炎性环境下如何利用干细胞的定向分化特性提高其骨向分化效率,最终获得牙槽骨的完全性再生,稳固牙齿,恢复天然牙齿的生理功能是当前研究的重点。
间充质干细胞(mesenchymal stem cells,MSCs)的分化受其周围环境的影响,涉及很多细胞因子和信号分子,彼此相互作用共同调控干细胞的定向分化。近年研究证实,MSCs除直接参与组织修复外,更重要的机制在于分泌可溶性因子,这些因子使MSCs与免疫细胞相互作用,从而发挥抗炎和免疫抑制作用[1,4]。笔者团队前期研究显示,炎性环境下骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)可分泌IL-6、IL-8、转化生长因子β1(transforming growth factor β1,TGF-β1)等细胞因子,其中TGF-β1的表达最为显著[5]。然而在炎性微环境下,TGF-β1在BMSCs骨向分化中的作用目前尚不清楚。因此,本研究应用肿瘤坏死因子(tumor necrosis factor-α,TNF-α)刺激模拟炎性微环境,明确TGF-β1在BMSCs成骨分化中的作用,初步探讨其作用机制。
材料与方法
1.材料与试剂:TNF-α、TGF-β1、SB431542购自美国PeproTech公司;p-Smad3抗体购自美国Bioss公司;RNA提取试剂盒、cDNA 链合成试剂盒、荧光定量检测试剂盒、骨桥蛋白(osteopontin,OPN)、Runt相关转录因子2(Runt-related transcription factor 2, RUNX2)、碱性磷酸酶(alkaline phosphatase,ALP)、Smad3抗体购自武汉塞维尔生物科技有限公司。
2.BMSCs分离培养及鉴定:选取4周龄SD雄性大鼠(购自徐州医科大学实验动物中心),依据以往描述方法采用全骨髓培养法分离纯化培养BMSCs。骨向、脂向分化能力鉴定:分别在矿化诱导条件下及成脂诱导液中培养,14天后甲醛固定油红O染色、21天茜素红染色,镜下观察矿化结节及脂滴的形成情况。
3.细胞增殖能力测试:将BMSCs以1 × 106个/孔的密度接种于 96 孔板内,24h后PBS洗3遍,更换包含100ng/ml TNF-α的矿化诱导液,同时加入不同浓度 (2.5ng/ml、5ng/ml、10ng/ml、20ng/ml、50ng/ml) TGF-β1连续培养,每组6孔。待细胞生长接近融合后,加入50μl的1×MTT液,恒温孵育箱培养4h后,每孔加入150μl DMSO,振荡10min,于490nm波长处检测每个孔的吸光度(A)值。
4.分组方法:样本随机分为3组,对照组为BMSCs+含100ng/ml TNF-α的矿化诱导液(osteogenic medium,OM),实验组为BMSCs+100ng/ml TNF-α的OM+TGF-β1,抑制组为BMSCs+100ng/ml TNF-α的OM+SB431542(TGF-β1拮抗剂)。
5.ALP和茜素红染色:每组细胞连续培养至第7、10天时分别进行染色。ALP染色:4%多聚甲醛固定20min,每孔加入BCIP/NBT工作液1ml,避光孵育3h,洗涤后于镜下拍照,使用Image-Pro Plus 6.0软件计算染色面积百分比;茜素红染色:4%多聚甲醛室温固定30min,PBS清洗后,加入0.1%茜素红染液,室温孵育30min,洗涤后,观察茜素红染色。
6.成骨相关基因及TGF-β1通路关键因子的检测:于24h、7天分别提取各组细胞总RNA,RT-qPCR检测OPN、RUNX2、ALP、Smad2和Smad3mRNA表达变化。GAPDH作为内参基因,引物序列如表1。

表1 引物序列
7.成骨相关蛋白及Smad3、p-Smad3蛋白的表达:用RAPI裂解液提取各组细胞总蛋白,进行蛋白定量、电泳、转膜、封闭,室温孵育一抗1h、二抗1h,化学成像发光仪进行成像。Image J软件进行灰度分析。
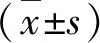
结 果
1.BMSCs培养与鉴定:镜下见细胞贴壁伸展后呈梭形。成脂诱导14天后油红O染色,镜下可见红色脂滴形成;成骨诱导21天茜素红染色可见较多的矿化结节,证实BMSCs具有多向分化能力(图1)。
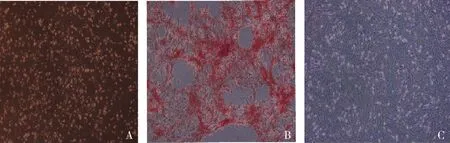
图1 BMSCs 的形态及多向分化能力鉴定(×40)
2.炎性环境下TGF-β1对BMSCs增殖能力的影响:结果显示24h时,TGF-β1在低浓度时(2.5~10.0ng/ml),BMSCs增殖能力随浓度增高逐渐增高,10.0ng/ml时BMSCs增殖能力最高,其后随TGF-β1浓度增高(10~50ng/ml),BMSCs增殖呈现降低趋势,在最大浓度(50ng/ml)增殖活性最低;在48h和72h时,BMSCs增殖趋势与24h一致,即TGF-β1在最大浓度50ng/ml时,BMSCs增殖活性最低(图2,P<0.05)。因此后续实验选取50ng/ml 的TGF-β1来研究BMSCs骨向分化能力的影响。
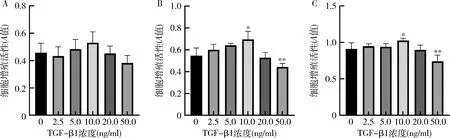
图2 炎性环境下不同时间段、不同浓度TGF-β1作用下对BMSCs增殖能力的影响
3.ALP染色:在7天和10天时,与对照组及抑制组比较,实验组内ALP染色最深、面积最大(图3),实验组与对照组比较,抑制组与对照组比较染色面积均有统计学意义(P<0.01,图4)。
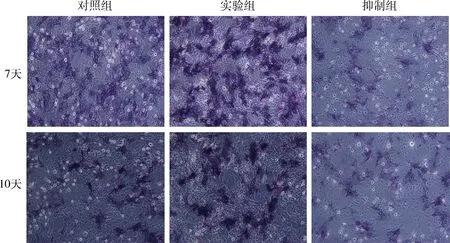
图3 各组BMSCs ALP图染色(×40)

图4 各组BMSCs ALP染色面积百分比
4.茜素红染色结果:7天和10天时,与对照组比较,实验组内矿化结节形成较多,而抑制组内矿化结节明显减少(图5)。
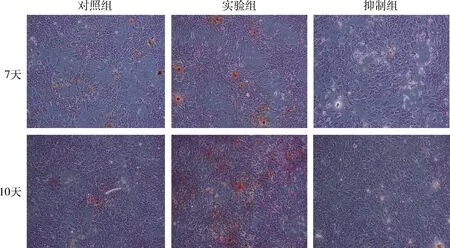
图5 各组BMSCs茜素红染色图(×40)
5.基因检测:成骨诱导7天时提取细胞内总RNA,结果显示,实验组内OPN、RUNX2和ALP基因表达水平均增高,与对照组比较,差异有统计学意义(P<0.05),而抑制组内基因表达水平均降低,其中RUNX2与OPN的表达与对照组较,差异有统计学意义(P<0.05,图6)。Smad2的表达在实验组内较其他两组高,但3组间比较差异无统计学意义(P>0.05);Smad3的表达在实验组最高、抑制组最低,两组与对照组比较,差异有统计学意义(P<0.01,图7)。
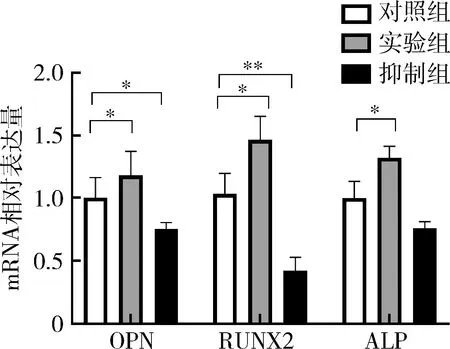
图6 骨向分化基因OPN、RUNX2、ALP的表达
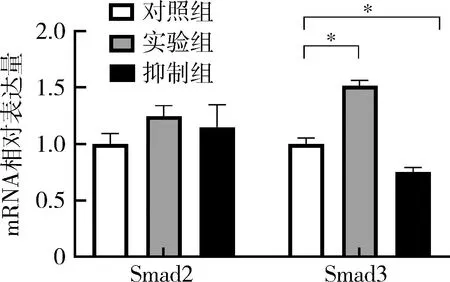
图7 TGF-β信号通路中Smad2、Smad3的表达
6.蛋白表达测试: OPN、RUNX2、ALP蛋白表达水平(图8)在实验组内均明显增加,抑制组内表达明显降低;两组与对照组比较,差异均有统计学意义(图9,P<0.05); Smad3的表达在3组中差异不明显,而p-Smad3在实验组中表达明显增高、抑制组中明显降低,差异有统计学意义(P<0.01,图10、图11)。

图8 OPN、RUNX2、ALP蛋白表达水平
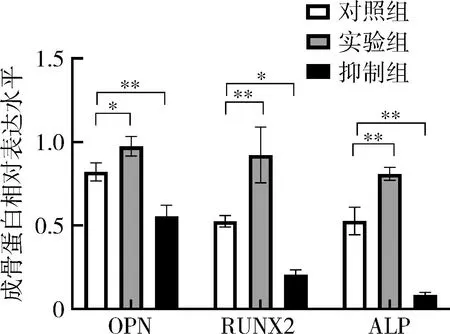
图9 OPN、RUNX2、ALP蛋白相对表达水平
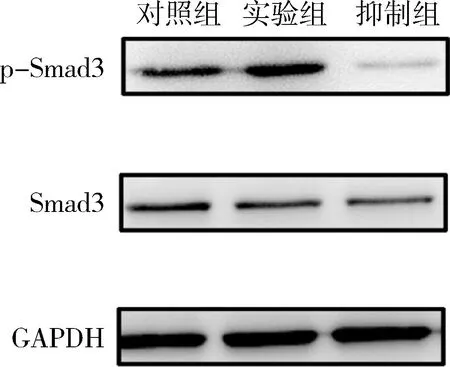
图10 Smad3及p-Smad3蛋白表达水平
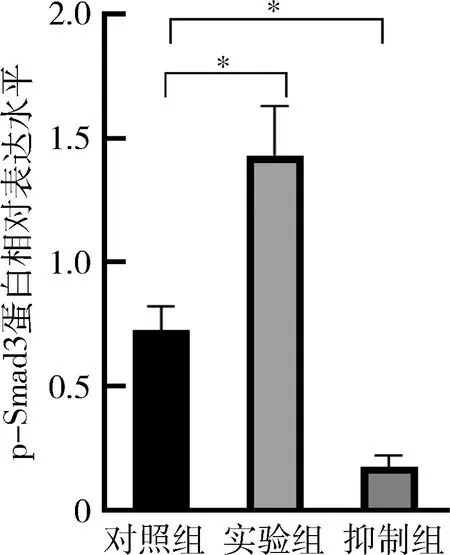
图11 p-Smad3蛋白相对表达水平
讨 论
微环境是决定细胞行为的重要因素,微环境中的MSCs、生长因子和细胞外基质之间的相互作用共同影响周围骨的动态平衡[6,7]。研究证实,细胞因子TGF-β1不仅在骨组织的发育和免疫稳态中发挥重要作用,而且其浓度的高低可影响细胞的增殖活性[8~10]。笔者团队前期研究表明,炎性环境下TGF-β1参与了BMSCs成骨分化过程[5]。为进一步明确TGF-β1在BMSCs骨向分化中的作用,本研究首先检测了不同时间段、不同浓度TGF-β1作用下对BMSCs增殖能力的影响,结果显示,炎性微环境下,低浓度的TGF-β1促进BMSCs增殖,高浓度(50ng/ml)抑制BMSCs增殖。这一结果与姜力铭等[11]研究一致:低浓度的TGF-β1(10ng/ml)作用下促进干细胞的增殖。Zhang 等[12]研究也证实了低浓度的TGF-β1可以诱导BMSCs增殖并促进Mdm2、Akt1、Wnt3和β-连环蛋白等的表达。Xu等[13]研究也显示,随时间的延长,低浓度的TGF-β1(1ng/ml)促进BMSCs骨向分化、上调ALP和Osterix的表达,而高浓度TGF-β1(50ng/ml)显著抑制BMSCs成骨分化,该结果与本研究结果一致。本研究结果显示,不同时间段BMSCs的增殖能力均在TGF-β1最大浓度(50ng/ml)时最低。对多种细胞类型的研究表明增殖和分化是负相关的过程,因此笔者后续实验选取50ng/ml 的TGF-β1来研究其对BMSCs骨向分化能力的影响。
ALP属于分化早期指标,其表达与细胞分化状态密切相关,在组织钙化中起着重要作用[14]。矿化结节形成是成骨分化晚期的标志之一。OPN是一种由成骨细胞分泌产生的调节蛋白,可参与骨组织的改建[15,16]。而RUNX2的表达是成骨分化早期所必须的,它可调节骨向分化基因如ALP、Col-1和OCN的表达[17]。本研究结果显示,炎性环境下,加入TGF-β1的实验组与其他两组比较,ALP染色较深、面积最大;矿化结节形成能力也高于其他两组,而加入TGF-β1拮抗剂SB431542的抑制组内矿化结节形成明显较少。本研究结果显示,炎性微环境中,TGF-β1作用下BMSCs内成骨分化基因OPN、RUNX2和ALP表达均增高,而加入TGF-β1拮抗剂的抑制组内成骨分化基因表达均明显降低,两组结果与对照组比较,差异均有统计学意义。这些结果表明,炎性微环境下TGF-β1能促进BMSC的成骨分化。然而有研究报道,TGF-β1在骨形成早期能促进成骨,而晚期则产生抑制的双重作用[13]。因此,TGF-β1在MSCs骨向分化中的作用结论并不一致,依据微环境、分化时期等因素有所不同。
牙周骨组织改建通过多种细胞因子共同协调作用、经由不同的信号通路完成,其中最重要的是TGF-β信号通路[18]。TGF-β1通过Ⅰ型和Ⅱ型受体复合物在表面转导,随后SMAD蛋白被磷酸化,磷酸化的Smad2/Smad3与Smad4结合后转移细胞核中,最终激活或抑制下游靶基因的表达[19]。而SB431542是TβRI受体拮抗剂,通过抑制Smad3的体外磷酸化,阻断TGF-β信号通路,最终影响骨的代谢[20,21]。本研究结果显示,TGF-β1作用下,实验组内骨向分化蛋白OPN、RUNX2、ALP表达水平增高,而抑制组内蛋白表达均降低,与对照组比较,差异均有统计学意义(P<0.05)。进一步对TGF-β信号通路中关键因子表达进行检测,结果显示,实验组内Smad3基因表达最高,抑制组表达最低,与对照组比较差异均有统计学意义(P<0.05);对蛋白表达检测结果显示,实验组内p-Smad3蛋白表达显著增高,而抑制组内p-Smad3蛋白表达明显降低,与对照组比较,差异有统计学意义(P<0.01)。因此,本研究证实炎性微环境中TGF-β1激活TGF-β/Smad信号通路,经由p-Smad3最终促进了BMSCs内成骨分化基因及蛋白的表达。
因此,本研究证实炎性微环境下,TGF-β1通过Smad3调控BMSCs的成骨分化。然而炎性环境下TGF-β1激活Smad3信号通路后如何与局部免疫细胞相互作用,调节损伤微环境、从而促进BMSCs成骨分化尚需开展深入研究。
利益冲突声明:所有作者均声明不存在利益冲突。

