中药调控NF-κB信号通路干预胃溃疡研究进展
范明明 刘烨玄 李敬孝 李显筑
胃溃疡(gastric ulcer,GU)是以反复周期性上腹部疼痛、腹胀等症状为主要表现疾病,其发病机制为胃黏膜损伤与黏膜防御之间机制失衡所致,发病因素包括幽门螺旋杆菌(helicobacter pylori,Hp)感染、非甾体类抗炎药、病毒、情绪、饮酒等,临床治疗以抑制胃酸分泌的质子泵抑制剂(proton pump inhibitors,PPI)、组胺H2受体拮抗剂(H2RA)及胃黏膜保护剂为主,此类药物的应用使病死率和发生率逐渐下降,长期使用增加胃息肉、肿瘤、低镁血症、营养不良、骨质疏松等风险。临床观察表明,中医药对于GU治疗具有良好的效果[1~3]。研究表明,氧化应激、中性粒细胞浸润是导致胃溃疡的关键因素,核因子-κB (nuclear factor-kappa B,NF-κB)是一种氧化还原敏感的转录因子,在胃溃疡损伤中起着关键作用,调节与炎症和细胞损伤相关的几个基因的表达,诱发胃黏膜炎症,与GU形成相关[4,5]。通过干预NF-κB信号通路成为中医药治疗GU研究重点,现总结既往研究,为临床用药治疗及开发提供思路。
一、NF-κB信号通路概述
NF-κB是一种由两个亚基构成二聚体,与IκB蛋白结合,掩盖了核定位信号,故位于绝大细胞胞质中,并处于非活性状态,是机体重要的转录因子,参与机体炎症、氧化应激、细胞凋亡等反应,其家族包括RELA(P65)、RELB、C-REL、NF-κB1(p50)和NF-κB2(p52)5种蛋白,可形成同源或异源二聚体,被白细胞介素(interleukin,IL)、肿瘤坏死因子(tumor necrosis factor,TNF)、活性氧(reactive oxygen species,ROS)等通过两种途径被激活,后可携带相关信息进入胞核进而调控靶基因转录。NF-κB激活途径即NF-κB信号通络,包括经典途径和非经典途径,经典途径由IKKγ和两种IκB激酶(IKK)组成的激酶复合物介导,其激活依赖于IKK激酶复合物的磷酸化,主要由促炎性细胞因子诱发,IκB蛋白被IKK磷酸化、泛素化,进而释放相关的NF-κB,NF-κB释放后转位至细胞核;非典型途径依赖于NIK、IKKα,激活信号主要为TNF受体家族成员,上游NF-κB诱导激酶(NIK)激活下游激酶IKKα,使p100磷酸化产生p52,后产生活化p52/RelB 复合物,并通过降解IκBδ,使NF-κB二聚体释放转位至细胞核。典型和非典型途径由不同的激酶和直接底物介导的,但NF-κB系统中存在大量共享成分,故两种途径中存在串扰,详见图1[6,7]。
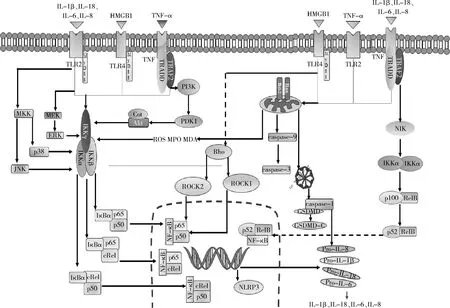
图1 NF-κB信号通路
二、NF-κB信号通路与胃溃疡
GU以胃黏膜受损为主要病理表现,涉及氧化应激、炎性反应及细胞凋亡,三者相互串扰[8]。体内氧化与抗氧化失衡,产生大量ROS,并通过脂质过氧化使胃黏膜血流减少、细胞器损伤,导致胃上皮细胞受损[9]。一方面,胃黏膜受损使NF-κB激活,活化的NF-κB上调IL-6、IL-8、TNF-α等炎性细胞因子表达,炎性细胞因子表达进一步激活NF-κB, 造成炎症扩大,损伤组织细胞等[10,11]。另一方面,ROS过度产生可损害线粒体酶、膜及DNA,线粒体功能障碍又产生大量ROS,进一步加重线粒体功能障碍[11~13]。研究证实,通过调控NF-κB信号通路可增加抗氧化酶、降低ROS水平、保护线粒体[14,15];
细胞凋亡在胃黏膜损伤中占重要作用,胃黏膜受损后,细胞凋亡迅速增加,Hp、非甾体类抗炎药等可以诱导细胞凋亡[16]。NF-κB信号通路可通过线粒体及NLRP3炎性小体介导细胞凋亡,一方面,通过抗凋亡蛋白(Bcl-2)和促凋亡蛋白(Bax)影响线粒体膜通透性,当Bax受到刺激信号后将其转导到线粒体膜,导致细胞色素c的释放并刺激caspase-9活性,后caspase-9被蛋白水解酶切割以激活caspase-3,从而启动凋亡级联效应。研究表明,八宝丹可通过抑制MAPK/NF-κB信号通路,使Bcl-2下调、Bax上调,从而减少细胞凋亡[17]。另一方面,NLRP3等蛋白被激活,产生具有活性的caspase-1,caspase-1加工IL-1β前体、IL-18前体,产生成熟形式的IL-1β和IL-18,诱发炎性反应,并裂解GSDMD蛋白触发细胞凋亡(图2)[18,19]。
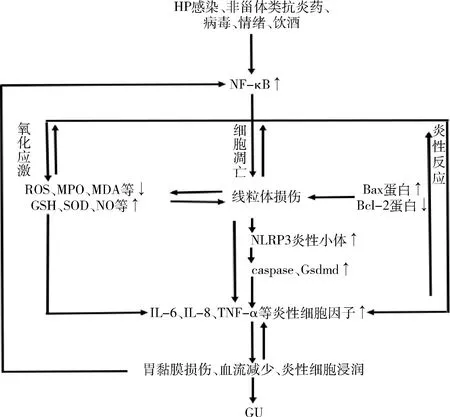
图2 NF-κB信号通路与胃溃疡
三、中药单体及有效成分
1.黄酮类化合物:研究表明,经陈皮苷治疗GU小鼠,胃组织中SOD活性增加,MDA、MPO水平降低,p-ERK/ERK、p-JNK/JNK、p-p38/p38、p-p65/p65及p-IκBα/IκBα表达水平降低,血清中IL-1β、IL-6、TNF-α降低,表明陈皮苷通过抑制MAPK/NF-κB信号通路,减少炎性及氧化反应[20]。研究证实,高良姜总黄酮(F.AOH)升高SOD、MPO活性、增加GSH水平、减少MDA含量,降低血清TNF-α、IL-6水平,增加Bcl-2蛋白和基因表达,减少Bax和caspase-3蛋白和基因表达,降低胃黏膜上皮(GES-1)细胞凋亡率,提示F.AOH可以通过阻断TLR4/MYD88/NF-κB信号通路,抑制Bcl-2/Bax/caspase-3途径蛋白和mRNA的表达,参与氧化应激、炎性反应及细胞凋亡,进而改善GU[21]。山奈素降低小鼠血清中COX-2、前列腺素E2(PGE2)、NO、TNF-α、IL-6、IL-1β,抑制一氧化氮合酶(iNOS)、COX-2、NF-κB p65蛋白,提示山奈素通过抑制NF-κB/COX-2信号,下调下游炎性细胞因子含量,抑制炎性反应,保护胃黏膜[22]。
2.多糖类化合物:研究表明,白芨多糖治疗GU大鼠,降低大鼠血清及胃组织Toll样受体-4(TLR-4)、IL-17、IL-23、NF-κB p65基因及蛋白表达水平,表明该成分通过抑制NF-κB信号通路抗炎,保护胃黏膜[23]。研究表明,人参多糖升高组织中NO、PGE2水平,增加SOD和过氧化酶(catalase,CAT)的活性,降低MDA、MPO活性,减少组织IL-6、IL-1β和TNF-α的含量,使磷酸化的NF-κB p65、非受体型酪氨酸蛋白激酶2(JAK2)及STAT3蛋白表达降低,IκBα蛋白水平升高,提示该成分通过调控NF-κB和STAT3信号通路发挥抗炎、抗氧化作用,进而改善炎性细胞浸润及黏膜下水肿,修复胃黏膜[24]。苦瓜多糖通过减少MPO、TNF-α和IL-6抑制胃部炎症,通过抑制脂质过氧化物、增强GSH和SOD活性预防胃氧化应激,通过抑制Bax和caspase-3活性,增强抗凋亡蛋白Bcl-2活性,减少胃上皮细胞凋亡率。表明MCP通过抑制NF-κB、上调IκBα降低乙醇诱导大鼠胃损伤[25]。石斛多糖(dendrobium officinale polysaccharide,DOP)预处理的小鼠,凋亡细胞数量减少,细胞核形态改变好转,Bax表达增加、Bcl-2、p-NF-κB p65、NF-κB p65表达下降,表明DOP通过抑制NF-κB抑制氧化应激诱导细胞凋亡而具有胃保护作用[26]。
3.生物碱类化合物:研究表明,苦参碱降低GU大鼠胃黏膜上皮细胞凋亡率,恢复胃黏膜上皮结构,降低胃黏膜组织TLR4、高迁移率族蛋白B1(HMGB1)、NF-κB、IL-6、COX-2、MyD88、γH2AX表达,提示苦参碱通过抑制HMGB1/TLR4/NF-κB通路,促进溃疡愈合及缓解胃黏膜损伤[27]。研究证实,吴茱萸碱预处理的乙醇诱导GU小鼠PGE2、IL-6和TNF-α表达水平下调,血清MDA含量和胃组织中MPO活性降低,GSH、SOD和CAT水平提高,并抑制小鼠Rho、ROCK1、ROCK2,下调NF-κB p65的蛋白表达,提高GES-1活性,提示吴茱萸碱可能与通过Rho/NF-κB途径改善氧化应激和炎性反应[28]。
4.萜类化合物:人参皂苷Rh4可通过阻断MAPK/NF-κB信号,提高SOD、GSH和NO水平,减少MDA、TNF-α、IL-6和IL-1β含量,介导PGE2-COX-2途径,增强Bcl-2蛋白表达,降低Bax、细胞表面死亡受体-6(Fas-6)蛋白表达,进而减轻胃损伤面积和胃组织黏膜病变百分比[29]。七叶皂苷是中药娑罗子提取物,研究表明,七叶皂苷通过抑制NF-κB活化,下调诱导性iNOS水平和NF-κB p65蛋白表达,降低小鼠TNF-α、IL-6、NO表达,进而保护胃损伤[30]。研究表明,黄芪甲苷(astragalosideⅣ,AS-Ⅳ)可下调MPO、TNF-α、肿瘤坏死因子受体2(TRAF2)、NF-κB p65表达,提示AS-Ⅳ作为抗炎剂通过调节胃组织中TNF-α/NF-κB信号通路,减轻乙醇诱导胃黏膜炎症损伤[31]。
5.酚类化合物:氧化白藜芦醇为虎杖、桑椹等提取物。研究表明,氧化白藜芦醇通过抑制NF-κB信号通路,上调三叶因子2(trefoil factor family 2,TFF-2)表达水平,下调IL-6 mRNA、COX-2表达水平,发挥抗炎、抗溃疡、免疫调节等作用[32]。覆盆子酮可提高GU大鼠GSH、谷胱甘肽过氧化酶(glutathione peroxidase,GPx)活性,下调组织中NF-κB、TNF-α水平,降低Bax/Bcl-2比值,表明其可通过抑制NF-κB的活化和TNF-α的产生抗炎、抗氧化、抗凋亡,进而减少溃疡面积,保护胃黏膜等[33]。研究表明,预防性使用芥子酸(sinapic aci,SA)可以通过抑制NF-κB信号通路,升高大鼠胃黏膜组织中PGE2、NO、GSH活性,降低TNF-α、IL-6、MPO、MDA水平,下调Bax和caspase-3水平,恢复抗凋亡蛋白Bcl-2活性,增加细胞存活率[34]。
6.其他:实验检测发现,木香可升高胃组织中SOD活性,上调溃疡组织PCNA水平,下调NF-κB、TNF-α、NO、iNOS表达水平,提示,其可通过抑制NF-κB信号通路,减少炎性反应,促进溃疡愈合[35]。研究表明,厚朴提取物可恢复SOD、GSH-Px等抗氧化物水平,降低TNF-α、IL-1β、IL-6、NF-κB浓度,提示厚朴胃保护作用归因于抑制NF-κB炎症途径,减少促炎性细胞因子的产生[36]。研究表明,中华雪胆醇提取物,能明显抑制LPS诱导的RAW264.7细胞中的NO、TNF-α、IL-1β、IL-6及VCAM-1的表达,提高RAW264.7细胞存活率,降低小鼠血清中TNF-α、IL-6、PGE2水平,使p38 MAPK、NF-κB p65蛋白磷酸化水平下降,提示中华雪胆醇通过抑制p38 MAPK/NF-κB信号通路保护胃黏膜[37]。牛蒡根(ALR-AE)剂量依赖性地降低MDA、TNF-α、IL-6和IL-1β的表达水平,升高GSH-Px、SOD水平,下调Akt、NF-κB p65、IKKα、IκBα磷酸化水平,降低p-Akt、p-NF-κB p65、p-IKKα、p-IκBα蛋白表达,提示ALR-AE通过调节Akt/NF-κB信号通路介导的炎性介质表达而减轻盐酸/乙醇(HCl/EtOH)诱导的胃组织损伤程度[38]。
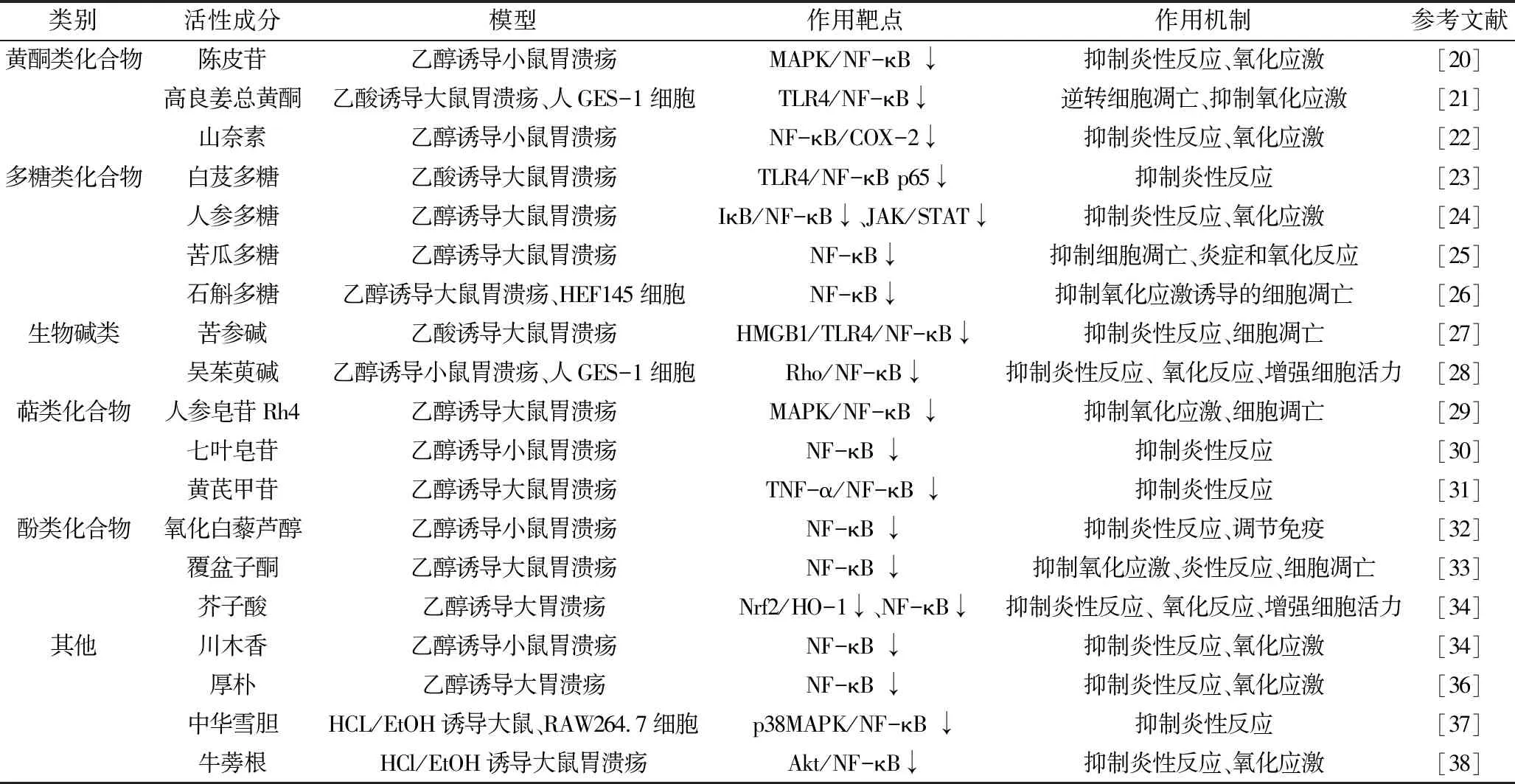
表1 中药单体调控胃溃疡相关信号通路及作用机制
四、中药复方
肝胃百合汤是湖南名老中医夏度衡治疗肝郁气滞,中焦湿热所致消化性溃疡。研究表明,肝胃百合汤治疗组NF-κB表达下降,HSP70蛋白表达增加,提示肝胃百合汤可以通过抑制NF-κB转录降低胃黏膜水肿,保护胃黏膜[39]。戊己丸肝火犯胃、肝胃不和所致胃溃疡,用戊己丸煎水灌胃治疗后,发现戊己丸减少黏膜出血点,增加黏液中酸性粘多糖含量,降低TNF-α、IL-6、MDA、COX-2、NF-κB(p65)表达水平,升高NO、IL-10、SOD、COX-1表达水平,表明戊己丸可通过下调NF-κB通路改善炎症、氧化及凋亡,从而发挥抗胃溃疡作用[40]。研究表明,黄芪建中汤(HQJZT)治疗组小鼠胃黏膜组织中TLR2、p-NF-κB蛋白表达下降、PGE2、NO含量升高,提示HQJZT通过抑制TLR2/MyD88/NF-κB信号通路调节胃黏膜炎性细胞因子水平,进而保护胃黏膜,改善胃溃疡[41]。葛花、枳椇子皆有解酒毒作用,临床研究表明,葛花、枳椇子配伍可升高乙醇诱导胃溃疡小鼠ADH活性,增加胃黏膜IκBα mRNA表达水平,降低NF-κB p65mRNA表达水平,进而降低IL-6、IL-1β、TNF-α含量,提示葛花、枳椇子配伍可以调控NF-κB信号通路,减轻乙醇对胃黏膜的炎性损伤[42]。

表2 中药复方调控胃溃疡相关信号通路及作用机制
五、展 望
胃溃疡在中医上可归为“胃脘痛”范畴,不同医家对胃脘痛证型分析及治疗侧重不同,但基本以肝胃为主,病理因素包括气滞、血瘀,热包括湿热、阴虚胃热,寒为实寒、虚寒,治疗以理气、活血、清热、滋阴、温阳散寒为主,涉及方剂包括理气为主的柴胡疏肝散、四逆散等,血瘀以丹参饮、失笑散等活血化瘀,清湿热以化肝煎、金铃子散、左金丸,连朴饮、小陷胸汤清肝胃湿热,梅国强认为肺胃痰热,也可导致胃脘痛,方以麻杏石甘汤,虚热以益胃汤、一贯煎等滋阴清热,实寒以良附丸加减,虚寒以小建中汤、理中汤、香砂六君子、黄芪建中汤等[43]。
中药对于胃溃疡抑制NF-κB信号通路,涉及因子包括NO、TNF-α、IL-1β、IL-6、SOD、MDA、Bcl-2等,通过抗炎、抗氧化、抗凋亡等机制,提高溃疡抑制率,改善黏膜组织损伤、水肿,促进胃黏膜糖蛋白再生和恢复,增加黏液中酸性黏多糖含量,进而保护胃黏膜。中成药及中药提取物的研发证明了中医的临床有效性,如柴胡疏肝散、丹参饮、半夏泻心汤可通过降低胃黏膜中TNF-α、IL-1β、IL-6的表达,抑制炎性反应、降低GES-1细胞的凋亡率治疗胃溃疡,但因成分复杂,有效成分尚不能完全确定,也未证明炎性反应是否通过NF-κB信号通路介导[44,45]。此外,炎症通路之间互相串扰,一种药物与多个信号通路相关,NF-κB信号通路是多数疾病信号通路。
诸多实验表明,药物提取物有剂量依赖性,故明确具体通路或最大相关通路,并确定药物剂量配比、研究药物联合应用的最佳组合及使用方式对于增加疗效,减少不良反应,保证药物有效性、安全性至关重要[46]。此外,本文所引用胃溃疡模型包括应激性胃溃疡、化学性胃溃疡、幽门螺杆菌感染胃溃疡等,其中乙醇诱导鼠胃溃疡多模拟乙醇所致急性胃溃疡,醋酸诱导则多模拟慢性胃溃疡,此两者模型的大鼠的出血、黏液和胃酸病理、组织形态相似;Hp诱导的鼠胃溃疡模型,对于研究Hp感染所致胃溃疡也有重要作用。
利益冲突声明:所有作者均声明不存在利益冲突。

