基于UPLC指纹图谱与抗氧化谱效关系的枸杞子质量标志物研究△
乔亚玲,宋霞,刘亚蓉,韩生兰,李永鹏,林鹏程
1.青海民族大学 药学院,青海 西宁 810007;2.青海省药品检验检测院,青海 西宁 810016;3.天津大学 理学院,天津 300072;4.国家药品监督管理局 中药(藏药)质量控制重点实验室,青海 西宁 810016;5.青海省中藏药现代化研究重点实验室,青海 西宁 810016;6.青海省青藏高原植物化学重点实验室,青海 西宁 810007
枸杞Lycium chinenseMiller.为茄科(Solanaceae)枸杞属(LyciumL.)植物,分布于我国东北、西北、西南、华南和华东各省区[1]。其干燥成熟果实为枸杞子,具有清心热、镇静的功效,主治心热病、头痛、失眠、健忘等[2],是名贵大宗中药材和功能性食品,主要含有多糖[3]、黄酮[4]、生物碱[5]等类化学成分,具有保护神经[6]、抗癌[7]、降血糖[8]、抗衰老[9]等多种药理作用。天然抗氧化剂在保健、抗炎、抗癌、保护心血管等方面发挥着重要作用[10]。目前,有关枸杞子的抗氧化作用研究主要集中于抗氧化剂含量和抗氧化能力的测定上[11-13],对枸杞子抗氧化活性的主要贡献物质缺乏统一的认识。
中药指纹图谱技术[14]具有专属性强、重现性好、稳定性好等优点,被广泛应用于中药材的产地鉴别[15]、加工[16]、质量评价[17-18]、活性研究[19]等各个环节,能够表达中药的整体特性,是一种合理的中药质量控制模式。中药成分复杂,发挥药效作用的具体成分不明确,中药谱效关系可将指纹图谱中化学成分的变化与药效相关联,筛选出有效活性成分群[20]。刘昌孝院士提出的中药质量标志物(Q-marker)新概念[21]对中药质量提升具有积极作用,其研究成果及学术影响对中医药的发展具有重大现实意义[22-24],本研究拟借助Q-marker的研究思路,依据液相色谱的指纹特性,建立枸杞子的超高效液相色谱法(UPLC)指纹图谱,同时结合聚类分析、主成分分析(PCA)、正交偏最小二乘法-判别分析(OPLS-DA)进行评价,为不同批次的枸杞子建立一致性评价方法,筛选出影响分类及质量的关键Q-marker。利用双变量相关性分析法与正交偏最小二乘法-回归分析研究指纹图谱共有峰与抗氧化活性指标的谱效关系,为阐明枸杞子抗氧化活性的Q-marker 提供参考,也为提升枸杞子的质量控制水平提供科学依据。
1 材料
1.1 样品
31 批研究样品经青海民族大学药学院林鹏程教授鉴定为茄科植物枸杞Lycium chinenseMiller.的干燥成熟果实,编号1~10 产地为青海都兰,11、13、15 产地为宁夏中宁,12、14、16 产地为宁夏银川,17~18 产地为吉林白山,19~25 产地为青海德令哈,26产地为甘肃瓜州,27~31产地为青海大柴旦。
1.2 试药
总抗氧化能力(T-AOC)检测试剂盒购自北京索莱宝生物试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)检测试剂盒、多功能氧化酶(MFO)检测试剂盒购自苏州科铭生物科技有限公司;乙腈为色谱纯;其余试剂为分析纯;水为超纯水。
1.3 仪器
Acquity 型超高效液相色谱仪、二极管阵列(PDA)检测器和Empower 工作站(美国Waters 公司);Milli-Q Advantage A10 型超纯水仪(美国密理博公司);KQ600DB 型超声波清洗器(东莞市科桥超声波设备有限公司);BSA224S-CW型万分之一电子天平(赛多利斯科学仪器有限公司);XS105DU型十万分之一电子天平(上海梅特勒-托利多有限公司);HM100型刀式研磨仪(北京格瑞德曼仪器设备有限公司);YB-IA 型真空恒温干燥箱(天津市新天光分析仪器技术有限公司);Lambda35型紫外分光光度计(美国Perkin Elmer公司)。
2 方法与结果
2.1 枸杞子乙醇提取物的制备
取经过减压恒重的药材粉末(过80 目筛)(1.000±0.001)g,精密称定,置于100 mL 锥形瓶中,精密加入无水乙醇25 mL,称定质量,超声提取(功率250 W,频率50 kHz)30 min,静置至室温后,再称定质量,用无水乙醇补足减失的质量,摇匀,经0.22 μm的微孔滤膜滤过,取续滤液,即得。
2.2 枸杞乙醇提取物UPLC指纹图谱
2.2.1 色谱条件及溶液制备 采用Waters CORTECS UPLC T3色谱柱(100 mm×2.1 mm,1.6 μm);流动相为0.05%甲酸水溶液(A)-80%乙腈水溶液(B),梯度洗脱(0~3 min,2%~10%B;3~15 min,10%~13%B;15~17 min,13%~20%B;17~20 min,20%~40%B;20~22 min,40%~80%B;22~30 min,80%~100%B);流速为0.4 mL·min-1;柱温为40 ℃;进样量为1 μL;检测波长为211 nm。
2.2.2 精密度试验 取枸杞子(编号1),按2.1 项下方法制备供试品溶液,按2.2.1 项下色谱条件连续进样6 针,记录色谱图,以峰面积占比最大、保留时间适中的峰为参照峰,计算各主要共有峰的相对保留时间和相对峰面积。各主要色谱峰相对保留时间的RSD 为0.31%~0.86%,相对峰面积的RSD为1.6%~2.7%,表明仪器精密度良好。
2.2.3 重复性试验 枸杞子(编号1)6 份,按2.1项下方法制备供试品溶液,按2.2.1 项下色谱条件进样分析。记录色谱图,以峰面积占比最大、保留时间适中的峰为参照峰,计算各主要共有峰的相对保留时间和相对峰面积。各主要色谱峰相对保留时间的RSD 为0.57%~0.83%,相对峰面积的RSD 为1.6%~2.7%,表明实验方法重复性良好。
2.2.4 稳定性试验 取枸杞子(编号1),按2.1 项下方法制备供试品溶液,按2.2.1 项下的色谱条件,分别在0、2、4、6、8、12、24 h进样分析,记录色谱图,以峰面积占比最大、保留时间适中的峰为参照峰,计算各主要共有峰的相对保留时间和相对峰面积。各主要色谱峰相对保留时间的RSD 为0.53%~1.6%,相对峰面积的RSD 为1.4%~2.8%,表明供试品溶液在24 h内稳定性良好。
2.2.5 指纹图谱的建立 31 批研究样品,分别按2.1 项下方法制备供试品溶液,按2.2.1 项下色谱条件进行检测,记录色谱图。根据实验结果,采用Chempattern 2017 化学计量学软件进行数据分析处理,生成枸杞子共有模式的对照指纹图谱(图1),共有峰34个,指纹图谱叠加图见图2。

图1 31批枸杞子的UPLC对照指纹图谱
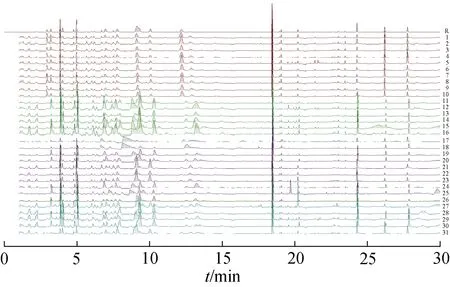
图2 31批枸杞子的UPLC指纹图谱叠加图
2.2.6 指纹图谱相似度评价 采用Chempattern 化学计量学软件对31 批样品的指纹图谱进行相似度计算,结果见表1。31 批样品的相似度为0.96~0.48,青海都兰县样品的相似度为0.91~0.83,青海德令哈样品的相似度为0.96~0.85,青海大柴旦样品的相似度为0.85~0.78,宁夏样品的相似度为0.87~0.68,可见不同地区枸杞有相对较好的相似度,但内在质量存在差异。这表明指纹图谱的相似度能够反映各样品间的差异。
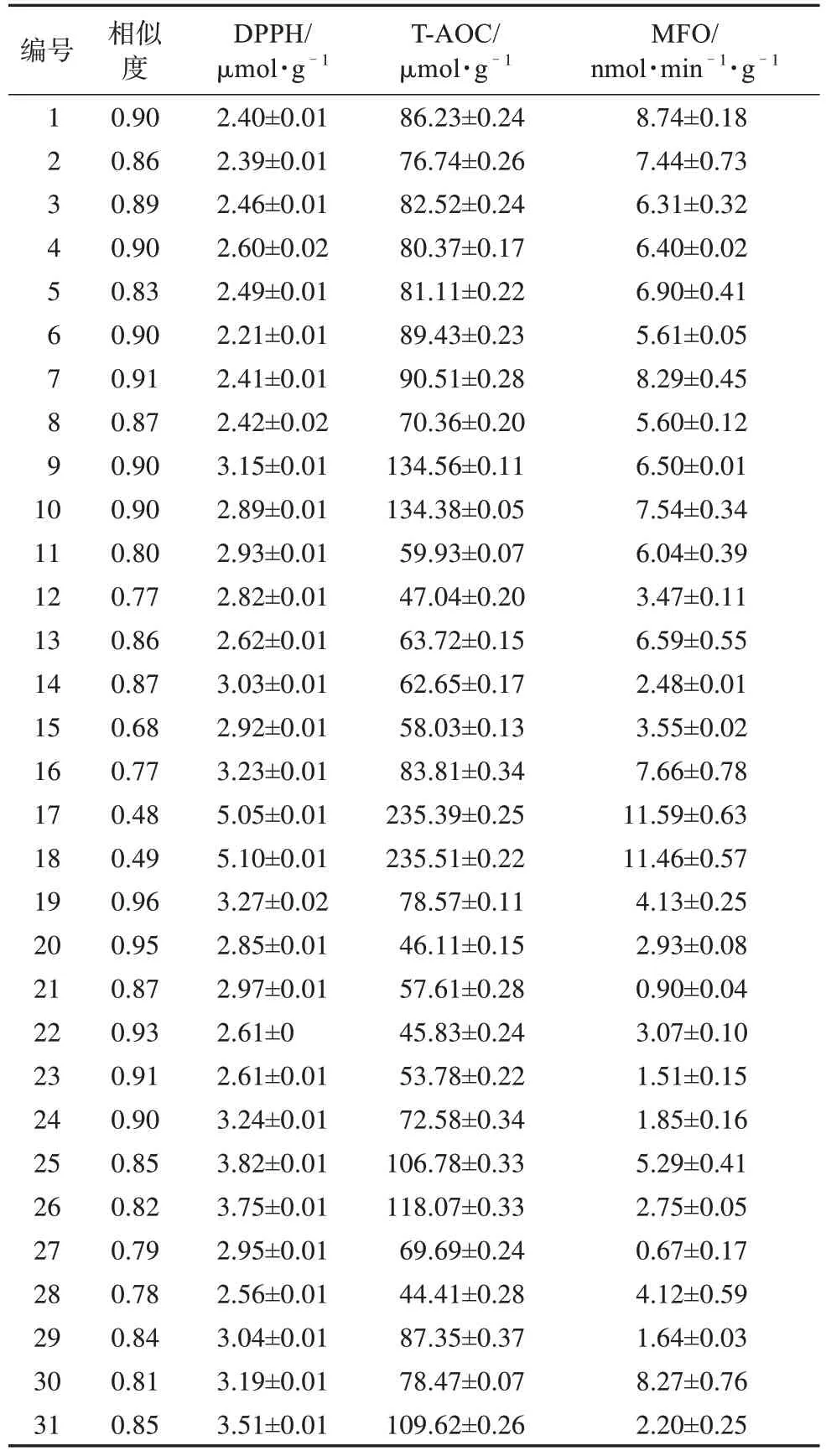
表1 31批枸杞子的样品信息、相似度及活性指标
2.3 化学计量学分析
2.3.1 聚类分析 将31 批枸杞子指纹图谱中的34个共有峰的峰面积导入Chempattern 化学计量学软件,经中心化预处理后进行聚类分析,采用加权平均距离法作为聚类模型识别方法,以欧氏距离对样品进行聚类分析,结果见图3。31 批枸杞子样品可分为3类:第1类为1~16、19~25、27~31,第2类为17、18,第3 类为26 号。枸杞子产地为宁夏与青海的聚为一类,产地为吉林、甘肃的各聚为一类,聚为一类的样品之间有较好的相似性,与相似度评价结果较为一致。
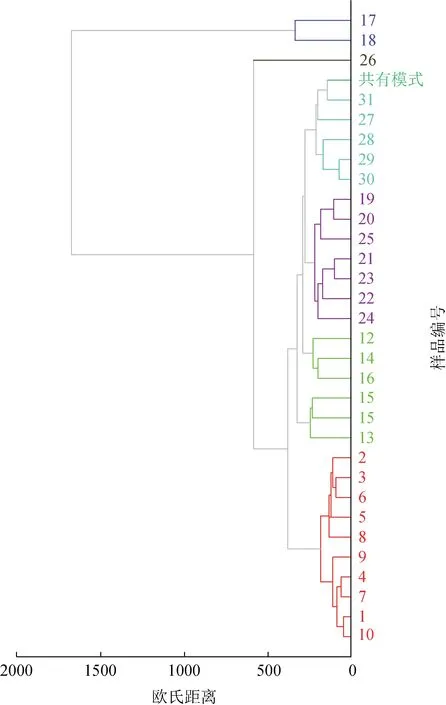
图3 31批枸杞子样品的聚类分析图
2.3.2 PCA 本研究采用Chempattern 化学计量学软件对31批样品的34个共有峰峰面积数据进行中心化处理,进行PCA。PCA 结果见图4,结果表明PCA 与聚类分析基本一致。在载荷散点图(图5)中,每1个点代表1个共有峰,其在坐标系中距离原点(0,0,0)距离的远近表明该成分对样品分类的贡献大小。其中,15、17、19、23 号色谱峰的化合物在色谱系中离坐标原点的距离较远,表明这4 个成分对样品整体分类起关键作用,可作为影响枸杞子分类与质量的关键Q-marker。

图4 31批枸杞子样品PCA得分图
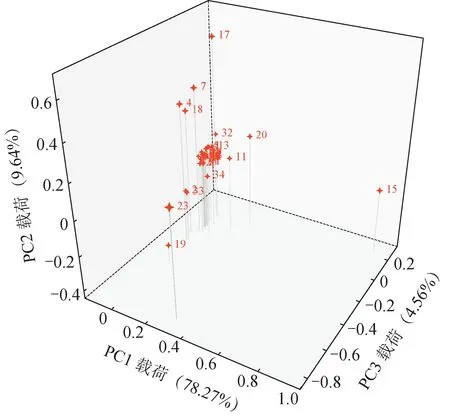
图5 31批枸杞子样品PCA载荷图
2.3.3 OPLS-DA 为了进一步寻找上述枸杞子之间的主要差异性标志物,采用OPLS-DA 对枸杞子样品进行分析。将31批枸杞子的34个共有峰的峰面积经中心化后导入Chempattern 化学计量学软件,获得相应模型,结果见图6、图7。由OPLS-DA 得分图可知,结果与PCA 分析一致,根据模型中变量投影重要性投影(VIP)预测值来筛选出具有统计学意义的差异标志物,在0.95的置信区间内,选出VIP值>1的色谱峰为差异性标志物,2、7、17、19、33 号色谱峰的化合物的VIP 值分别为1.42、1.42、1.38、3.27、1.06,均大于1,可作为鉴别和区分枸杞子的Q-marker。
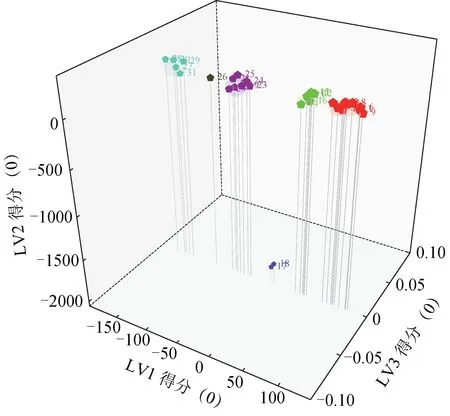
图6 31批枸杞子样品OPLS-DA得分图
2.4 枸杞子乙醇提取物的抗氧化作用
2.4.1 DPPH 测定 按照DPPH 试剂盒说明书进行测定,设置空白管和测定管,空白管加入无水乙醇50 μL,测定管加入样品50 μL,均加入试剂一950 μL,涡旋混匀,室温避光反应20 min,于1 mL 玻璃比色皿测定515 nm 处的吸光度(A)。用从标准曲线上获得的抗氧化剂Trolox 的量来表示样品的DPPH 自由基清除能力(μmol·g-1)。按公式(1)以样本质量折算其DPPH自由基清除能力(μmol·g-1)。
式中,ΔA表示空白管与测定管A的差值;V样总表示加入提取液体积,此处为25 mL;W表示样品质量。每个实验平行3 次,结果用()表示,31批枸杞子样品DPPH 值不同,最小值为(2.21±0.01)μmol·g-1,最大值为(5.10±0.01)μmol·g-1,各样品测定结果见表1。
2.4.2 T-AOC测定 按照T-AOC试剂盒说明,先配制梯度浓度为2.00、0.10、0.05、0.025、0.012 5、0.006 25、0.003 125 μmol·mL-1的FeSO4标准品溶液,以纯水作为空白,测定样品在593 nm 下的A。根据Fe2+终浓度为横坐标(X),以ΔA标准(ΔA标准=A标准-A空白)为纵坐标(Y)绘制标准曲线,得到线性回归方程Y=1.942 5X+0.034 8(r=0.999 9),将ΔA测定(ΔA测定=A测定-A空白)代入方程求得X(μmol·mL-1)。样品的T-AOC(μmol·g-1)按公式(2)以样本质量折算。
式中,V样总为25 mL;V反总为1.02 mL;V样为0.03 mL。每个实验平行3 次,结果用()表示,31 批枸杞子样品T-AOC 不同,最小值为(90.51±0.28)μmol·g-1,最大值为(235.51±0.22)μmol·g-1,各样品测定结果见表1。
2.4.3 MFO 测定 按照MFO 试剂盒说明书进行测定,设置空白管和测定管,空白管加入试剂一500 μL、试剂二100 μL、无水乙醇900 μL,测定管加入试剂一500 μL、试剂二100 μL、无水乙醇400 μL与样品500 μL,涡旋混匀,37 ℃水浴反应30 min,空白管与测定管再分别加入试剂三500 μL与三氯甲烷2.5 mL,充分混匀萃取,静置10 min,取下层溶液1.5 mL 至新的离心管中。再分别加入试剂四1.5 mL,充分混匀萃取,取上层溶液1 mL 置于1 mL 的玻璃比色皿中,测定A400nm与A空白。每克样品每分钟产生1 nmol对硝基苯酚定义为1 个酶活力单位。样品的MFO(nmol·min-1·g-1)按公式(3)以样本质量折算.
式中,ΔA表示测定管与空白管吸光度值的差值;V总表示最终萃取液体积,1.5 mL;V样表示反应中样品体积,500 μL;V样总表示加入提取液体积,25 mL;T表示反应时间,30 min;W表示样品质量。每个实验平行3次,结果用()表示,31批枸杞子样品MFO不同,最小值为(0.67±0.17)nmol·min-1·g-1,最大值为(11.59±0.63)nmol·min-1·g-1,各样品测定结果见表1。
2.5 乙醇提取物UPLC指纹图谱药效相关性分析
2.5.1 双变量相关性分析 采用SPSS 26.0 软件,以34 个共有峰的峰面积为自变量(X),以MFO、DPPH 与T-AOC 的测定值为因变量(Y)进行双变量相关性分析,计算共有峰峰面积与MFO、DPPH 和T-AOC 测定值的Pearson 相关系数,结果峰1、5、7、8、11、13、15、20~25、27、29、31、32、33、34 的峰面积与MFO、DPPH 和T-AOC 的测定值显著相关(P<0.05)或极显著相关(P<0.01),其中峰1、5、7、27 呈负相关,峰8、11、13、15、20~25、29、31~33、34 呈正相关,峰8、11、15、20、23、34 的峰面积与MFO、DPPH 和T-AOC 的测定值极显著相关,此类化合物为枸杞子抗氧化活性的主要Qmarker,见表2。
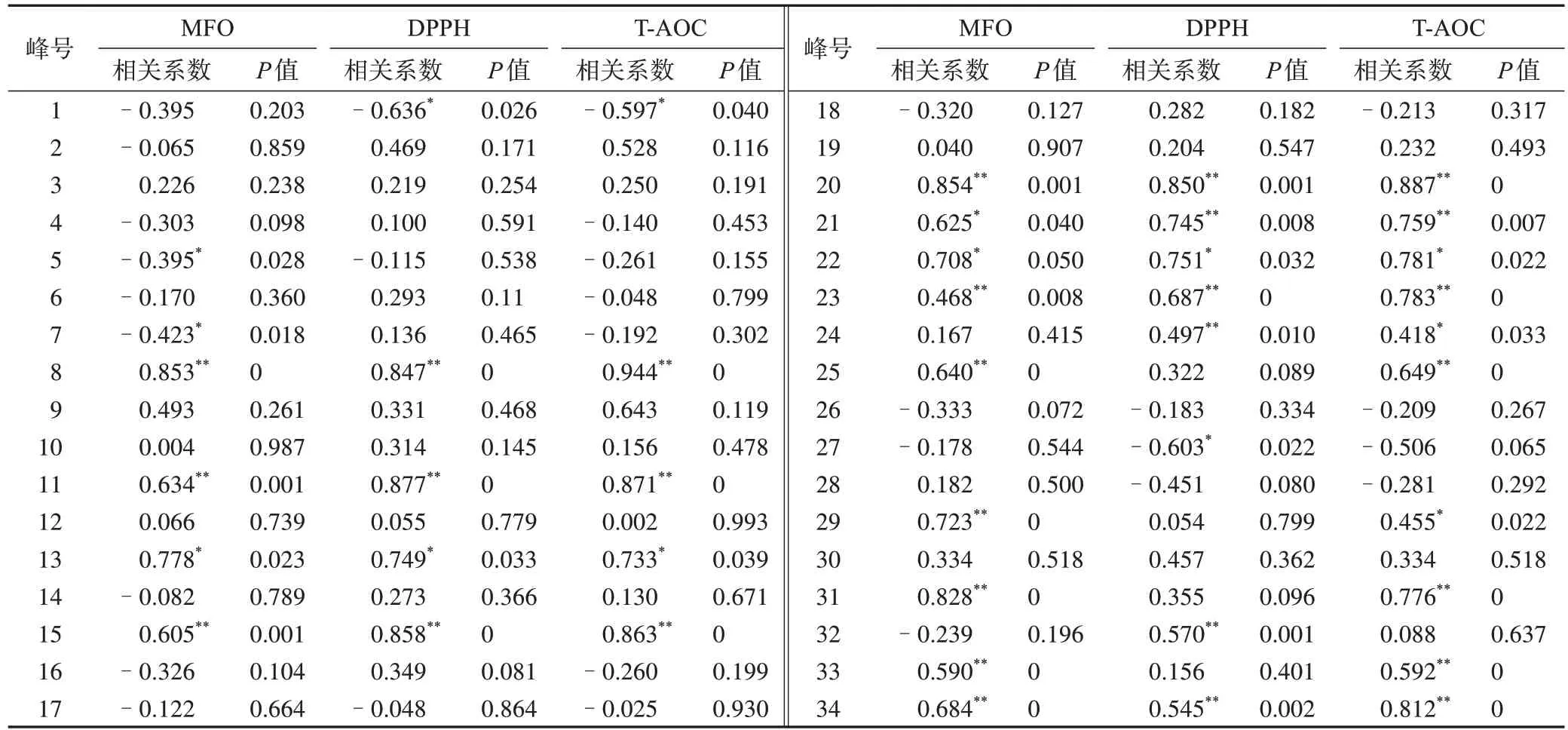
表2 31批枸杞子指纹图谱共有峰峰面积与MFO、DPPH、T-AOC测定值的双变量相关性分析结果
2.5.2 正交偏最小二乘法-回归分析 以34 个共有峰的峰面积为自变量,以不同批次枸杞子样品的DPPH、T-AOC 和MFO 的测定值为因变量,导入SIMCA 11.5 作模型拟合,计算回归系数和VIP 值,评价枸杞子样品与抗氧化活性的谱效关系。结果显示,31 批枸杞子乙醇提取物UPLC 指纹图谱中的峰3、11、12、15、23~25、28、29、31、33、34 的峰面积与MFO 测定值呈正相关(图8A),峰3、4、6、7、10、11、15、16、18、23~25、31、32、34 的峰面积与DPPH 测定值呈正相关(图8B),峰3、10、11、15、23~25、29、31~34 的峰面积与T-AOC 测定值呈正相关(图8C),提示相应成分是枸杞子乙醇提取物抗氧化作用的物质基础,是发挥抗氧化能力的Q-marker。由VIP 分析结果可知,与MFO 测定值正相关的色谱峰中,峰31、34、29、33、15、25、11、16、23、7 的VIP 值均>1,其中,31 号峰的VIP最大(图8D)。与DPPH 测定值正相关的色谱峰中,峰15、11、23、16、32、34、18、24 的VIP 均>1,其中,15 号峰的VIP 值最大(图8E)。与T-AOC 测定值正相关的色谱峰中,峰15、34、23、11、31、25、33的VIP值均大于1,其中,15号峰的VIP值最大(图8F)。因此,发挥抗氧化能力的主要Qmarker是11、15、23、29、31、34号峰的化合物。
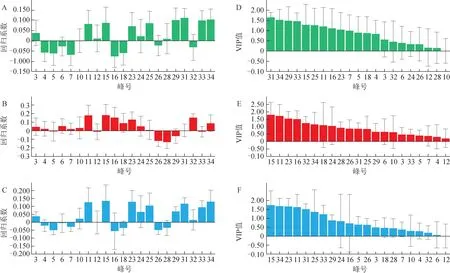
图8 31批枸杞子样品的正交偏最小二乘法-回归分析回归系数与VIP值(,n=3)
3 讨论
关于枸杞子水提取物富含糖类成分,已有深入研究与广泛应用,其乙醇提取物可提高枸杞子的综合利用价值,且提取溶液利于储存,色谱图信息丰富,便于挖掘影响质量和活性的Q-marker,故选择乙醇提取物为研究对象。本研究建立了枸杞子的UPLC 指纹图谱,共标定了34 个共有峰,31 批样品的相似度为0.96~0.48,产地为吉林的样品与其他样品区别明显,青海、甘肃、宁夏的样品较为一致,表明指纹图谱的相似度能够反映枸杞子内在质量的差异,为评价枸杞子质量的一致性与差异性提供了参考。采用聚类分析、PCA、OPLS-DA 的化学计量学方法对枸杞子整体质量进行控制。聚类分析将研究样品聚为三大类,可用来区分不同产地的枸杞子。PCA 得到共有峰15、17、19、23 的化合物是影响枸杞子分类的主要Q-marker。OPLS-DA 显示共有峰2、7、17、19、33 的化合物可作为鉴别和区分枸杞子的主要Q-marker。
本研究采用双变量相关性分析和正交偏最小二乘法-回归分析将枸杞子乙醇提取物的指纹图谱共有峰峰面积与DPPH、T-AOC、MFO 的测定值相关联,双变量相关性分析表明峰8、11、15、20、23、34的化合物与MFO、DPPH、T-AOC 的测定值极显著相关,OPLS-DA 表明峰11、15、23、25、31、33、34 的化合物是影响活性的主要Q-marker。研究结果可为枸杞子Q-marker 的筛选及质量控制提供参考,同时为枸杞子的资源开发利用提供实验支撑与理论依据。后续将对各共有峰的化学成分进行分离、鉴定,尤其是影响质量和具有抗氧化活性的主要Qmarker 进行结构鉴定,并对筛选出的Q-marker 进行进一步的等效性验证。
[利益冲突]本文不存在任何利益冲突。

