基于血清CA50、TSGF、TPA的中晚期乳腺癌放化疗敏感性列线图预测模型的建立与评价
陈国华,张浩宇,韩升波,何建鑫
(郑州市中医院检验科,郑州 450000)
乳腺癌是全球范围常见的女性肿瘤,最新数据显示,2020年新发乳腺癌226万例,这也是全球女性癌症死亡的主要原因[1]。乳腺癌早期无特异症状,临床症状明显时患者多处于中晚期,此时已错过最佳治疗时期,只能采用综合治疗。放化疗是治疗中晚期乳腺癌的首选方法,可提高患者生存期,降低组织转移和复发风险,但部分患者对放化疗不敏感,导致治疗效果不佳[2]。近年来研究[3-4]发现,血清糖类抗原50(carbohydrate antigen 50,CA50)、肿瘤特异性生长因子(tumor specific growth factor,TSGF)、组织多肽抗原(tissue polypeptide antigen,TPA)等肿瘤标志物可用于乳腺癌等肿瘤的早期诊断、预后评估、疾病转归等,但关于在中晚期乳腺癌患者中CA50、TSGF、TPA联合应用的临床研究少见。因此,本研究分析了中晚期乳腺癌放化疗不敏感和敏感患者中血清CA50、TSGF、TPA的表达情况,构建列线图预测模型,并对该模型进行验证与评价。
1 材料与方法
1.1 研究对象
选取2020年10月至2022年10月我院收治的82例中晚期乳腺癌患者,年龄42~72岁,平均(56.65±5.21)岁;体质量指数(body mass index,BMI)18.7~25.4 kg/m2,平均(21.43±1.34)kg/m2;月经状态:绝经期52例,非绝经期30例;病理类型:导管内原位癌61例,浸润性导管癌4例,浸润性小叶癌17例。
纳入标准:符合《中国抗癌协会乳腺癌诊治指南与规范(2017年版)》[5]诊断标准,经病理检查确诊;为中晚期乳腺癌;预计生存期≥3个月;入组前3个月内未接受过放化疗等治疗。排除标准:妊娠期或哺乳期女性;患有其他恶性肿瘤;患有急慢性感染性疾病,如艾滋病、麻疹、病毒性肝炎等;患有自身免疫性疾病、内分泌疾病、血液系统疾病;严重心肝肾等器官功能障碍;意识或语言障碍;凝血功能障碍。本研究获得我院伦理委员会批准(批号:20200510005)。
1.2 治疗方法
化疗方法:135 mg/m2紫杉醇(美国Bristol-Myers Squibb公司,国药准字HJ20171227,规格5 mL:30 mg)静脉滴注1次。放疗方法:胸壁和锁骨区域用6和9 MV电子线照射,照射16次后,在胸壁处加盖0.5 cm组织等效膜,2 Gy/次,1次/d,5次/周,总量50 Gy。21 d为1个疗程,持续2个疗程。
根据实体瘤疗效评价标准[6],将82例患者分为敏感组(n=57)和不敏感组(n=25)。
1.3 观察指标
1.3.1 一般资料:包括年龄、肿瘤直径、BMI、月经状态(绝经、未绝经)、脉管侵犯(有、无)、TNM分期(Ⅲa期、Ⅲb期、Ⅳ期)、淋巴结转移(有、无)、淋巴结转移数量、孕激素受体(阳性、阴性)、雌激素受体(阳性、阴性)、病理类型(导管内原位癌、浸润性导管癌、浸润性小叶癌)、分化程度(中分化、低分化)、肿瘤位置(外侧象限、中央或内侧象限)。
1.3.2 治疗前后血清CA50、TSGF、TPA表达水平:取2组患者治疗前后静脉血5 mL,1000g离心10 min,收集上清液,采用化学发光法检测CA50、TSGF、TPA水平,试剂盒购自上海雅吉生物。
1.4 统计学分析
采用SPSS 25.0软件处理数据。计数资料用率(%)表示,采用χ2检验进行比较。计量资料行Shapiro-Wilk正态性检验和Levene法方差齐性检验,方差齐性且近似服从呈正态分布的计量资料以±s表示,采用t检验进行比较。采用LASSO回归、logistic回归分析中晚期乳腺癌放化疗敏感性的影响因素,运用R语言rms包构建列线图模型,采用校准曲线、受试者操作特征(receiver operating characteristic,ROC)曲线、决策曲线评估列线图模型的预测效能和临床效用。双侧P<0.05为差异有统计学意义。
2 结果
2.1 2组一般资料的比较
2组比较,肿瘤直径、脉管侵犯、TNM分期、淋巴结转移、分化程度的差异有统计学意义(P<0.05),年龄、月经状态、BMI、淋巴结转移数量、孕激素受体、雌激素受体、病理类型、肿瘤位置的差异无统计学意义(P>0.05)。见表1。

表1 2组一般资料的比较Tab.1 Comparison of general information between the two groups
2.2 2组治疗前后血清CA50、TSGF、TPA表达水平的比较
治疗前2组比较,血清CA50、TSGF、TPA表达水平的差异无统计学意义(P>0.05);治疗后不敏感组血清CA50、TSGF、TPA表达水平高于敏感组,三者差值低于敏感组(P<0.05)。见表2。
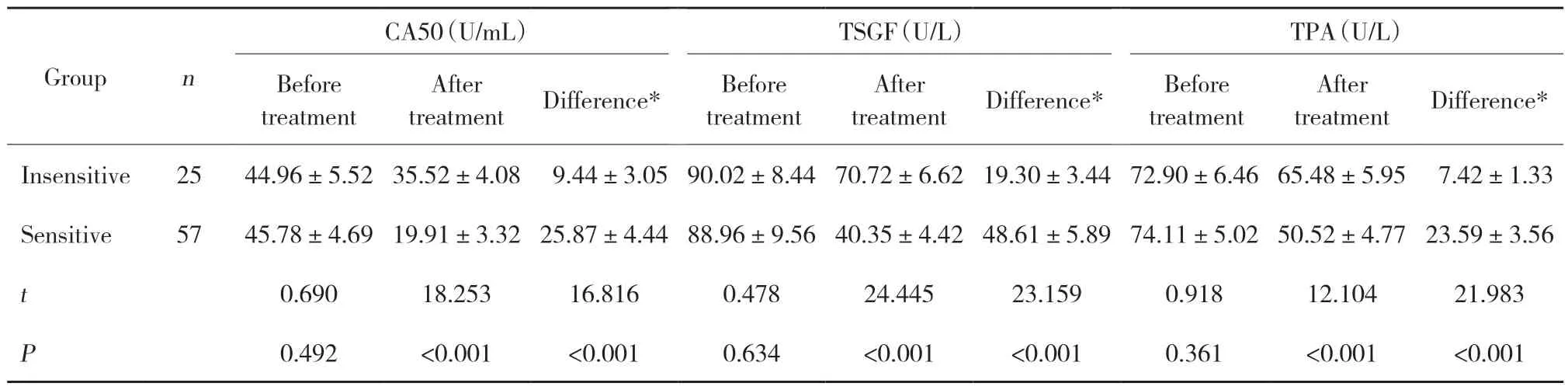
表2 2组治疗前后血清CA50、TSGF、TPA表达水平的比较Tab.2 Comparison of serum levels of CA50,TSGF,and TPA before and after treatment in the two groups
2.3 预测因素初筛
应用R语言glmnet程序包,以中晚期乳腺癌放化疗敏感性(不敏感=1,敏感=0)为因变量,肿瘤直径(实测值)、脉管侵犯(有=1,无=0)、TNM分期(Ⅲa期=1,Ⅲb期=2,Ⅳ期=3)、淋巴结转移(有=1,无=0)、分化程度(低分化=1,中分化=2)、治疗后血清CA50、TSGF、TPA表达水平及差值(实测值)纳入LASSO回归分析。随着惩罚系数λ变化,模型初始纳入影响因素系数被压缩,达到最佳影响因素选择的效果图(图1)。采用交叉验证法绘制均方误差随lgλ的变化图(图2),寻找到可使模型性能优良且影响因素最少的最佳惩罚系数λ,即图中虚线对应的λ=3。依据此λ值,选出3个预测变量,分别为TSGF差值、CA50差值、TPA差值。
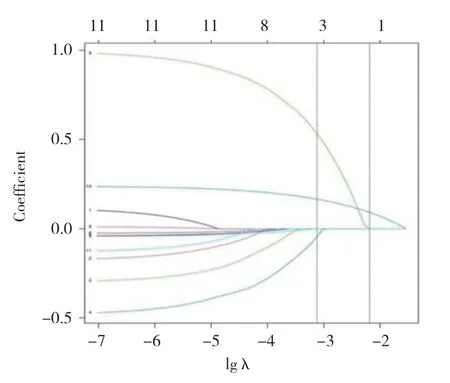
图1 LASSO回归筛选变量动态过程图Fig.1 Dynamic graph of screening variable using LASSO regression
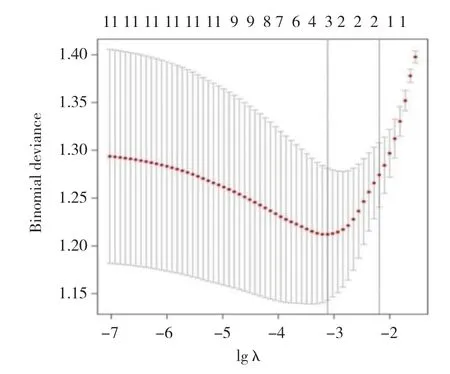
图2 交叉验证最佳参数λ的选择过程图Fig.2 Selection process of the optimal parameter λ for crossvalidation
2.4 中晚期乳腺癌放化疗敏感性影响因素的多因素logistic回归分析
以中晚期乳腺癌放化疗敏感性(不敏感=1,敏感=0)为因变量,以LASSO回归筛选指标作为自变量,纳入多因素logistic回归分析,结果显示,CA50、TSGF、TPA差值是中晚期乳腺癌放化疗敏感性的影响因素(P<0.05),见表3。
2.5 列线图模型的构建
基于多因素logistic回归分析结果(CA50、TSGF、TPA差值),运用R语言rms包构建中晚期乳腺癌放化疗敏感性列线图模型。见图3。

图3 中晚期乳腺癌放化疗敏感性列线图模型Fig.3 Nomogram model for predicting sensitivity to radiochemotherapy in middle- and advanced-stage breast cancers
2.6 列线图模型的验证与评价
采用Hosmer-Lemeshow检验检测列线图模型拟合度,结果显示,该列线图预测模型具有良好拟合度(P=0.482)。采用Bootstrap自抽样法及计算预测模型区分度(C-index),展开内部验证,结果显示,该列线图模型C-index为0.839,校准曲线趋向于理想曲线,见图4A。ROC曲线显示,列线图模型的AUC为0.839(95%CI:0.814~0.871),灵敏度和特异度分别为80.00%和75.74%,说明基于CA50、TSGF、TPA差值构建的列线图模型具有良好的预测精准度,见图4B。决策曲线显示,在0.1~1.0范围内,该列线图模型预测净获益值较高,说明该列线图模型临床预测效能良好,见图4C。

A,calibration curve;B,ROC curve;C,decision curve.图4 中晚期乳腺癌放化疗敏感性列线图模型的校准曲线、ROC曲线和决策曲线Fig.4 Calibration,ROC,and decision curves of the nomogram model for predicting sensitivity to radiochemotherapy in middle- and advanced-stage breast cancer
3 讨论
研究[7]显示,中晚期乳腺癌患者采取同步放化疗治疗,可提高临床缓解率,缩小肿瘤体积,并改善生活质量和免疫功能。但部分患者未获得临床缓解,导致预后不佳,还易出现复发、转移等。因此,寻找一些特异度和灵敏度高的无创分子标志物,对预测中晚期乳腺癌患者放化疗敏感性具有重要作用。
肿瘤标志物主要以激素、抗原、酶等形式存在于肿瘤细胞和宿主体液中,可准确反映肿瘤细胞的生化性质和代谢情况,临床主要用于鉴别良恶性肿瘤、筛选肿瘤高危人群、判断肿瘤进展、评估肿瘤预后等[8]。血清肿瘤标志物检测是一种非介入性检查措施,操作简单、检测快捷。目前临床发现,血清CA153、癌胚抗原、CA125等在乳腺癌患者组织和血清中差异表达,且与远处转移、分化程度、血管形成等密切相关,可用于乳腺癌的早期诊断、预后评估等[9-10]。CA50、TSGF、TPA是临床常见肿瘤标志物。CA50是一种非特异性肿瘤抗原,与癌抗原19-9具有交叉性。CA50在人正常组织中含量较低,细胞癌变后可激活糖基化酶,引起细胞膜表层糖基结构改变,导致大量CA50进入血液或组织中[11]。已有研究[12]显示,CA50在多种恶性肿瘤中高表达,肿瘤分期越高、分化程度越低、直径越小,CA50阳性率越高。TSGF是国际公认的与恶性肿瘤有关的广谱肿瘤标志物,是由多种小分子代谢产物、氨基酸和糖类物质形成的一种多肽因子,TSGF分泌增多可刺激恶性肿瘤细胞新血管形成,促进肿瘤恶性生长分化、转移和毛细血管增生;TSGF在多种肿瘤中表达升高,具有较高灵敏度和特异度,可用于良恶性肿瘤鉴别、预后评估等[13]。TPA是一种与角蛋白8、18、19有关的一种多肽物质,主要在多种恶性肿瘤组织和胎盘组织中表达;研究[14]发现,TPA水平升高与恶性肿瘤直径、分化程度、浸润程度等有关。本研究发现,治疗后不敏感组血清CA50、TSGF、TPA表达水平高于敏感组,CA50、TSGF、TPA差值低于敏感组,提示血清CA50、TSGF、TPA表达水平与中晚期乳腺癌患者放化疗敏感性有关。笔者推测:患者肿瘤直径越大、脉管发生侵犯、TNM分期越高、淋巴结发生转移可促进肿瘤细胞恶性生长,进而促进新血管形成;放化疗治疗后,约30.49%的患者不敏感,影响治疗效果,故不敏感组患者治疗前后血清CA50、TSGF、TPA差值变化较小。
本研究使用LASSO回归筛选的有统计学差异的11个变量,发现最佳惩罚系数λ=3,筛选出3个预测变量为治疗前后TSGF、CA50、TPA差值。logistic回归也证实三者差值是中晚期乳腺癌放化疗敏感性的影响因素,进一步说明血清CA50、TSGF、TPA与中晚期乳腺癌放化疗敏感性有关。根据logistic回归结果构建中晚期乳腺癌放化疗敏感性列线图模型,提示三者差值越小,中晚期乳腺癌放化疗不敏感风险越高。采用C-index对该模型进行内部验证,发现C-index为0.839,具有较高的准确度,且校准曲线趋向于理想曲线;ROC曲线和决策曲线显示,该模型具有良好的预测精准度和临床预测效能。
综上所述,在中晚期乳腺癌放化疗不敏感患者中血清CA50、TSGF、TPA表达水平较高,且血清CA50、TSGF、TPA差值是患者放化疗敏感性的影响因素,基于以上因素构建的列线图预测模型,具有较好的参考价值和临床适用性。

