高糖环境下肝细胞外泌体对胰腺癌细胞迁移与侵袭能力的影响
杨昊长,许永宁,廖嘉华,杨馨玥,秦雯
(1.广西医科大学基础医学院 病理生理学教研室,广西 南宁 530021;2.广西医科大学附属武鸣医院 病理科,广西 南宁 530199;3.广西医科大学第二附属医院 病理科,广西 南宁 530005)
胰腺癌是全球预后最差的恶性肿瘤之一,其5 年生存率<10%且特别容易发生肝转移[1-2]。研究表明一些非肿瘤细胞(如巨噬细胞[3]、成纤维细胞[4-6]、骨髓间充质干细胞[7]、脂肪肝细胞[8])在肿瘤的转移中起着关键作用,并且受到肿瘤微环境(如缺氧微环境、免疫微环境[8]、高糖微环境[9-10]等)的影响和调控。如在胰腺癌中,高糖微环境被证明可以驱动表皮生长因子(epidermal growth factor,EGF)诱导的胰腺癌侵袭和迁移[11]。笔者前期研究[12]也发现高血糖可能通过增强肿瘤的侵袭和迁移能力而参与胰腺癌的恶性进展。肝脏既是胰腺癌转移的高发器官[13],也是糖代谢的重要器官[14],因此笔者推测在高糖微环境下肝细胞可能参与了胰腺癌的侵袭和转移。外泌体是几乎所有活细胞都可以分泌的纳米级细胞囊泡,也是大多数生物体液中最小的胞外囊泡,其内含有的蛋白质、脂质、DNA 和RNA 可以调节受体细胞的功能,是细胞交流的关键媒介之一,它们在细胞信号传导[15]、免疫应答[16]、肿瘤转移[17],后者如上皮-间充质转 化(epithelia-mesenchymal transition,EMT)[18]等方面起着重要的作用。最新的研究[3]还认为外泌体是串联癌细胞和肿瘤微环境之间的新兴介质,既可以在肿瘤微环境中产生,也可以改变肿瘤微环境。因此,本研究进一步探讨在高糖微环境下,肝细胞分泌的外泌体是否作为细胞间交流的媒介促进了胰腺癌的侵袭和迁移,为深入阐明胰腺癌侵袭、转移的分子机制奠定基础,也为胰腺癌肝转移的预防和治疗提供新的思路和方向。
1 材料与方法
1.1 实验材料
人永生化肝细胞MIHA(广西医科大学免疫学王启辉教授赠送),胰腺癌细胞PANC-1(中国科学院典型培养物保藏委员会细胞库)。DMEM(Dulbecco's modified eagle medium,DMEM)高糖培养基(美国Gibco 公司,C11995500BT),DMEM 正常糖培养基(美国Gibco 公司,C11885500BT),胎牛血清(中国太仓依科赛公司,FSP500),青链霉素(中国北京Solarbio 公司,P1400),胰蛋白酶(中国北京Solarbio 公司,T1320)、超高速离心管(美国Beckman Coulter 公司,355631),PKH67 试剂盒(美国Sigma 公司,MINI67),DAPI(中国北京Bioshap 生物科技公司,BL105A),BCA 试剂盒(中国上海碧云天生物技术有限公司,P0010S),0.1% 结晶紫溶液(中国北京Solarbio 公司,G1063),4%多聚甲醛(中国北京Bioshap 生物科技公司,BL539A),10%PAGE 凝胶快速制备试剂盒(中国上海雅酶生物医药科技公司,PG112),6、24、96 孔板、Transwell 小室(美国Corning 公司,3516、3524、3599、3422),一抗:CD9、CD63 和GAPDH(中国武汉三鹰公司,60232-1-lg、67605-1-lg、60004-1-lg),E-cadherin、N-cadherin(美国Abcam公司,ab1416、ab18203),荧光二抗:鼠抗兔抗(美国Invitrogen 公司,SA5-35521、SA5-35571)。
1.2 方法
1.2.1 细胞培养取等量的人永生化肝细胞MIHA分别用含10%无外泌体胎牛血清、1%青链霉素双抗的DMEM 高糖或正常糖培养基,胰腺癌细胞PANC-1 使用含10% 胎牛血清、1% 青链霉素的DMEM 高糖培养基,所有细胞都置于37 ℃、5% CO2培养箱中正常传代培养。
1.2.2 外泌体的提取和鉴定MIHA 细胞生长稳定融合度达80%时更换为10%无外泌体胎牛血清的培养基继续培养48 h。收集细胞上清液于离心管中,分别经过2 000 g 30 min、10 000 g 30 min、120 000 g 1.5 h、120 000 g 1.5 h 离心,全程保证离心机温度在4 ℃,使用100 μL PBS 重悬将超高速离心管底部外泌体转移至无菌EP 管中,进行透射电镜观察;使用NanoFCM 粒径分析仪检测外泌体的粒径;用RIPA 裂解缓冲液裂解外泌体,再用Westrn blot 法检测提取物中外泌体标志蛋白CD9 和CD63 的表达。
1.2.3 实时激光扫描共聚焦显微镜示踪外泌体的摄取使用亲脂性染料PKH67 对人永生化肝细胞MIHA 来源的外泌体进行标记,能够强而稳定地发出绿色荧光且不使邻近细胞染色,因此能显示肝细胞MIHA 产生的外泌体和胰腺癌细胞PANC-1 在共孵育过程中外泌体的移动。使用细胞核染料DAPI 可使胰腺癌细胞PANC-1 的细胞核呈现蓝色荧光,使其得到定位并以此来观察胰腺癌细胞PANC-1对人永生化肝细胞MIHA 来源的外泌体的摄取。本实验使用共聚焦皿种板,每皿5 000 个细胞;分别取上述高糖和正常糖培养基中分离得到的两种外泌体进行如下实验:100 μL 外泌体溶液重悬于0.5 mL Diluent C 中吹打混匀,避光环境下将4 μL PKH67 添加到0.5 mL Diluent C 中,将两者混匀,避光孵育4 min;加入等量的无外泌体胎牛血清终止染色1 min;室温400 g 离心10 min,弃上清,更换新的离心管,洗涤离心2 次从而去除未结合的染料,使用200 μL PBS 重悬后得到PKH67 标记的外泌体溶液,加入共聚焦皿中37 ℃避光与胰腺癌细胞PANC-1 共培养8 h;吸去上清,PBS 洗涤1 次,加入1 mL 多聚甲醛避光孵育10 min;吸去多聚甲醛PBS 清洗1 次,加入DAPI 染核,避光孵育5 min后PBS 清洗3 次。最后,分别置于激光共聚焦显微镜下观察HG 组和NG 组胰腺癌细胞PANC-1 对肝细胞MIHA 来源的外泌体的吞噬。
1.2.4 划痕实验先取人胰腺癌细胞PANC-1 按合适的浓度接种于背后用marker 画好线的6 孔板,过夜铺满。划痕时吸头垂直于背后横线,PBS 清洗3 次后加入无血清培养基。之后,按共培养情况进行分组实验:包括PANC-1 与高糖环境肝细胞外泌体共培养组(高糖组)、PANC-1 与正常糖环境肝细胞外泌体共培养组(正常糖组)、无外泌体的PANC-1 培养组(阴性对照组NC 组),即分别取高糖和正常糖环境下肝细胞MIHA 来源外泌体200 μg加入六孔板与PANC-1 共培养48 h,在0 h 和48 h 分别评估三组细胞迁移情况。
1.2.5 Transwell 迁移和侵袭实验分组同划痕试验,即分别提取正常糖与高糖环境下肝细胞产生的外泌体与胰腺癌细胞PANC-1 共培养48 h 后与阴性对照组一起分别进行如下实验:⑴ 侵袭实验:细胞消化离心后按照1×104个数目接种在涂有Matrigel基质胶的上腔室,下室加入500 μL 含10%胎牛血清的对应培养基,37 ℃ 5% CO2培养24 h 后取出小室使用4%多聚甲醛固定20 min,0.1%结晶紫溶液染色20 min,拍照计数细胞迁移数进行统计学分析。⑵ 迁移实验:除不需要基质胶外其余步骤和分组与侵袭实验相同。
1.2.6 Western blot将胰腺癌细胞PANC-1 按照5×105个数目接种至6 孔板,待细胞融合度达到80%时换液,按照100 μg/mL 加入200 μg 外泌体,共培养48 h 后裂解细胞,BCA 法检测蛋白浓度。分组同前,上样使用10% SDS-PAGE 凝胶设置150 V 电泳45 min,电泳后设置电流150 mA 冰上转膜85 min 将印迹转移至PVDF 膜上,快速封闭液封闭15 min。分别与E-cadherin、N-cadherin 和GAPDH一抗4 ℃共同孵育过夜,TBST 漂洗后按照一抗种属加入荧光二抗暗盒孵育2 h 后扫膜并保存数据。
1.3 统计学处理
使用SPSS 26.0 软件及Image J 软件进行实验数据分析,使用Graphpad Prism 8.0 制作统计图。计量资料使用均数±标准差(±s)表示,数据采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 外泌体的鉴定
高糖与正常糖培养基培养的肝细胞MIHA 外泌体样品在透射电镜下均呈椭圆形或球形囊泡,形态完整,大小均匀,具有脂质双层膜结构(图1A),粒径分析显示其粒径大小在40~150 nm 之间(图1B),符合外泌体的形态特征。Western blot 结果显示,其外泌体标志蛋白CD9 和CD63 表达阳性(图1C)。由此可确定提取物为外泌体。

图1 两种培养基来源的外泌体鉴定 A:透射电子显微镜下提取物呈现脂质双层结构的外泌体形态表征(比例尺=100 nm);B:粒径分析测量提取物小囊泡的粒径范围与外泌体粒径范围一致;C:Western blot结果显示两种培养基来源提取物外泌体标志蛋白CD9和CD63表达阳性 Figure 1 Identification of exosomes from two culture medium sources A: Characterization of exosome morphology with lipid bilayer structure observed under transmission electron microscopy (scale bar=100 nm);B: Particle size analysis showing the size range of extracted small vesicles consistent with the range of exosome sizes;C: Western blot results demonstrating positive expression of exosome marker proteins CD9 and CD63 in extracts from both culture medium sources
2.2 外泌体的摄取
在实时激光扫描共聚焦显微镜下可见到胰腺癌细胞PANC-1 细胞核被DAPI 染成蓝色,随着时间的推移,被PKH67 染为绿色的外泌体逐渐聚集于蓝色细胞核周围的细胞质中,表明两种培养基来源的肝细胞MIHA 外泌体均能被胰腺癌细胞PANC-1摄取(图2)。
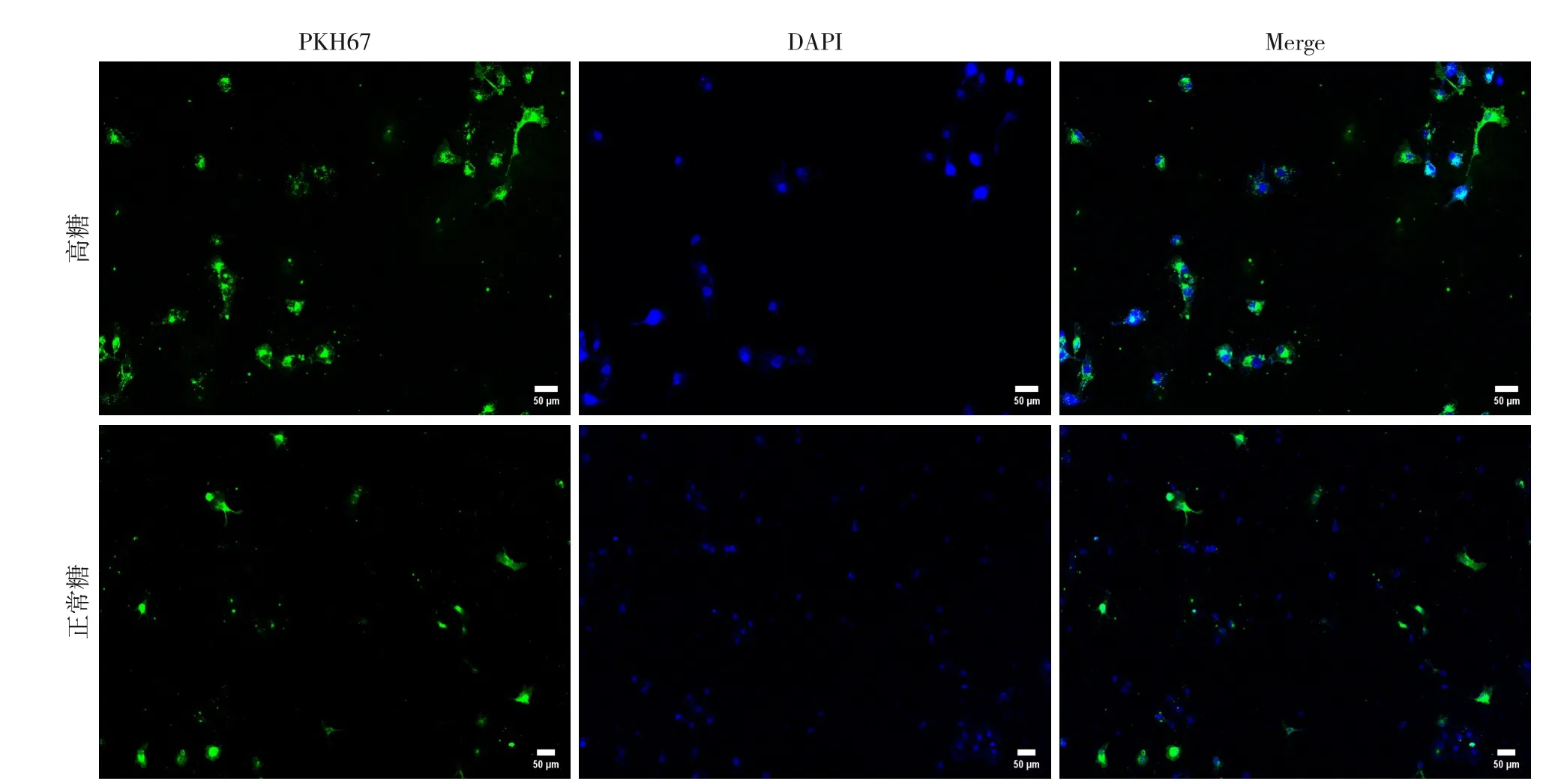
图2 PANC-1细胞对外泌体的摄取(绿色荧光显示外泌体,蓝色荧光显示PANC-1细胞核的位置;Merge为前面两图的叠加效果,从而显示胰腺癌细胞对外泌体的摄取;比例尺=50 μm)Figure 2 The uptake of exosomes by panc-1 cells (exosomes labeled in green fluorescence,PANC-1 cell nuclei labeled in blue fluorescence;Merge represents the overlay of the two previous images,demonstrating the uptake of exosomes by pancreatic cancer cells;scale bar=50 μm)
2.3 划痕试验结果
划痕试验检测PANC-1 细胞在外泌体作用下迁移能力的改变,结果显示,高糖组PANC-1 细胞的迁移率为(30.19±3.76)%、正常糖组PANC-1 细胞的迁移率为(22.87±4.07)%、阴性对照组PANC-1 细胞的迁移率为(16.62±4.52)%,高糖组PANC-1 细胞的迁移率明显高于阴性对照组(P<0.05),而正常糖组与阴性对照组的细胞迁移率差异无统计学意义(P>0.05)(图3)。

图3 细胞迁移率检测 A:划痕试验检测细胞迁移率(×40);B:各组细胞迁移率比较Figure 3 Cell migration rate detection A: Wound-healing assay to detect cell migration rate (×40);B: Comparison of cell migration rates among different groups
2.4 Transwell迁移实验结果
Transwell 迁移实验结果显示;高糖组迁移细胞数为(194.20±39.54)个、正常糖组迁移细胞数为(106.60±23.68)个、阴性对照组迁移细胞数为(89.60±32.55)个,高糖组迁移细胞数明显高于阴性对照组(P<0.05),而正常糖组与阴性对照组迁移细胞数差异无统计学意义(P>0.05)(图4)。
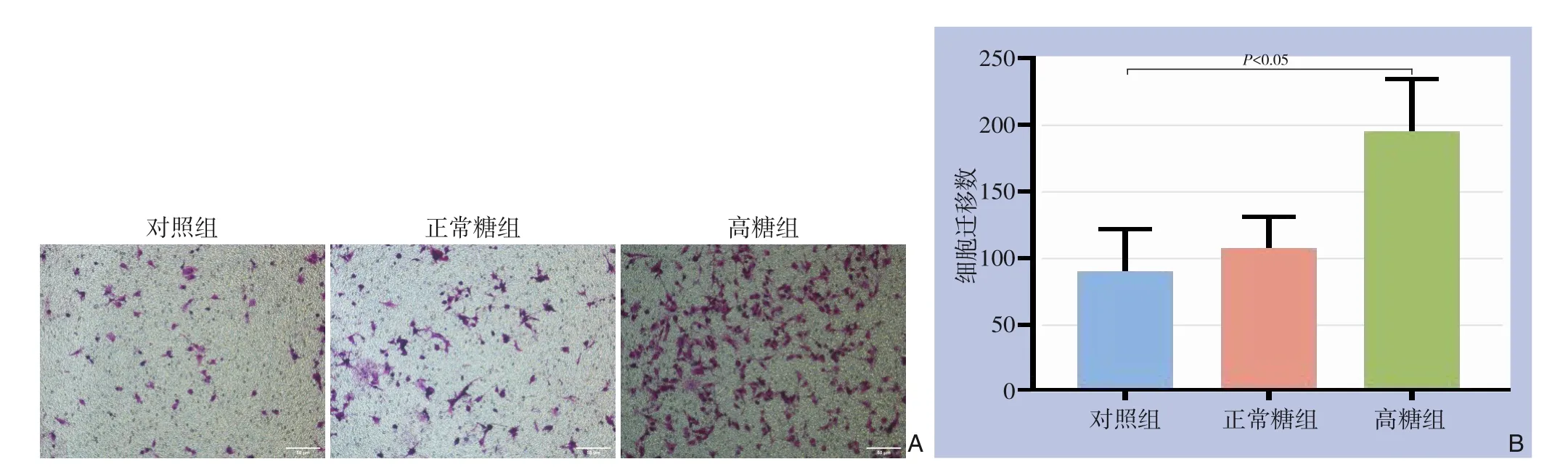
图4 细胞迁移数检测 A:Transwell迁移实验检测细胞迁移数(×100);B:各组细胞迁移数比较Figure 4 Cell migration number detection A: Transwell migration assay to detect cell migration number (×100);B: Comparison of cell migration numbers among different groups
2.5 Transwell侵袭实验结果
Transwell 侵袭实验结果显示,高糖组侵袭细胞数为(164.40±26.09)个、正常糖组侵袭细胞数为(116.20±29.88)个、阴性对照组侵袭细胞数为(99.80±25.59)个,高糖组侵袭细胞数明显高于阴性对照组(P<0.05),而正常糖组与阴性对照组的侵袭细胞数差异无统计学意义(P>0.05)(图5)。

图5 细胞侵袭数检测 A:Transwell侵袭实验检测细胞侵袭数(×100);B:各组细胞侵袭数比较Figure 5 Cell invasion number detection A: Transwell invasion assay to detect cell invasion number (×100);B: Comparison of cell invasion numbers among different group
2.6 EMT相关蛋白检测结果
用Western blot 检测EMT 相关蛋白的表达,结果显示,与阴性对照组比较,高糖组PANC-1 细胞中E-cadherin 蛋白的表达明显降低,N-cadherin 蛋白的表达明显升高(均P<0.05),而正常糖组与阴性对照组间两种蛋白表达的差异均无统计学意义(均P>0.05)(图6)。
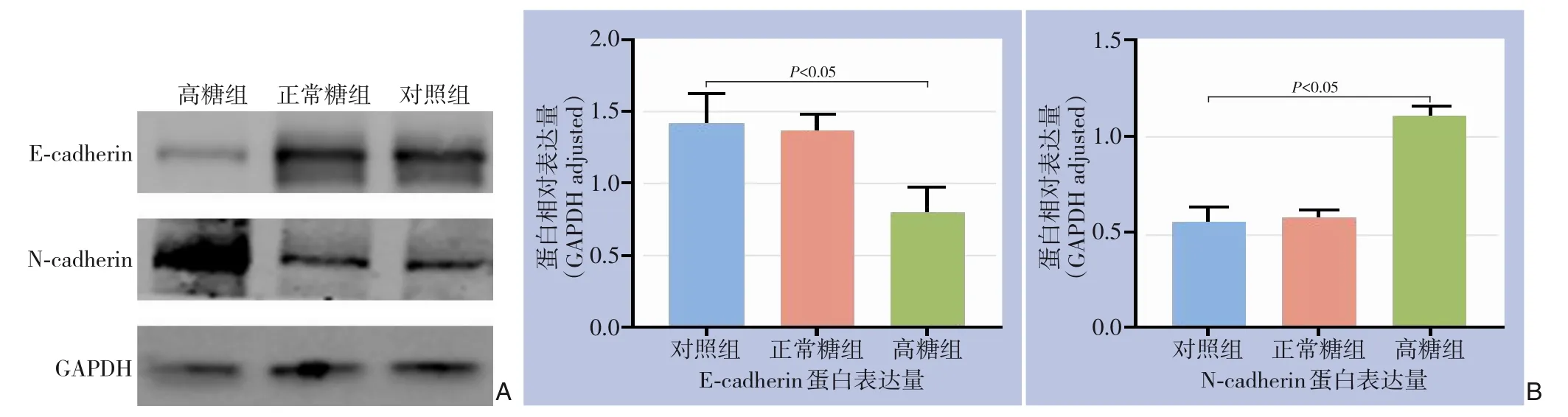
图6 EMT相关蛋白检测 A:Western blot检测结果;B:各组E-cadherin与N-cadherin蛋白表达量比较Figure 6 Detection of EMT-related proteins A: Results of Western blot analysis;B: Comparison of protein expression levels of E-cadherin and N-cadherin among different groups
3 讨论
胰腺癌是预后最差的恶性肿瘤之一,近年来患者数量持续增加。但是,胰腺位于腹部深处,属于腹膜后位器官,这一特殊位置导致胰腺癌难以被早期发现;且大多数早期胰腺癌不会引起患者明显的临床症状,直到扩散转移后才得以确诊[19]。胰腺癌的转移又以肝转移较为常见[1-2],这种临床现象是否与肝细胞本身的活动有关值得探讨。
文献报道一些非肿瘤细胞以外泌体为媒介在肿瘤的转移和进展中起着关键作用。在乳腺癌中,成纤维细胞通过外泌体介导的细胞通讯在调节乳腺癌进展的过程中发挥关键作用。来自成纤维细胞外泌体的circTBPL1 转运到乳腺癌细胞中,保护其下游靶基因TPBG 免受miR-653-5p 介导的降解,从而促进乳腺癌细胞的增殖、迁移和侵袭[4]。在卵巢癌中,成纤维细胞外泌体可通过调控miR-29c-3p-MMP2 轴促进卵巢癌的腹膜转移[5]。在胰腺癌中,M2 巨噬细胞来源的外泌体通过miR-193b-3p 靶向TRIM62 促进胰腺癌的进展和谷氨酰胺的摄取。TRIM62 的表达与miR-193b-3p 和c-Myc 的表达呈负相关,即miR-193b-3p 和c-Myc 的高表达和TRIM62 的低表达预示着胰腺癌患者预后不良[3]。成纤维细胞来源的外泌体通过miR-3173-5p/ACSL4 通路诱导了胰腺癌的吉西他滨耐药[6]。在非小细胞肺癌中,骨髓间充质干细胞来源的外泌体通过运送microRNA-30b-5p 阻断EZH2/PI3K/Akt 轴而抑制非小细胞肺癌的转移[7]。在结直肠癌中,脂肪肝细胞来源的外泌体将YAP 信号相关的miRNA 转移到癌细胞中,通过抑制LATS2而增强YAP 活性,从而促进致癌的YAP 蛋白信号通路并形成免疫抑制微环境,导致了结直肠癌的肝转移[8]。此外,肿瘤及其微环境一直有“种子和土壤”的假说,即肿瘤微环境为肿瘤这粒“种子”提供了肥沃的“土壤”,促进了肿瘤的转移和扩散。不少研究认为高糖微环境也是有利于肿瘤生长的“土壤”[9-10,20-23],因为它可以糖基化细胞外基质[21],还可以抑制癌细胞氧化磷酸化和细胞凋亡[9]。在胰腺癌中,高糖培养基预处理28 d 后,胰腺癌PANC-1 细胞的活力明显增加;高糖微环境通过增高磷酸化STAT3 和Myc 的水平[22]、改变Wnt/β-catenin 信号通路[23]等而促进胰腺癌的进展。那么,在高糖微环境下,作为非肿瘤细胞的肝细胞,其外泌体是否充当了细胞间交流的媒介从而促进胰腺癌的侵袭和迁移呢?本研究首先通过实验提取了高糖条件下肝细胞分泌的外泌体并对其进行验证。使用高糖培养基培养人正常肝细胞MIHA,运用超高速离心法提取细胞上清液中的外泌体,通过透射电镜观察发现提取物中存在较多圆形或椭圆形的囊泡,其形态完整、大小均匀,具有脂质双层膜结构,与外泌体的形态一致。接着,使用nanoFCM 粒径分析仪检测这些圆形囊泡的粒径,发现其粒径大小在40~150 nm 之间,与外泌体的大小一致。最后,用RIPA 裂解缓冲液裂解提取物,再用Western blot 法检测证实提取物中有外泌体标志蛋白CD9 和CD63 的表达。至此,完成了从形态学到分子水平对高糖微环境下肝细胞外泌体的鉴定。
研究还发现,外泌体及其携带的信息物质可以通过组织间的旁分泌、内分泌通路来调节基因表达[24]、影响细胞功能[25],是肿瘤发生和发展的重要调控因素。在肿瘤相关的外泌体中,有的能促进黑色素瘤细胞的EMT、迁移和侵袭[26],有的能促进鼻咽癌的转移[27]、有的能促进结直肠癌的肝转移[28],有的能促进胰腺癌细胞的增殖和迁移[29],有的能抑制尿路上皮癌的转移[30]等。
为了证实肝细胞产生的外泌体能与胰腺癌细胞相互作用,本研究使用亲脂性染料PKH67 标记高糖和正常糖环境下提取的肝细胞MIHA 的外泌体,使其发出绿色荧光。再将其分别与胰腺癌细胞PANC-1 共培养。然后,使用细胞核染料DAPI 使胰腺癌细胞PANC-1 的细胞核呈现蓝色荧光。最后,通过激光共聚焦显微镜观察发现:随着时间的推移,被PKH67 染为绿色的外泌体逐渐聚集于被DAPI 染成蓝色的胰腺癌细胞PANC-1 核周的细胞质中,表明肝细胞MIHA 来源的外泌体能被胰腺癌细胞PANC-1 摄取。
为研究胰腺癌细胞摄入高糖环境下肝细胞分泌的外泌体后会发生何种改变,本研究对胰腺癌细胞PANC-1 继续进行分组实验。划痕试验显示,高糖组胰腺癌细胞的迁移率高于其他两组;Transwell 迁移实验和侵袭实验显示,高糖组的迁移和侵袭能力均高于其他两组。Western blot 结果显示,高糖组胰腺癌细胞PANC-1 中E-cadherin 蛋白的表达显著降低,而N-cadherin 蛋白的表达则显著增强。E-cadherin 和N-cadherin 是EMT 相关蛋白,EMT是上皮细胞获得间充质细胞典型特征的一个动态可逆的转变过程,在这个过程中上皮细胞获得了迁移和侵袭周围组织的能力从而导致了肿瘤的侵袭、转移和耐药等不同特征[31]。在EMT 中上皮细胞标志物E-cadherin 表达缺失被认为是关键步骤[32],同时N-cadherin 作为间充质细胞标志物表达增高从而使肿瘤细胞更具运动性和侵袭性[33]。当受到某些因素刺激时(如缺氧微环境),胰腺癌细胞E-cadherin 的表达显著下调,进而启动EMT 过程导致肿瘤的侵袭和转移。E-cadherin 的表达水平与患者的预后呈正相关,也是胰腺癌的独立预后标志物[34],并且E-cadherin 的表达水平与肿瘤的恶性程度和不良分化呈显著的相关性[35]。本研究中高糖组胰腺癌细胞PANC-1 的E-cadherin 表达降低而N-cadherin 表达升高,表明高糖微环境下肝细胞分泌的外泌体能够促进胰腺癌细胞的EMT,从而增强其侵袭和迁移能力。
综上所述,本研究从体外细胞水平证实了高糖微环境下肝细胞MIHA 产生的外泌体能够促进胰腺癌细胞PANC-1 的侵袭、迁移及EMT。笔者推测此结果可能与外泌体中某些miRNA 的表达改变有关。由于本研究主要从形态学和蛋白水平进行验证,尚未涉及基因水平,因此课题组后续会进一步从基因层面深入研究,探讨高糖微环境下胰腺癌侵袭、转移的完整分子网络,为胰腺癌肝转移的预防和治疗提供新的思路和方向。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:杨昊长负责实验操作、文稿撰写及统计学分析;秦雯负责课题设计、提供基金资助、审校稿件和指导课题实施;许永宁、廖嘉华及杨馨玥负责细胞培养。

