陆地棉重组自交系再生能力和遗传转化效率筛选
乐 愉 王 涛 张献龙 林忠旭
陆地棉重组自交系再生能力和遗传转化效率筛选
乐 愉 王 涛 张献龙 林忠旭*
华中农业大学植物科学技术学院 / 作物遗传改良全国重点实验室, 湖北武汉 430070
转基因工程育种是棉花种质创新的有效手段, 为了拓展陆地棉可再生基因型, 丰富棉花转基因受体, 本研究以湖北省高产阔叶棉品种‘鄂棉22’ (E22)为母本、高再生能力的鸡脚叶品种‘豫早1号’ (YZ1)为父本, 通过单籽传法构建了F9重组自交系群体(YE); 利用棉花中比较成熟的IBA+KT (IK)和2,4-D+KT (DK) 2种不同激素组合的培养体系, 分别对重组自交系群体的164个家系的愈伤组织诱导率(CIF)、愈伤组织继代繁殖力(CSC)、愈伤组织的出胚率(CRE)以及愈伤组织出胚时间(CET)进行比较, 共获得12个可再生的阔叶棉家系; 利用目前成熟的棉花遗传转化体系对可再生阔叶棉家系进行遗传转化效率分析, 同时对其进行田间农艺性状考察, 最终获得了一个遗传转化效率为82.9%并且农艺性状更优良的家系YE3。本研究为棉花的遗传转化及基因功能研究拓展了陆地棉基因型种质资源。
棉花; 重组自交系; 体细胞胚胎发生; 再生能力; 遗传转化效率
棉花是世界上重要的纤维和油料作物, 在我国的经济发展中有着举足轻重的地位。传统的杂交育种法已经难以满足现代棉花遗传改良的需要, 转基因生物技术育种是棉花种质创新的热点[1]。而现代分子生物技术应用的先决条件在于具备不同品种的组织培养和植株再生的高效体系, 因此在棉花的遗传改良过程中, 丰富的棉花遗传转化受体材料以及较高的再生能力和遗传转化效率至关重要。
棉花组织培养体系的构建起步较晚, 但发展迅速。1979年, Price和Smith利用悬浮培养技术成功地诱导出了棉花体细胞胚[2], 1983年, Davidonis对陆地棉Coker 310 (珂字棉)经过2年多的继代培养, 成功获得第1株棉花再生植株[3]。历经十几年的研究探索, 棉花组织培养体系逐渐完善, 随后进入快速发展时期, 由于棉花体细胞胚胎发生受基因型限制, 很多体细胞胚胎发生的陆地棉多为珂字棉或有其遗传背景的品种[4-6]。2006年, 金双侠等[7]通过对多种基因型棉花材料进行离体培养, 筛选到了2个体细胞胚胎发生能力明显高于珂字棉的基因型材料‘豫668’ (Y668)和‘豫早1号’ (YZ1); 2008年, 陈天子等[8]利用新疆4个主栽棉花品种‘新陆中20’、‘新陆早24’、‘新陆早33’和‘03298’为材料, 通过不同浓度的激素组合成功地诱导体细胞胚发生并且在6~8个月获得大批量再生苗。葛书娅等[9]设计了6种不同激素组合的培养体系, 成功建立了新疆推广的陆地棉品种‘新陆早45号’的再生体系。对棉花不同品种的再生条件的摸索, 拓展了陆地棉再生基因型, 为棉花的遗传转化丰富了受体材料。
植物转基因技术已经成为植物分子育种中最常用的手段, 棉花转基因后能否快速地获得再生植株, 除了受到组织培养再生体系的影响, 关键影响因素是转基因受体的可再生能力[10]。再生能力受基因型决定, 不同基因型间再生能力差异很大, 且多为数量性状[11]。张献龙等[12]提出棉花的基因型是影响体细胞胚胎发生和植株再生的首要因素, 而其他外界条件是次要的。通过对4个栽培品种的比较发现, 再生能力在栽培种之间也存在较大的差异: 陆地棉>亚洲棉>海岛棉>非洲棉, 而同一栽培种的不同棉花品种间也存在差异, 例如陆地棉中以珂字棉的再生能力最强, 珂字棉>岱字棉>斯字棉[13]。2022年, Ge等[14]以棉花种子的顶端分生组织干细胞为外植体, 利用农杆菌和超声波处理将外源基因整合到干细胞中, 通过诱导干细胞产生不定芽进而发育成再生植株, 建立了无基因型限制的棉花遗传转化体系。然而, 通过体细胞胚胎发生再生植株仍然是棉花转基因研究的重要方法。通过对再生能力相关的基因进行定位和克隆, 用以改造农艺性状优良但再生能力低的基因型, 是实现作物转基因生产的有效手段[15]。由于棉花体细胞胚胎发生和植株再生对基因型的依赖性较大, 根据已报道的不同棉花品种的再生培养体系, 选择与亲本相关的再生体系对构建的群体进行培养, 通过对再生能力相关性状的数据统计, 尝试定位与体细胞胚发生和再生能力相关的位点, 然后有针对性的将这些位点导入到农艺性状优良的品种中去, 可用于进一步改良这些优良品种[16]。
为了拓展陆地棉可再生的基因型, 丰富陆地棉的转基因受体材料, 本研究以湖北省高产棉花品种‘鄂棉22’ (Emian 22, E22)和高再生能力的品种‘豫早1号’ (Yuzao 1, YZ1)为亲本, 构建了包含164个家系的重组自交系群体(YE), 采用IBA+KT (IK)和2,4-D+KT (DK) 2种培养体系对YE家系的再生能力进行鉴定并对可再生阔叶棉家系进行遗传转化效率分析, 以期筛选出农艺性状优良且遗传转化效率较高的材料。
1 材料与方法
1.1 试验材料
以‘鄂棉22’ (E22)为母本、‘豫早1号’ (YZ1)为父本杂交获得F1。E22是由湖北省黄冈市农业科学院选育, 产量较高, 纤维品质良好, 但再生能力较差, 难以获得再生植株。YZ1再生能力高[7,17], 可在短时间内获得再生植株, 但产量低, 纤维品质一般。F1自交获得F2, 之后通过单籽传法自交9代获得纯合株系, 该重组自交系群体包含164个株系, 以YE表示。
1.2 试验方法
1.2.1 组织培养方法 基于本实验室优化的棉花组织培养体系[18], 采用IBA+KT (IK)和2,4-D+KT (DK) 2套培养体系, 分别对164个YE家系及亲本E22和YZ1的下胚轴进行愈伤组织的诱导、胚性愈伤组织的分化和再生培养。
1.2.2 培养基的选择 本试验中所用的培养体系是经过多次优化后的、适合棉花组织培养的培养体系, 包括无菌苗萌发培养基、愈伤组织诱导培养基、体细胞胚分化培养基、生根培养基。采用IK和DK 2套体系进行培养。
无菌苗萌发培养基: 1/2 MS大量元素, 附加15 g L–1葡萄糖, 2.5 g L–1的Phytagel。
愈伤组织诱导培养基: MS无机盐, B5维生素作为基本培养基(以下简称MSB), 附加不同种类的激素组合。
体细胞胚分化培养基: MSB基本培养基(KNO3加倍, 去掉NH4NO3)并附加Gln 2.0 g L–1和Asn 1.0 g L–1。
生根培养基: 1/2 MS无机盐加B5有机物, 附加15 g L–1葡萄糖, 2.5 g L–1的Phytagel。
所有的激素和氨基酸在灭菌前加入, 在121℃, 1.1 kg cm–2压力下高温高压灭菌15 min。所有培养物均置于(28±2)℃, 光照强度(冷光源135mmol m–2s–1), 每天光照14 h的条件下进行培养。
1.2.3 愈伤组织的诱导 无菌苗的培养: 硫酸脱掉短绒后的种子剥掉种皮后浸泡于10%的升汞溶液8~10 min, 再用无菌水冲洗3~5次, 接种于无菌苗培养基上, 露白之后将根用无菌的镊子插入培养基中, 并剥去内种皮, 置于20℃的暗培养条件下生长。
愈伤组织诱导: 取无菌苗下胚轴切成0.5~ 0.8 cm小段分别接种于2种愈伤组织诱导培养基上, 每个家系培养3瓶, 每瓶初始放置10段下胚轴, 并称取0 d的重量; 放置于光照培养室进行培养, 培养每隔25 d后采用各自所属体系进行继代培养, 统计愈伤组织的诱导率(callus induction rate, CIF); 第1次25 d继代时称取每个家系的增殖重量, 求取平均值, 计算愈伤组织继代繁殖力(callus secondary fecundity, CSC)。
1.2.4 愈伤组织的继代 随着愈伤组织的快速增长, 培养基空间过于拥挤, 所以在继代过程中随机减少愈伤的块数, 每瓶培养基只保留6块愈伤组织, 在继代过程中统计愈伤组织最早出胚时间(callus embryo time, CET)和愈伤组织的出胚块数以及瓶数, 从而计算愈伤组织的出胚率(embryo rate of callus, CRE)。
1.2.5 愈伤组织的分化 观察到分化出胚性愈伤组织后立即转入分化培养基中培养, 继续继代培养直到分化成胚, 再选择发育正常的子叶胚转移到生根培养基上, 促使幼苗生根。
1.2.6 衡量棉花再生能力性状的统计 本次试验所统计的与棉花体细胞再生能力的性状有: 愈伤组织诱导率(CIF)、愈伤组织继代繁殖力(CSC)、愈伤组织最早出胚时间(CET)、愈伤组织的出胚率(CRE) 4个指标, 计算方法如下: 愈伤组织诱导率(CIF): 出愈伤块数/诱导愈伤总块数×100; 愈伤组织继代繁殖力(CSC): 继代25 d后的愈伤重/继代0 d的愈伤重×100; 愈伤组织出胚时间(CET): 单个家系中最早出现胚性愈伤的时间; 愈伤组织的出胚率(CRE): 出现胚性愈伤的块数/继代总块数×100。
1.2.7 遗传转化效率分析 以12个可再生阔叶棉家系为转化受体材料, 每一个受体保证10瓶无菌苗, 每瓶4粒种子的下胚轴用于切苗侵染; 在农杆菌侵染后的第1个月, 每个愈伤组织诱导培养皿有35~40段生长健康的下胚轴段, 每个受体获得10~12个培养皿不等, 不同的培养皿是不同的重复。采用IK培养体系, 以红色荧光蛋白(red fluorescence protein, RFP)为报告基因, 红色荧光蛋白由华中农业大学金双侠教授提供, 利用农杆菌介导的棉花遗传转化方法进行棉花遗传转化[18]; 再利用体式显微镜在红色荧光波长下观察转基因植株是否有红色荧光, 遗传转化效率计算方法为阳性单株/总转化单株×100。
1.2.8 农艺性状考察 12个可再生阔叶棉家系以及亲本E22和YZ1于2019年种植于湖北武汉、2020年及2021年种植于湖北鄂州试验基地。待棉花完全吐絮时, 收取植株中部吐絮正常的棉花, 轧花后对衣分含量以及棉花纤维品质性状进行考察。
2 结果与分析
2.1 2种培养体系下YE群体的再生能力鉴定
2.1.1 体细胞胚胎发生的差异 不同的棉花品种在同一培养体系下, 其再生时间存在明显的差别, 而同一品种选择的培养体系不同, 再生能力也存在差异。因此, 针对高再生能力的家系选择合适的培养体系就显得至关重要。
棉花的植株再生过程通常包括外植体接种、愈伤组织的诱导、胚性愈伤组织的分化、胚状体的形成和植株再生4个过程。胚性愈伤组织转移到分化培养基上培养2~3个月后会得到大量胚状体, 对胚状体进行诱导后得到再生幼苗。但是在利用IK和DK体系培养YE家系的过程中发现, 在IK培养体系下(图1)有个别家系(YE3)在2~3个月的时候未见大量胚性愈伤, 却率先发现了零星的子叶胚(图1-C),通过对子叶胚的诱导, 能够顺利得到再生植株, 可在原来培养周期的基础上进一步缩短再生周期。这些家系在DK培养体系(图2)下并未出现这种先出现子叶胚的情况, 因此在培养体系的选择上, IK体系比DK体系更适合YE群体。
2.1.2 再生能力的比较 利用IK和DK培养体系对164个YE家系和亲本进行组织培养, 本研究对CIF、CSC、CET、CRE 4个指标进行了数据统计。由于培养体系的优化, 在2种培养体系下所有的家系都可以诱导出愈伤组织, 因此所有家系的CIF都接近100%, 本研究可通过其他3个指标来衡量不同家系的再生能力。

图1 IK体系下棉花体细胞胚胎发生和植株再生流程
A: 棉花下胚轴; B: 1~2个月的愈伤组织; C: 胚性愈伤组织, 伴有子叶型胚状体; D: 大量胚状体形成; E: 植株再生; F: 水培后可移栽。
A: hypocotyl; B: the induced callus tissue of 1–2 months; C: the embryonic callus with cotyledons; D: a large amount of embryoid formation; E: plant regeneration; F: hydroponics can be transplanted.

图2 DK体系下棉花体细胞胚胎发生和植株再生流程
A: 棉花下胚轴; B: 1~2个月的愈伤组织; C: 胚性愈伤组织, 无胚状体; D: 大量胚状体形成; E: 植株再生; F: 水培后可移栽。
A: hypocotyl; B: the induced callus tissue of 1–2 months; C: the embryonic callus with cotyledons; D: a large amount of embryoid formation; E: plant regeneration; F: hydroponics can be transplanted.
由IK和DK体系下愈伤组织增殖频率分布图(图3)可知, YE家系在DK培养体系下的继代繁殖力大部分在4~7 g, 而在IK培养体系下的继代繁殖力大部分在3~5 g, 在DK培养体系下的继代繁殖力高于IK体系。对于在IK和DK 2种培养体系下均可出胚的家系, 本研究对其相关性状的统计分析发现, 对于出胚时间(图4-A), 在IK体系下, 出胚时间主要集中在60~80 d, 而在DK体系下, 出胚时间主要集中在80~100 d, IK体系的出胚时间要比DK体系的出胚时间短; 对胚性愈伤组织出胚率(图4-B)的比较可以看出, 出胚率大多处于60%~100%, 2种体系没有明显差异。综合胚性愈伤组织增殖、愈伤组织出胚时间和胚性愈伤组织出胚率可知, 过度地愈伤增殖并不会加快胚性愈伤组织的出现, 对出胚率也没有明显影响。
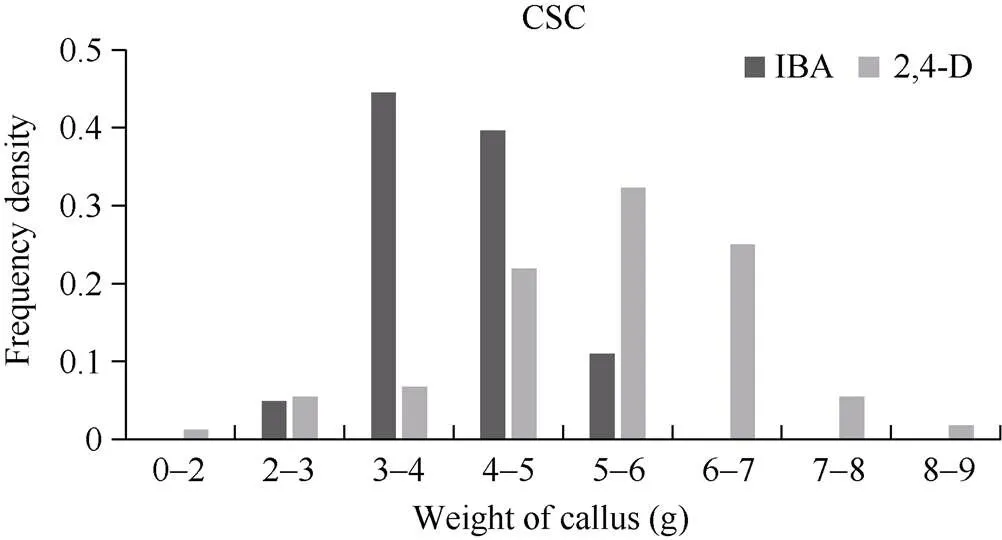
图3 IK和DK体系下愈伤组织增殖的频率分布图
CSC: 愈伤组织继代繁殖力。CSC: callus secondary fecundity.
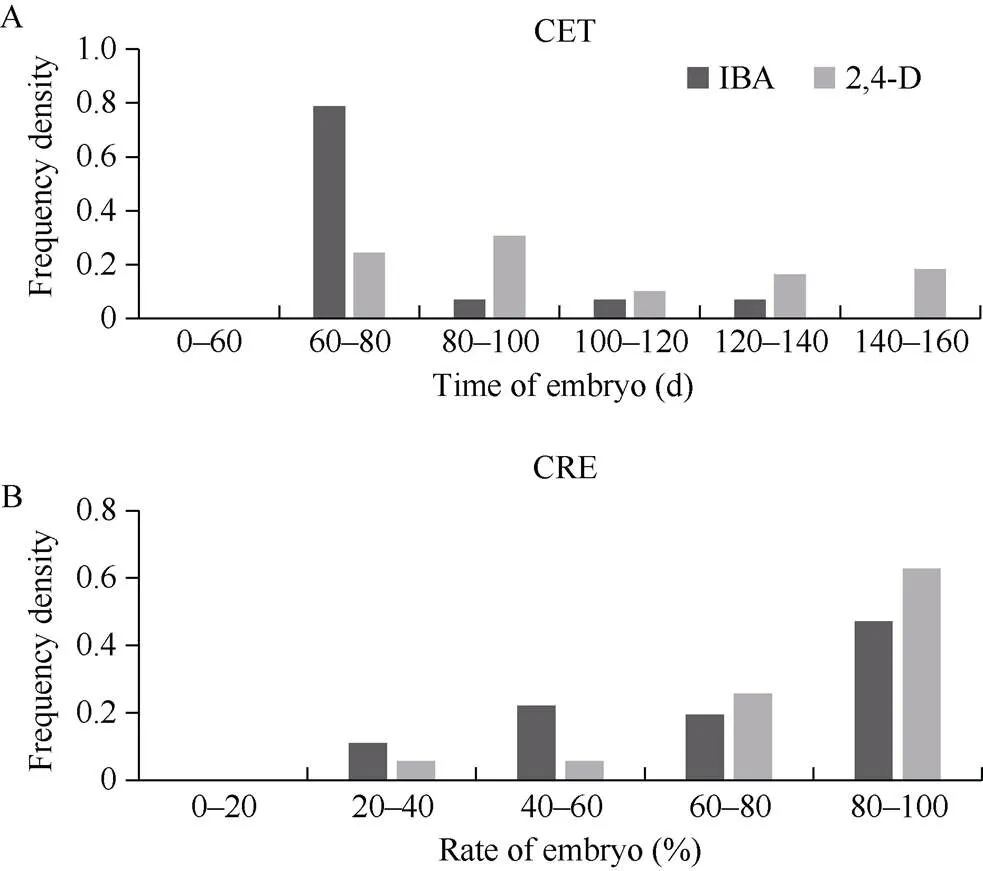
图4 IK和DK体系下可出胚家系再生相关性状的频率分布图
A: CET, 愈伤组织最早出现的时间; B: CRE, 愈伤组织出胚率。
A: CET, callus embryo time; B: CRE, the embryo rate of callus.
2.1.3 YE家系再生植株统计 本研究对在2种体系下获得的再生苗进行统计发现, 共有36个家系在IK体系下获得再生苗, 其中22个是阔叶棉家系; 共有35个家系在DK体系下获得再生苗, 其中19个是阔叶棉家系; 共有25个家系在2个培养体系下均能获得再生苗, 其中阔叶棉家系有12个(表1), 图5所示为部分再生植株。本研究选择在2个体系下均可以获得再生苗的阔叶棉家系继续后续的遗传转化分析, 这些阔叶棉家系在IK体系下的CIF为100%, CSC不低于2.8 g, CER不低于50%, CET不晚于120 d。

图5 部分再生植株

表1 再生YE家系CSC、CRE和CET比较
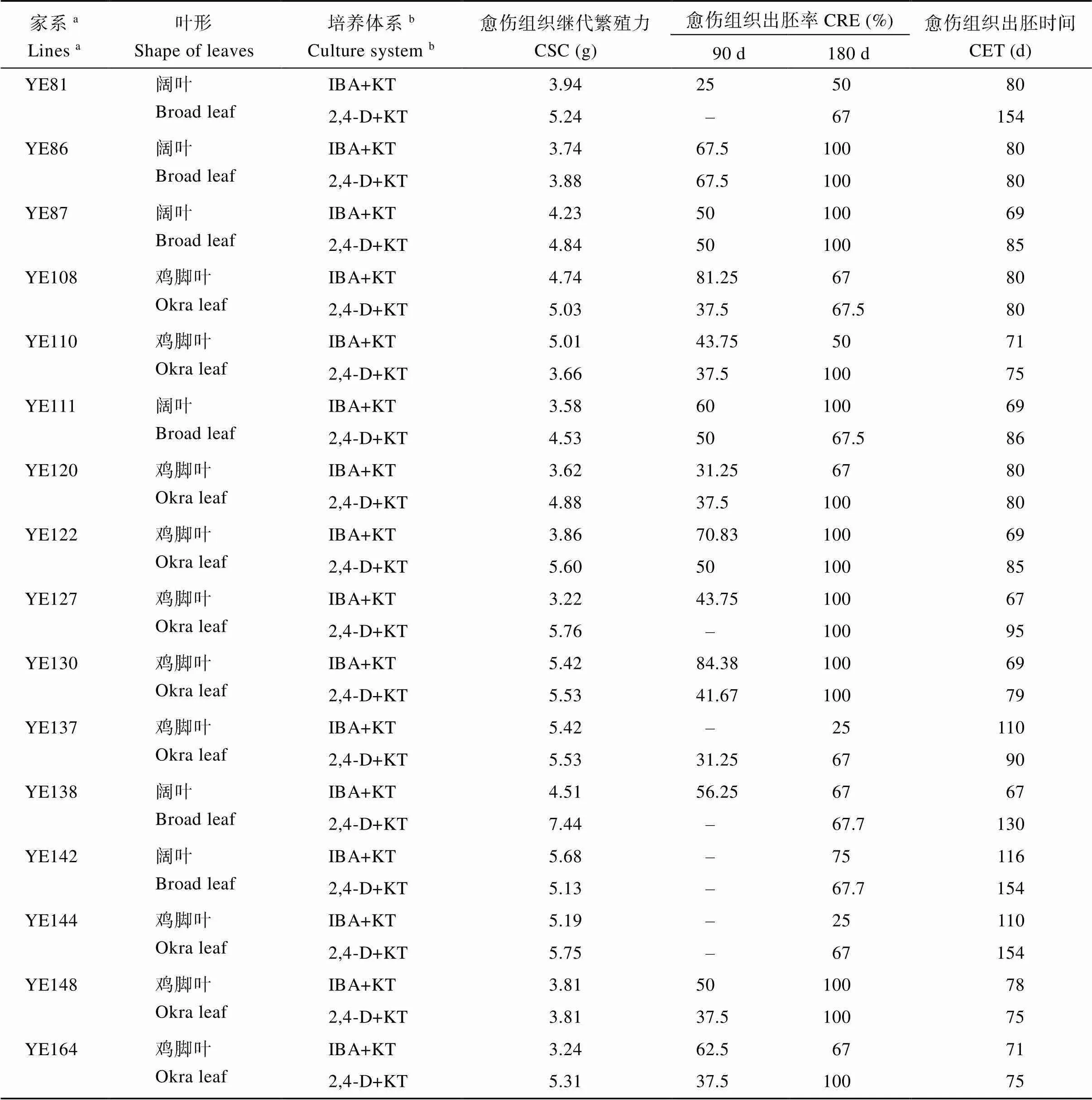
(续表1)
aYE表示以E22和YZ1为亲本获得的重组自交系群体的家系编号;bIBA+KT表示吲哚丁酸+激动素激素组合, 2,4-D+KT表示2,4-二氯苯氧乙酸+激动素激素组合。
aYE: the recombinant inbred lines obtained with E22 and YZ1 as the parents.bIBA+KT: hormone combination of indole butyric acid + kinetin, 2,4-D+KT: hormone combination of 2,4-dichlorophenoxyacetic acid + kinetin. CSC: callus secondary fecundity; CRE: the embryo rate of callus; CET: callus embryo time.
2.2 可再生阔叶棉遗传转化效率鉴定
本研究对筛选得到的所有可再生阔叶棉家系利用IK体系进行遗传转化发现, 并不是所有的可再生阔叶棉家系在经过农杆菌侵染后都能获得再生植株。YE81和YE86在侵染90 d后开始出现大面积的农杆菌污染, 下胚轴坏死; YE21无法诱导出愈伤组织, 下胚轴发黑坏死; YE22、YE33、YE38、YE111、YE138和YE142可以诱导出愈伤组织, 但是后面无法诱导出胚性愈伤组织; YE87可以诱导出胚性愈伤组织, 但是胚状体发育畸形, 无法获得再生植株; 只有YE3和YE54能完成体细胞胚胎发生及植株再生过程, YE3在培养7个月后开始获得再生苗, YE54只获得了阴性单株, 没有获得阳性单株。图6中的ABCD和EFGH分别为在白光和红色荧光条件下YE3转基因胚性愈伤组织(图6-A)、体细胞胚(图6-B)和转基因植株叶片(图6-C, D), 其中图6-D和6-F所示左边为阳性植株叶片, 右边为阴性植株叶片。最终统计表明以YE3为受体获得的转基因总植株数为41, 阳性单株数为34, 其遗传转化效率达到82.9%。

图6 YE3转基因植株阳性鉴定
A和E: 胚性愈伤组织; B和F: 体细胞胚; C、G、D和F: 叶片; 标尺为1000mm。
A and E: embryonic callus; B and F: embryo; C, G, D, and H: leaf. Bar: 1000mm.
2.3 可再生阔叶棉家系农艺性状考察
本研究考察了12个可再生的阔叶棉家系的纤维品质及纤维产量相关性状, 包括纤维长度、纤维强度、马克隆值、整齐度、伸长率和衣分。由表2可知, 在纤维长度方面, 除YE22明显低于YZ1外, 其他可再生阔叶棉家系均接近或高于YZ1; 在纤维强度方面, 所有家系均高于YZ1; 马克隆值和伸长率在E22和YZ1之间没有差异, 可再生阔叶家系中的马克隆值和伸长率变化较大; YZ1的整齐度高于E22, 可再生阔叶棉家系YE3、YE21、YE81、YE138和YE142的整齐度均高于YZ1; 在产量性状衣分上, 除了YE81和E22接近, 其他阔叶棉家系均高于YZ1。由此可见, 可再生阔叶棉中大部分家系表现出优于高再生能力材料YZ1的农艺性状, 说明这些可再生阔叶家系中同时还携带了与优良农艺性状相关的遗传信息。
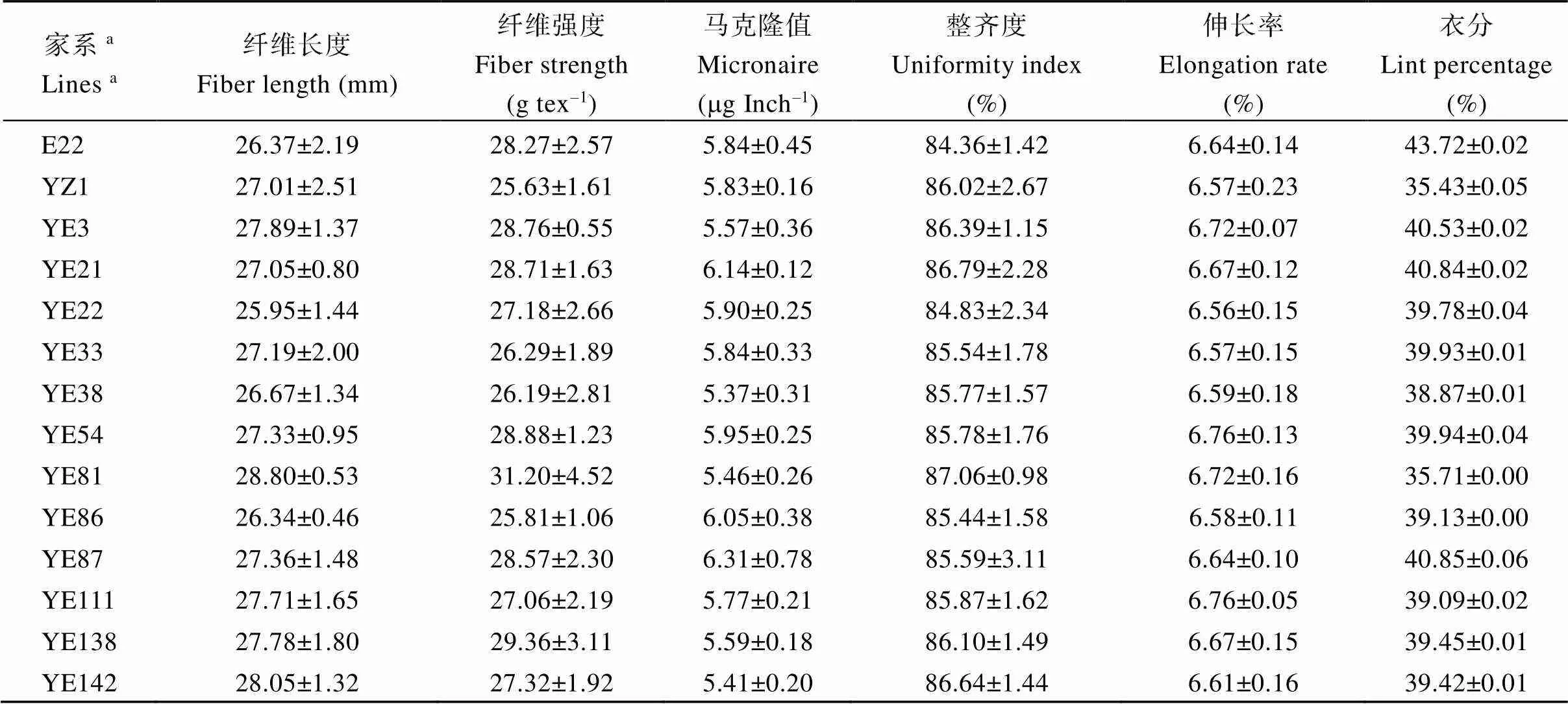
表2 12个可再生阔叶家系农艺性状考察
aYE表示以E22和YZ1为亲本获得的重组自交系群体的家系编号。
aYE represents the recombinant inbred lines obtained with E22 and YZ1 as the parents.
YE3在纤维品质性状如纤维长度、纤维强度、纤维整齐度、纤维伸长率方面要明显优于高再生能力的材料YZ1; 在产量性状上, YE3的衣分为40.53%, 与E22的43.72%接近, 远远高于YZ1的35.43%。综上, 在主要农艺性状方面, YE3表现出优于高再生材料YZ1的潜力, 表明YE3中携带了YZ1高再生能力相关的遗传位点, 同时又保留了高产陆地棉品种的优异农艺性状。
3 讨论
3.1 高再生能力家系的筛选
同一个家系在不同培养体系下的再生能力存在差异。李雪林等[19]利用DK和IK体系对多个棉花品种的体细胞胚胎发生能力进行比较时发现, DK体系下大铃棉和邯8959两个材料只能分化出胚性愈伤, 但在IK体系下胚性愈伤组织能够萌发出胚状体, 并再生出完整植株。本研究利用DK和IK体系对YE家系的再生能力统计过程中也发现, 有些家系在2个体系下都可再生(表1); 但也有一部分家系只在其中一个体系下可再生, 如YE16、YE34和YE129等10个家系只能在DK体系下获得再生植株, YE30、YE44、YE80等11个家系只能在IK体系下可以获得再生植株。本研究认为在2个体系下都能获得再生植株的YE家系才是高再生能力的代表, 至少说明其基因型响应2种激素的能力较强。
3.2 高遗传转化效率及农艺性状优良材料的筛选
筛选再生能力强以及遗传转化效率高且综合农艺性状优良的阔叶棉材料对于棉花转基因工程尤为重要。YZ1虽然具有较高的再生能力, 但以它作为转基因受体的弊端很明显, 作为超鸡脚叶的典型代表, YZ1的纤维产量和品质不佳, 以它为受体的转基因植株很难满足当前的生产需要。E22适应范围广, 其纤维产量和纤维品质优于YZ1, 但该材料无法通过组织培养技术诱导体细胞胚胎的发生及植株再生,因此我们无法以它作为转基因受体材料进行定向改良研究。为了获得高再生能力并且产量和品质优良的材料, 以满足当前生产上的遗传改良需要, 本研究以YZ1和E22为亲本, 通过多代自交获得了稳定遗传的重组自交系群体, 避免了像F2群体只能用一代的弊端, 可以常年获得外植体对其进行组织培养和遗传转化研究。
作为维管束植物最主要的营养器官, 叶片对于光合产物的积累、养分分配以及水分运输起着重要作用[20]; 叶形和空间分布会影响光能利用效率, 在很大程度上决定着作物的产量和品质[21]。目前生产上主栽陆地棉品种为阔叶棉, 阔叶棉叶面积大, 光合作用强; 鸡脚叶叶面积小, 不利于光合作用, 并且与纤维产量和品质不利性状关联, 不适于大面积种植[22]。因此, 本研究选择可再生的阔叶棉家系进行遗传转化效率的研究。
本研究共获得了12个在IK和DK 2种培养体系下均可再生的阔叶棉家系, 选用更适合于YE家系的IK培养体系进行培养, 利用农杆菌介导法进行遗传转化, 农杆菌介导外源基因进入植物基因组需要编码毒力蛋白(vir)的基因, 这些毒蛋白基因的表达受到受伤的植物释放的酚类物质的诱导[23]。农杆菌介导棉花遗传转化受到多因素影响[24], 内在因素包括基因型和外植体, 外在因素包括培养体系、农杆菌菌株和浓度以及浸染时间、酚类物质乙酰丁香酮(AS)的浓度、共培养的时间以及抗生素的浓度等, 本研究在对可再生阔叶棉家系进行遗传转化时, 除了基因型的差异外, 其他因素都是保持一致的。遗传转化结果表明, 并不是所有能够再生的阔叶棉家系都能够经过农杆菌的浸染并完成转化过程而得到转基因植株, 可能是由于基因型差异引起, 基因型不同的受体在受到农杆菌侵染时, 伤口释放的酚类物质可能也会不同, 从而影响对毒力蛋白的诱导和T-DNA的转移能力, 针对不同基因型的材料, 可能需要优化遗传转化方案才能达到理想的结果。
本研究选择以RFP为报告基因, 因为RFP的可视性强, 可肉眼观察转基因植株的颜色以筛选阳性转化事件, 同时可利用荧光体式显微镜观察以明确筛选结果。通过统计阳性转基因植株所占比例, 筛选出了高遗传转化效率的材料YE3, 该材料能在胚性愈伤组织诱导阶段率先诱导出子叶胚, 子叶胚进一步分化成再生苗, 这一点特性可缩短再生苗的培养周期; 田间农艺性状考察表明YE3有更优于YZ1的优良农艺性状。综上, 本研究表明YE3在棉花转基因育种中具有很强的实用性。
4 结论
本研究利用DK和IK 2种培养体系对YE重组自交系群体进行再生能力的鉴定, 筛选出了12个可再生阔叶棉; 通过遗传转化效率分析以及农艺性状考察, 最终筛选到一个遗传转化效率高于80%、且主要农艺性状更优良的材料YE3, 本研究拓展了陆地棉遗传转化的基因型, 丰富了转基因受体材料。后续研究可以将具有YZ1等位基因的位点作为具有调控棉花再生能力的候选位点, 同时结合转录组分析以及功能基因组挖掘棉花再生相关候选基因, 为棉花体细胞胚胎发生及再生研究提供理论基础。
[1] Tanveer K, Siva R V, Sadhu L. High-frequency regeneration via somatic embryogenesis of an elite recalcitrant cotton genotype (L.) and efficient-mediated transformation, 2010, 101: 323–330.
[2] Price H J, Roberta H S. Somatic embryogenesis in suspension cultures ofanderss,1979, 145: 305–307.
[3] Davidonis G H, Hamilton R H. Plant regeneration from callus tissue ofL, 1983, 32: 89–93.
[4] Kumar S, Pental D. Regeneration of Indian cotton variety MCU-5 through somatic embryogenesis, 1998, 74: 538–540.
[5] Kumria R, Sunnichan V G, Das D K, Gupta S K, Reddy V S, Bhatnagar R K, Leelavathi S. High-frequency somatic embryo production and maturation into normal plants in cotton () through metabolic stress, 2003, 21: 635–639.
[6] Rauf S, Hafeez-ur-Rahman. A study ofregeneration in relation to doses of growth regulators in hybrids of upland cotton, 2005, 83: 209–215.
[7] Jin S X, Zhang X L, Nie Y C, Guo X P, Liang S G, Zhu H G. Identification of a novel elite genotype forculture and genetic transformation of cotton, 2006, 50: 519–524.
[8] 陈天子, 吴慎杰, 李飞飞, 郭旺珍, 张天真. 新疆棉花4个主栽品种的体细胞胚胎发生及植株再生作物学报, 2008, 34: 1374–1380. Chen T Z, Wu S J, Li F F, Guo W Z, Zhang T Z.regeneration of four commercial cotton (L.) cultivars grown in Xinjiang, China., 2008, 34: 1374–1380 (in Chinese with English abstract).
[9] 葛书娅, 沈秋平, 何积明, 吕尊富, 郑海彪, 李飞飞. 陆地棉新陆早45号体细胞胚胎发生及再生体系的建立作物学报, 2018, 30: 492–497. Ge S Y, Shen Q P, He J M, Lyu Z F, Zheng H B, Li F F. A regeneration system for cotton variety Xinluzao 45somatic embryogenesis., 2018, 30: 492–497 (in Chinese with English abstract).
[10] 罗晓丽, 姜艳丽, 肖娟丽, 武宗信, 张安红, 王志安, 吴家和. 早熟棉体细胞胚胎发生和植株再生体系的建立西北植物学报, 2011, 31: 609–615. Luo X L, Jiang Y L, Xiao J L, Wu Z X, Zhang A H, Wang Z A, Wu J H. Establishment of somatic cell embryogenesis and plant regeneration system of early cotton., 2011, 31: 609–615 (in Chinese with English abstract).
[11] 王永芳, 刁现民. 植物再生相关基因的QTL定位及克隆应用研究进展河北农业科学, 2010, 14(11): 85–88.
Wang Y F, Diao X M. Advances of QTL localization and cloning of genes related to regeneration ability of plant tissue culture., 2010, 14(11): 85–88 (in Chinese with English abstract).
[12] 张献龙, 孙济中, 刘金兰. 陆地棉体细胞胚胎发生与植株再生遗传学报, 1991, 18: 461–467. Zhang X L, Sun J Z, Liu J L. Somatic embryogenesis and plant regeneration in upland cotton., 1991, 18: 461–467 (in Chinese with English abstract).
[13] 董合忠. 不同基因型棉花下胚轴离体培养胚状体发生的研究莱阳农学院学报, 1991, 8(2): 97–101. Dong H Z. Cotton somatic embryogenesis of different genotypes., 1991, 8(2): 97–101 (in Chinese with English abstract).
[14] Ge X Y, Xu J T, Yang Z E, Yang X F, Wang Y, Chen Y L, Wang P, Li F G. Efficient genotype-independent cotton genetic transformation and genome editing, 2022, 65: 907–917.
[15] Bolibok H, Rakoczy-Trojanowska M. Genetic mapping of QTLs for tissue-culture response in plants, 2006, 149: 73–83.
[16] Zhao L N, Zhou H J, Lu L X, Liu L L, Li X H, Lin Y J, Yu S B. Identification of quantitative trait loci controlling rice mature seed culturability using chromosomal segment substitution lines, 2009, 28: 247–56.
[17] Jin S X, Zhang X L, Liang S G, Nie Y C, Guo X P, Huang C. Factors affecting transformation efficiency of embryogenic callus of upland cotton () with, 2005, 81: 229–237.
[18] Li J Y, Wang M J, Li Y J, Zhang Q H, Lindsey K, Daniell H, Jin S X, Zhang X L. Multi-omics analyses reveal epigenomics basis for cotton somatic embryogenesis through successive regeneration acclimation process, 2019, 17: 435–450.
[19] 李雪林, 王翠玲, 孟超敏. 高频体细胞胚胎发生的优异棉花种质材料筛选分子植物育种, 2012, 10: 683–688. Li X L, Wang C L, Meng C M. Screening elite cotton germplasm with high frequency somatic embryogenesis., 2012, 10: 683–688 (in Chinese with English abstract).
[20] Tsukaya H. Mechanism of leaf-shape determination, 2006, 57: 477–496.
[21] Wang H F, Kong F J, Zhou C E. From genes to networks: The genetic control of leaf development, 2021, 63: 1181–1196.
[22] Zhu Q H, Zhang J, Liu D X, Stiller W, Liu D J, Zhang Z S, Llewellyn D, Wilson L. Integrated mapping and characterization of the gene underlying the okra leaf trait inL., 2016, 67: 763–774.
[23] Gelvin S B. Integration ofT-DNA into the plant genome, 2017, 51: 195–217.
[24] 李静, 张换样, 朱永红, 吴慎杰, 焦改丽. 农杆菌介导棉花遗传转化的影响因素南方农业, 2020, 14(8): 8–12. Li J, Zhang H Y, Zhu Y H, Wu S J, Jiao G L. Influencing factors of-mediated genetic transformation in cotton., 2020, 14(8): 8–12 (in Chinese with English abstract).
Screening of regeneration capacity and genetic transformation efficiency in recombinant inbred lines ofL
LE Yu, WANG Tao, ZHANG Xian-Long, and LIN Zhong-Xu*
College of Plant Science & Technology, Huazhong Agricultural University / National Key Laboratory of Crop Genetic Improvement, Wuhan 430070, Hubei, China
Transgenic engineered breeding is an effective way of cotton germplasm innovations. In order to expand the renewable genotypes of upland cotton and to enrich cotton transgenic receptors, we constructed an F9recombinant inbred population (YE) by the single-seed descent method using the high-yielding broad leaf cotton variety Emian 22 (E22) from Hubei province as the male parent and the high regeneration-capable okra leaf variety Yuzao 1 (YZ1) as the female parent. We compared the callus induction rate (CIF), callus secondary fecundity (CSC), embryo rate of callus (CRE), and callus embryo time (CET) of 164 recombinant inbred lines using two different hormone combinations of IBA+KT (IK) and 2,4-D+KT (DK), respectively, which were mature tissue culture systems in cotton. A total of 12 regenerable broad leaf lines were obtained and evaluated for the genetic transformation efficiency using the current mature genetic transformation system in cotton; meanwhile, agronomic traits of these lines were investigated. Finally, a family line YE3, with a genetic transformation efficiency of 82.9% and better agronomic traits, was obtained. This study develops a new genotype of upland cotton, which will facilitate the genetic transformation and gene function research of cotton.
cotton; RILs; somatic embryogenesis; regeneration capacity; transformation efficiency
10.3724/SP.J.1006.2024.34167
本研究由国家自然科学基金项目(32172025)资助。
This study was supported by the National Natural Science Foundation of China (32172025).
林忠旭, E-mail: linzhongxu@mail.hzau.edu.cn
E-mail: leyu_hzau@163.com
2023-10-16;
2024-01-12;
2024-02-07.
URL: https://link.cnki.net/urlid/11.1809.S.20240205.1152.008
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

