111例侵袭性肺曲霉病(IPA)的临床特征及预后风险因素
叶乃芳,龚 真,唐 伟,李 昕,储雯雯,刘 周,周 强
(安徽医科大学第二附属医院检验科,安徽 合肥 230601)
侵袭性肺曲霉病(invasive pulmonary aspergi-llosis, IPA)是由曲霉属侵入肺组织、血管引起一系列炎症反应的肺部感染性疾病。据估计,全球2017年发生侵袭性真菌病病例超过180万例,其中约25万例为IPA[1]。近年来,由于实体肿瘤、白血病患者增多,各种侵入性操作的开展及免疫制剂和糖皮质激素的长期使用,使IPA发病率有所升高[2-3]。IPA患者早期临床表现不典型,一旦侵袭部位较深,则治疗难度较大,治疗成本高且疗效差。近年来,临床工作者发现流感病毒感染或新型冠状病毒(新冠)感染合并曲霉感染后病死率较高,已引起人们的重视。国内新冠疫情后期关于IPA临床特征、实验室检查及预后的文献报道较少。本研究探讨某医院收治的IPA患者的临床特征、实验室检查及预后情况,旨在提供可靠的临床依据。
1 对象与方法
1.1 研究对象 研究纳入某医院2020年9月—2023年6月符合IPA诊断的住院患者。诊断标准参照2007年我国《肺真菌病诊断和治疗专家共识》及2020年欧洲癌症研究和治疗组织(EORTC)及真菌研究组教育与研究共同体(MSGERC)关于侵袭性真菌病定义共识的修订及更新[4]。IPA患者的诊断分为确诊(proven)、拟诊(probable)及疑诊(possible)。本研究纳入确诊和拟诊的住院患者。IPA确诊要求呼吸道标本细菌和真菌涂片、培养及高分辨CT检测符合IPA诊断标准,同时有组织病理学证据。拟诊需具备1项宿主因素,1项临床特征,以及1项微生物学依据。
宿主因素应至少符合以下一项:(1)中性粒细胞减少(低于0.5×109/L),持续>10 d;(2)血液系统恶性疾病;(3)接受同种异体造血干细胞移植;(4)接受实体器官移植;(5)60 d内以≥0.3 mg/kg治疗剂量使用皮质类固醇≥3周;(6)90 d内使用T细胞免疫抑制剂;(7)使用识别B细胞免疫抑制剂;(8)遗传性严重免疫缺陷病;(9)累及肠道、肺或肝的急性移植物抗宿主病Ⅲ级或Ⅳ级,用类固醇一线药物治疗无效;(10)艾滋病患者;(11)体温>38℃或<36℃,伴有慢性基础疾病;(12)体温>38℃或<36℃,伴有创伤、大手术、长期住重症监护病房(ICU)、长时间机械通气、留置导管、全胃肠外营养和长期使用广谱抗菌药物等(具备其中任何1项)。
临床特征应至少符合一项主要特征或者两项次要特征。主要特征:感染早期胸部X线和CT检查可见胸膜下密度增高的结节影,病灶周围可出现晕轮征;发病10~15 d后,肺实变区液化、坏死,胸部X线和CT检查可见空腔阴影或新月征。次要特征:(1)持续发热>96 h,经积极的抗细菌感染治疗无效;(2)具有肺部感染的症状及体征,包括咳嗽、咳痰、咯血、胸痛、呼吸困难、肺部啰音或胸膜摩擦音等体征;(3)影像学检查可见除主要临床特征之外的、新的非特异性肺部浸润影。
微生物学依据应至少符合以下一项:(1)气管内吸引物或合格痰标本直接镜检发现菌丝,且连续≥2次培养分离到同种真菌;(2)支气管肺泡灌洗液经直接镜检发现菌丝,且真菌培养阳性;(3)血清、肺泡灌洗液(1,3)-β-D-葡聚糖抗原检测(G试验)连续2次阳性;(4)血清、支气管肺泡灌洗液半乳甘露聚糖抗原检测(GM试验)连续2次阳性。
1.2 研究方法
1.2.1 临床信息 收集患者临床数据,包括患者的性别、年龄、科室、CT特征、宿主因素、用药情况等,根据患者预后情况分为预后良好或预后不良,预后不良包括住院期间死亡和因病情恶化放弃治疗出院。
1.2.2 病原学检查 所有研究对象均送检呼吸道标本进行真菌培养,呼吸道标本包括气管内吸引物、合格痰或支气管肺泡灌洗液。送检标本接种于血平板及沙保弱培养基于35℃孵育培养48 h,对生长的菌落进行乳酸酚棉兰染色及质谱鉴定,质谱鉴定应用布鲁克MALDI Biotyper质谱鉴定仪。部分患者可同时送检血和支气管肺泡灌洗液,通过丹娜全自动酶联免疫分析仪(HB-100E)进行G试验、GM试验。
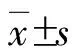
2 结果
2.1 临床资料、科室来源及菌种分布 2020年9月—2023年6月该院共诊治111例IPA患者,均为临床拟诊。
IPA患者年龄为(68.8±12.5)岁,其中男性70例(63.1%),女性41例(36.9%)。111例患者均合并其他疾病,其中合并高血压41例(36.9%),心血管疾病35例(31.5%),糖尿病34例(30.6%),病毒感染25例(22.5%),慢性阻塞性肺疾病19例(17.1%),血液系统恶性肿瘤18例(16.2%),脑血管疾病11例(9.9%),实体肿瘤9例(8.1%),部分患者同时合并2种以上疾病。
IPA患者主要来源于呼吸科(31例, 27.9%)、ICU(28例, 25.2%)、血液内科(15例, 13.5%)、感染科(10例, 9.0%)、肿瘤科(7例, 6.3%)、肾脏内科(5例, 4.5%)、外科(4例, 3.6%)、急诊内科(3例, 2.7%)等科室。
111例IPA患者中检出曲霉株数占比最高的是烟曲霉(67.6%),其次是黄曲霉(19.8%)及黑曲霉(4.5%)。见表1。

表1 111例IPA患者检出曲霉属曲霉分布情况
2.2 临床表现、影像学及实验室检查 IPA患者临床症状多以咳嗽、胸闷为主要表现,其中反复咳嗽、咳痰75例(67.6%),胸闷气急45例(40.5%),发热40例(36.0%),咯血9例(8.1%),胸背部疼痛8例(7.2%)。
影像学特征出现斑片状渗出或实变性改变83例(74.8%),肿块或结节24例(21.6%),胸腔积液23例(20.7%),空洞15例(13.5%),新月征15例(13.5%)。
111例IPA患者中有61例患者进行支气管肺泡灌洗液、连续两次血清G试验检查,阳性率分别为73.7%(45例)、63.9%(39例);75例患者进行支气管肺泡灌洗液、连续两次血清GM试验检查,阳性率为68.0%(51例)、54.7%(41例)。
2.3 宿主因素及合并病毒感染情况 111例IPA患者宿主因素包括:(1)中性粒细胞缺乏持续>10 d 13例(11.7%);(2)血液系统恶性疾病18例(16.2%);(3)接受同种异体造血干细胞移植1例(0.9%);(4)连续使用糖皮质激素3周39例(35.1%);(5)过去90 d内使用免疫抑制剂23例(20.7%);(6)体温>38℃或<36℃,伴有慢性基础疾病74例(66.7%);(7)体温>38℃或<36℃,伴有创伤、大手术、长期住ICU、长时间机械通气、留置导管、全胃肠外营养和长期使用广谱抗菌药物任一因素74例(66.7%)。
25例合并病毒感染的IPA患者中,包括新冠10例(9.0%),新型布尼亚病毒7例(6.3%),EB病毒5例(4.5%),甲型流感病毒、人类疱疹病毒、汉坦病毒各1例(各占0.9%)。
2.4 治疗情况及预后 所有患者均进行抗真菌治疗,其中应用伏立康唑91例(81.9%),卡泊芬净11例(9.9%),泊沙康唑5例(4.5%),伊曲康唑2例(1.8%),两性霉素B 2例(1.8%),5例(4.5%)患者联合使用两种抗真菌药物。
经过治疗、随访,预后不良患者共32例(28.8%)。25例合并病毒感染患者中,12例患者30 d内死亡,10例合并新冠感染患者中6例死亡,病死率达60.0%。
对预后不良患者与预后良好患者进行logistic单因素分析,发现合并病毒感染,留置胃管、导尿管、中心静脉置管、体腔引流管,机械通气及连续3周使用糖皮质激素史与患者预后不良有关(均P<0.05),见表2。logistic多因素回归分析显示合并病毒感染、连续3周使用糖皮质激素史、机械通气及留置导尿管是患者预后不良的独立危险因素(均P<0.05),见表3。
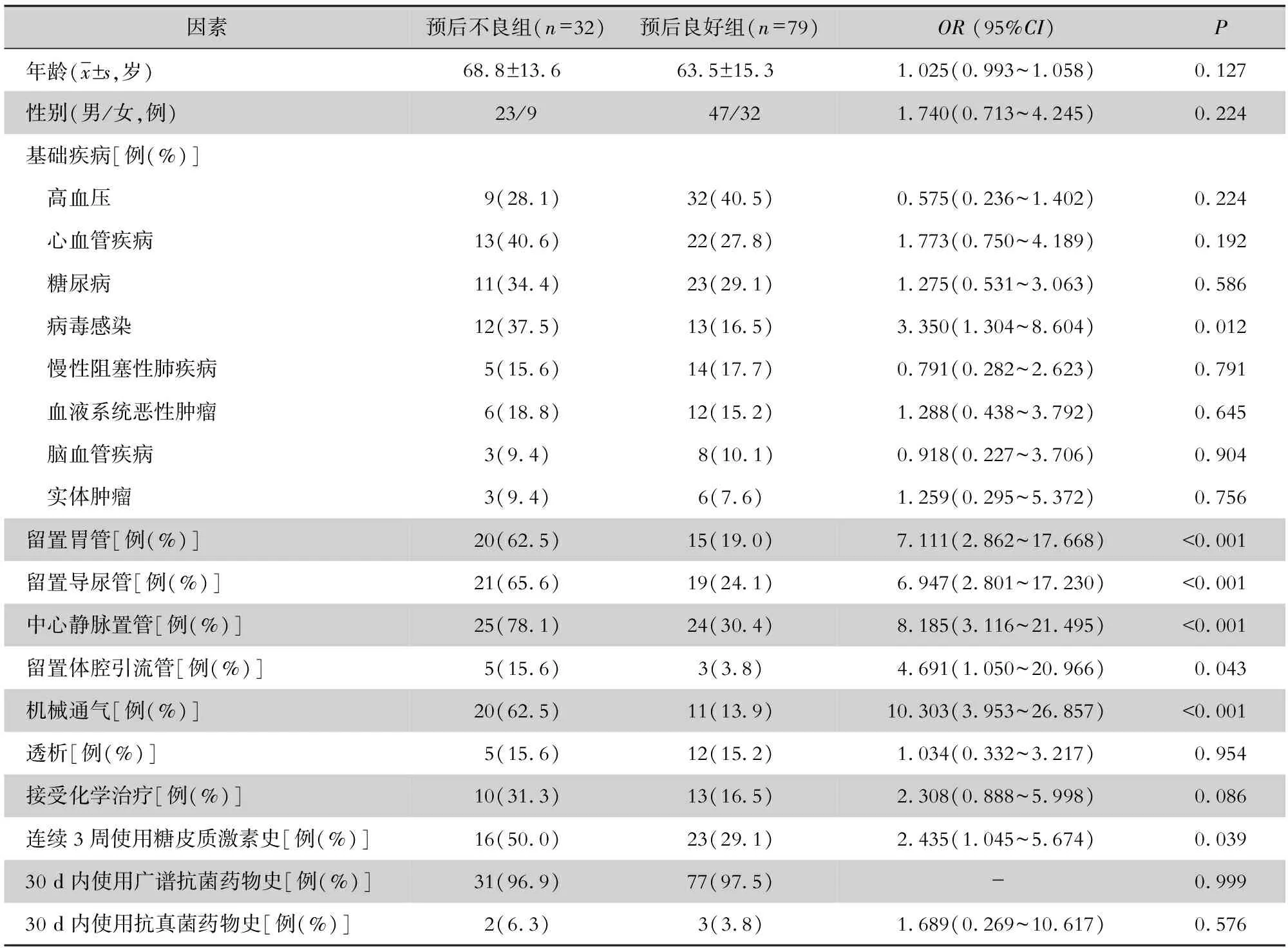
表2 IPA患者预后单因素logistic回归分析
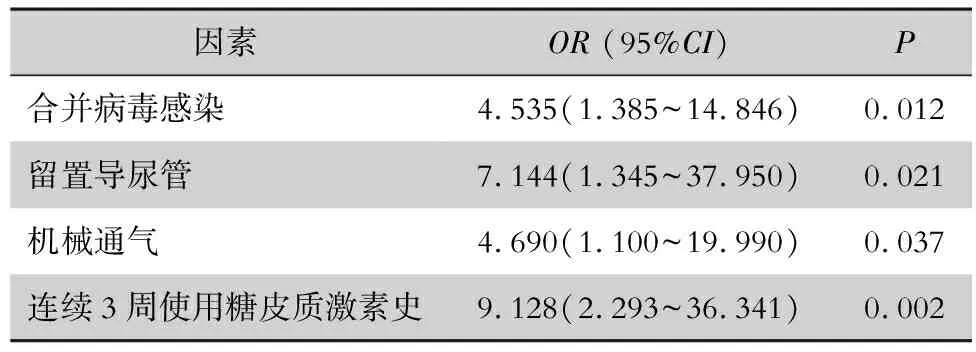
表3 IPA患者预后多因素logistic回归分析
3 讨论
IPA是由大量曲霉孢子经呼吸道侵入肺部引起组织损伤的深部真菌感染性疾病,常继发于严重血液系统恶性肿瘤、粒细胞缺乏、实体器官移植,以及接受免疫制剂和糖皮质激素治疗的患者[5]。近年来,IPA发生的危险因素也在不断演变,新发现的危险因素包括新型生物制剂的应用、合并流感病毒及新冠感染等[6-7]。IPA患者早期症状不典型,可单纯表现为咳嗽、咳痰,与普通呼吸道感染症状类似,其临床诊断需要微生物学证据、影像学特征,以及临床症状和体征,诊断相对困难。支气管肺泡灌洗液GM检测被指南推荐为早期诊断的检查。然而,IPA确诊需要组织病理学证据,但很多危重患者无法进行纤维支气管镜及肺穿刺活检等有创检查,组织病理学证据获取较为困难[8]。
本研究通过呼吸道痰标本或支气管肺泡灌洗液标本培养,联合形态学和基质辅助激光解析电离飞行质谱(MALDI-TOF MS)检测进行诊断,并鉴定曲霉属种,结果显示,烟曲霉是引起IPA的主要病原体(67.6%),其次是黄曲霉(19.8%),与国内外相关研究[9-10]结果一致。华山医院的调查研究[10]显示,深部曲霉感染患者多来源于感染科、呼吸科和ICU。本研究发现IPA患者最常见于呼吸科(27.9%)、ICU(25.2%)、血液内科(13.5%)、感染科(9.0%),与华山医院的研究结果基本一致。IPA患者以老年男性居多,考虑与患者合并基础疾病、免疫功能受损且接受侵入性操作有关。25例患者合并病毒感染,其中10例合并新冠感染,且6例患者死亡,考虑曲霉感染易引起新冠肺炎患者发生急性呼吸窘迫综合征,导致患者死亡。
美国感染病学会依据循证医学推荐伏立康唑作为IPA患者治疗的首选方案[11],其次是卡泊芬净和泊沙康唑。本研究结果显示,IPA患者经过系统性治疗,仍有28.8% 预后不良,与研究[12]报道的117例IPA患者中32例(27.4%)患者在随访期间死亡基本一致。也有其他文献[13-14]显示预后不良患者占比较高,肾移植患者合并IPA人群总病死率可达57.5%[14],考虑与本研究纳入患者的基础疾病不同有关。
高龄、入住ICU、各种侵入性操作及进行糖皮质激素治疗是IPA患者预后不良的危险因素[15-17]。本研究发现合并病毒感染、使用糖皮质激素史、机械通气及留置导尿管是IPA患者预后不良的独立危险因素。值得注意的是,本研究中10例新冠感染相关肺曲霉病的病死率高达60.0%,高于单纯的新冠肺炎,对患者构成严重威胁。新冠感染可损伤自身免疫系统,包括上皮细胞、巨噬细胞和中性粒细胞,从而诱发曲霉感染[18],因此,对此类患者早期进行呼吸道病毒及GM试验筛查,识别并尽早启动相关治疗非常重要。此外,本研究有部分患者合并血液病、慢性阻塞性肺疾病、风湿免疫系统疾病,这部分患者长期接受糖皮质激素治疗,可导致机体免疫力低下、菌群失调,容易发生真菌感染。有创操作可破坏机体机械屏障、微生物屏障、免疫屏障等,容易导致患者在原发病基础上发生IPA,预后更差。
本研究存在一些局限和不足。作为单中心研究,本研究结果可能因医院临床诊疗方式及医疗政策等诸多因素影响,不能完全准确地反映当地IPA患者的临床特征。后期可进一步开展安徽省多中心的临床流行病学研究,以获取更加准确的IPA流行病学和临床特征。综上所述, IPA患者早期诊断较困难,病原体以烟曲霉为主,部分患者预后不良,合并病毒感染、使用糖皮质激素史、机械通气及留置导尿管是患者预后不良的独立危险因素。针对上述问题,建议临床采取多种检验手段相结合的方式早期诊断IPA;同时,通过风险因素分析,识别容易发生IPA的重点科室及高危因素,及时启动抗真菌治疗,改善患者预后。
利益冲突:所有作者均声明不存在利益冲突。

