新型冠状病毒肺炎所致凝血功能障碍及其对预后的影响
孙玉,郭守玉,龙明智
(南京医科大学第二附属医院心血管内科,南京 210000)
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)感染患者常以咽痛、干咳、发热等为首发症状[1],具有自限性,大多数患者预后较好,合并心肺基础疾病的老年患者可发展至重症,常在发病数天后出现呼吸困难、低氧血症,严重者可出现急性呼吸窘迫综合征[2]、出凝血平衡失调[3]、多器官功能衰竭[4]等。相关研究[5]显示COVID-19感染后患者会出现血浆纤维蛋白(原)降解产物(fibrin degradation products,FDPs)、D-二聚体水平显著升高,且升高水平与疾病恶化呈正相关。本研究对不同危重程度的COVID-19感染患者的凝血指标特点进行分析,探讨D-二聚体、FDPs对COVID-19感染患者病情的预测价值。
1 对象与方法
1.1 研究对象
选取2022年12月至2023年1月南京医科大学第二附属医院收治的100例根据《新型冠状病毒感染诊疗方案(试行第十版)》[1]临床确诊为COVID-19感染的患者作为研究对象,根据病情严重程度分为3组。(1)轻型组:患者仅出现咽干、咽痛、咳嗽、发烧等上呼吸道感染症状,共29例。(2)中型组:患者出现持续高热>3d或(和)咳嗽、气促等,呼吸频率(respiratory rate, RR)<30次/min、静息状态下吸空气时指氧饱和度>93%,影像学可见特征性COVID-19感染肺炎表现,共40例。(3)重型组/危重型:重型诊断标准为患者出现RR≥30次/min;指脉氧饱和度≤93%;氧合指数≤300mmHg(1mmHg=0.133kPa);临床症状进行性加重,肺部影像学显示1~2d内病灶明显进展>50%。危重型诊断标准为出现呼吸衰竭需要机械通气;出现休克;合并其他器官功能衰竭需重症监护治疗,共31例。排除标准:COVID-19感染诊断不明确及缺乏关于凝血指标的信息。
1.2 方法
比较3组COVID-19感染患者的一般资料及凝血指标特点。(1)一般资料:性别、年龄、既往基础疾病史等;(2)入院时实验室检查:D-二聚体、FDPs、血小板计数(platelet,PLT)、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT);(3)临床结局:病情改善、死亡。
1.3 统计学处理

2 结 果
2.1 3组患者一般资料比较
重型/危重型组高龄患者比例显著高于轻型组和中型组(P<0.01);重型/危重型组合并高血压、冠心病比例高于轻型组和中型组(P<0.05),且与轻型组和中型组相比,重型/危重型组死亡率显著升高,差异有统计学意义(P<0.01)。3组患者性别、糖尿病及肺部疾病所占比例比较,差异无统计学意义(表1)。
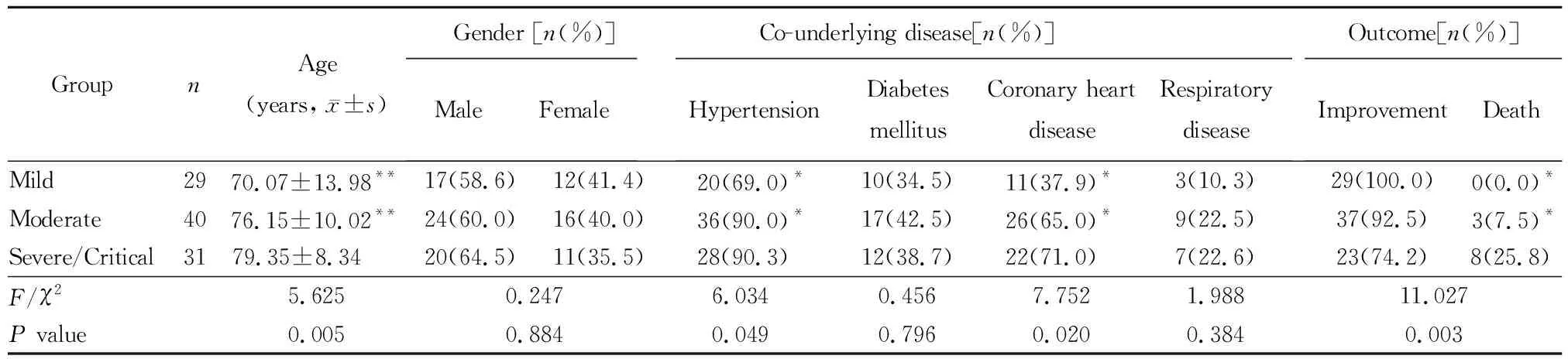
表1 3组患者一般临床资料比较Table 1 Comparison of general clinical date of patients among three groups
2.2 3组患者凝血指标水平比较
中型组患者血浆FDPs水平高于轻型组(P<0.05),重型/危重型组患者血浆FDPs、D-二聚体水平显著高于轻型组(P<0.01),中型组与重型/危重型组患者血浆FDPs、D-二聚体水平差异无统计学意义(P>0.05);不同组PLT、PT、APTT水平比较,差异无统计学意义(表2)。
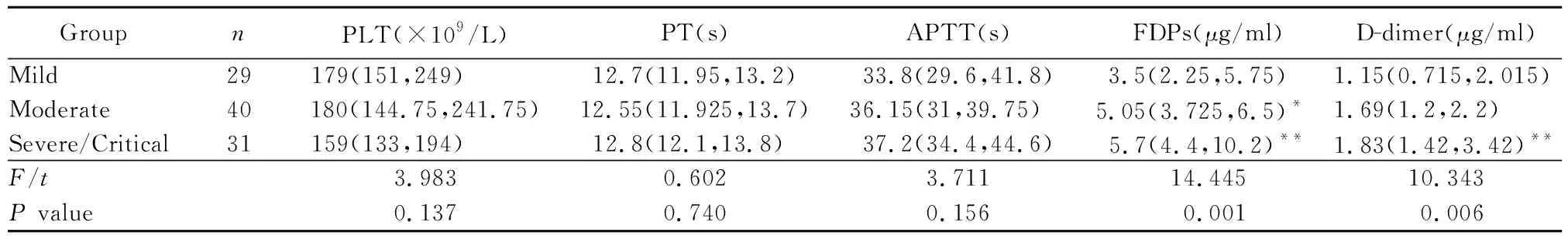
表2 3组患者凝血指标水平比较Table 2 Comparison of coagulation indexes among three groups [M(Q1, Q3)]
2.3 ROC曲线分析
FDPs、D-二聚体、年龄、FDPs与D-二聚体两项联合分析及三项联合的ROC曲线下面积(area under curve, AUC)分别为0.785(95%CI0.645~0.926;P<0.01)、0.811(95%CI0.691~0.03;P<0.01)、0.725(95%CI0.558~0.891;P<0.05)、0.766(95%CI0.581~0.951;P<0.05)、0.875(95%CI0.789~0.962;P<0.01;图1,表3)。并通过霍斯默-莱梅肖拟合优度检验来评估FDPs、D-二聚体及年龄三项联合预测模型的校准能力,结果显示霍斯默-莱梅肖检验χ2=2.414,P=0.966>0.05,提示模型预测值与实际观测值之间的差异无统计学意义,预测模型有较好的校准能力。

图1 FDPs、D-二聚体、年龄、FDPs和D-二聚体两项联合以及三项联合对预测COVID-19感染患者病死的价值Figure 1 FDPs, D-dimer, age, the combination of FDPs and D-dimer, and combination of FDPs, D-dimer and age in predicting death of patients with COVID-19 FDPs: fibrin degradation products; COVID-19: coronavirus disease 2019.
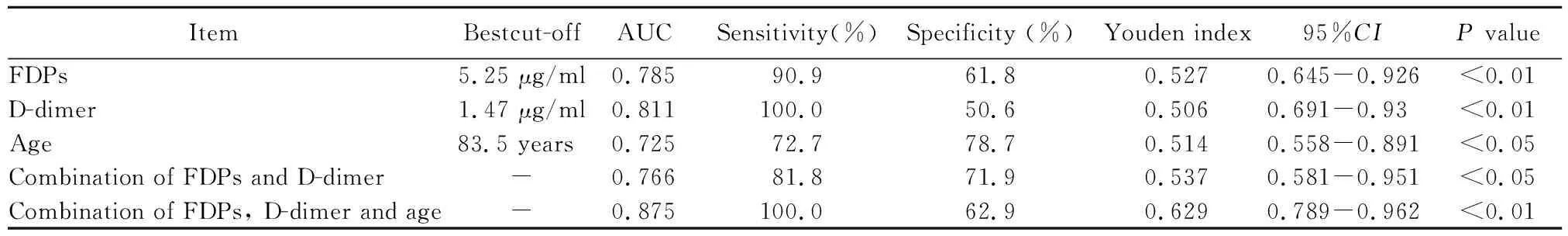
表3 FDPs、D-二聚体、年龄及联合分析对预测COVID-19感染患者病死的诊断价值Table 3 Diagnostic value of FDPs, D-dimer, age and combinations in predicting death of patients with COVID-19
3 讨 论
COVID-19是一种正单链RNA病毒颗粒,含有刺突蛋白(S蛋白)、包膜蛋白(E蛋白)、膜蛋白(M蛋白)、核壳蛋白(N蛋白)4种结构蛋白[1]。侵入人体呼吸道后,依靠S蛋白的受体结合域识别并结合宿主细胞血管紧张素转化酶2(angiotensin converting enzyme 2, ACE2)受体,从而感染宿主细胞[6]。ACE2受体遍布于心、肺、肝、肾等全身器官,感染后COVID-19直接侵袭内皮细胞,促炎细胞因子的释放[7],内皮功能障碍促进全身凝血,造成机体高凝状态[9],易形成微循环血栓[9]、致通气/血流失衡。瑞典研究团队[10]发现近20%的COVID-19感染者会出现凝血功能异常,几乎所有重型和危重型患者存在凝血功能紊乱。D-二聚体、FDPs水平升高反应机体凝血功能障碍或血栓生成[11]。
研究表明在COVID-19早期D-二聚体、FDPs水平显著升高,D-二聚体升高3~4倍提示预后不良,从疾病早期监测D-二聚体等凝血指标有助于评估COVID-19感染的进展[12]。本研究对100例COVID-19感染患者凝血指标进行分析,探索D-二聚体、FDPs水平对患者病情的预测价值。研究结果显示:与轻型组和中型组相比,重型/危重型组患者高龄、合并高血压、冠心病比例及死亡率增加;中型组患者血浆FDPs、重型/危重型组患者血浆D-二聚体、FDPs均高于轻型组;该结果提示年龄越大,FDPs、D-二聚体水平越高,合并有心血管疾病的COVID-19感染患者病情进展、死亡风险越高。
COVID-19感染所致凝血功能障碍与弥散性血管内凝血或其他病原体引起的凝血功能障碍相比,D-二聚体、FDPs水平往往更高或更早出现[13]。本研究ROC曲线分析结果显示,D-二聚体具有高灵敏度(100.0%)及较低特异度(50.6%),与其他评估D-二聚体和COVID-19的研究结果相符[14],提示D-二聚体是判断COVID-19感染患者血栓性疾病的有效排除性工具。Tang等[15]发现在严重COVID-19肺炎死亡病例中FDPs、D-二聚体均明显升高;本研究初步将FDPs、D-二聚体联合分析后发现特异度升高,但AUC及灵敏度降低,针对此结果本研究后续将年龄纳入进行三项联合后的ROC曲线分析显示AUC升高,灵敏度仍为100.0%,虽然特异度较年龄单项分析有所下降,但可补足不同指标之间假阳性或假阴性的缺点,有效提高对疾病的诊断准确率,对于临床诊疗具有重要意义。新入院COVID-19感染的高龄患者应迅速检测其凝血指标水平,评估预后并尽早予以对症治疗,避免漏诊误诊可能,进一步提示D-二聚体、FDPs水平以及患者高龄是有效预测COVID-19感染患者病情的重要因素。
多项尸检报告证实COVID-19肺炎患者死亡的主要原因是血栓引起的肺栓塞[16,17]。对于COVID-19感染患者预防性抗凝治疗目前虽有争议[18],但对于重型患者而言,积极、早期予以抗凝剂(如低分子肝素和新型口服抗凝剂)治疗具有必要性。相关研究显示,具有深静脉血栓风险的COVID-19感染患者使用抗凝剂可以降低死亡率[19]。同时,国内外的专家共识或指南[20,21]提出在没有禁忌证的情况下将低分子肝素作为一线治疗,待病情平稳后可换用新型口服抗凝剂。本研究团队针对COVID-19感染患者治疗的后续研究结果初步提示抗凝治疗的疗效显著,有待更多临床数据进一步证实。
综上,随着COVID-19感染患者病情进展,体内出凝血平衡失调,血栓形成风险增加,纤溶亢进,D-二聚体、FDPs水平升高更明显。因此,本研究认为D-二聚体、FDPs水平与COVID-19感染患者病情严重程度及不良预后具有一定相关性,且高龄、合并基础疾病是促进COVID-19感染病情进展的危险因素。

