基于抗炎效应成分指数的金银花配方颗粒质量评价研究
贾金浩,陈小菲,李寒冰,李伟霞,王晓艳,张 辉,张明亮,汪 彬,韩 冰,纪秋如,肖小河,唐进法, *
基于抗炎效应成分指数的金银花配方颗粒质量评价研究
贾金浩1,陈小菲2, 3,李寒冰2,李伟霞2,王晓艳2,张 辉2,张明亮2,汪 彬1,韩 冰1,纪秋如1,肖小河3*,唐进法1, 2*
1. 河南中医药大学药学院,河南 郑州 450046 2. 河南中医药大学第一附属医院 药学部,河南省中药临床应用、评价与转化工程研究中心,河南省中药临床药学中医药重点实验室,河南 郑州 450000 3. 中国人民解放军总医院第五医学中心,北京 100039
以抗炎为例,建立基于效应成分指数(effect-constituents index,ECI)的金银花配方颗粒质量一致性评价方法。采用超高效液相色谱法测定22批次不同标准(国标/企标)的金银花配方颗粒样品中9种具有抗炎活性的单体成分(新绿原酸、绿原酸、隐绿原酸、断马钱子酸、断氧化马钱子苷、木犀草苷、异绿原酸B、异绿原酸A、异绿原酸C)含量,采用环氧合酶-2(cyclooxygenase-2,COX-2)试剂盒测定上述样品的抗炎效价和相关单体成分的半数抑制浓度(half inhibitory concentration,IC50),进而整合分析获取上述各个成分的抗炎效价权重系数,通过权重系数和效价整合计算得到ECI,最后通过细胞实验验证所构建的ECI的可行性。抗炎成分含量测定结果显示,9种单体成分含量存在较大的差异,其中国标批次(S1~S11)和企标批次(S12~S22)在单体成分的含量高低也存在显著差异,如国标批次(S8)中绿原酸的含量是企标批次(S16)中该成分含量的3.3倍(43.0612.98 mg/g)。国标(S1~S11)样品的整体稳定性与企标(S12~S22)样品相差不大(RSD国标=211.55,RSD企标=215.71)。生物效价测定方法通过了方法学考察,结果显示国标样品的抗炎效价和稳定性比企标更好(效价国标=100.28~106.35 U/mL,效价企标=88.06~95.49 U/mL;RSD国标=1.98,RSD企标=2.56)。ECI理论计算结果显示该方法结果与实验结果一致,能够反映金银花配方颗粒样品的药效关系(ECI国标=10.82~14.11,ECI企标=9.32~12.58;RSD国标=9.51,RSD企标=10.02)。相关性分析显示单一指标性成分的含量与抗炎效价之间正相关性较好的是绿原酸(=0.644),其次是木犀草苷(=0.581),说明这2个成分在抗炎活性中起主要作用。以抗炎为例,建立基于效应成分指数的金银花配方颗粒质量评价方法。可应用于多批次不同标准(国标/企标)的金银花配方颗粒的质量一致性评价,为其他具有类似抗炎作用的中药配方颗粒的质量评价研究及应用提供科学参考。
质量评价;效应成分指数;抗炎;金银花;配方颗粒;新绿原酸;绿原酸;隐绿原酸;断马钱子酸;断氧化马钱子苷;木犀草苷;异绿原酸B;异绿原酸A;异绿原酸C
符合中医药特点的质量评价模式是中药质量研究中的重点和难点,同时也是限制中药现代化发展的关键问题之一[1]。目前中药质量评价研究有了全方位的进步,从整体上对中药质量评价水平进行了提升[2]。现行中药质量控制的基本模式参照国外植物药的质量控制方法,借鉴化学药质量控制的模式所建立,化学定性鉴别与指标成分检测是其主要内容[3]。然而,仅基于化学基准的中药质量控制模式存在指标性成分难以全面地反映整体质量、与临床有效性及安全性关联不够紧密、不能充分体现中医药特色等问题,仍存在较大的局限性[4]。生物效价是可以评估药物对生物体的活性和效果,评价药物有效性或毒性的方法,推动中药质量标准走进临床、关联疗效的关键举措[5]。将多组分化学表征和生物效价检测联用模式,以效应成分指数(effect-constituents index,ECI)为指标作为中药质量评价的方法越来越受到专家的共识,同时也为中药质量评价提供一种新的参考研究模式和分析方法。
ECI是一种质量控制综合量化的评价指标,可以解决质量差异对临床疗效稳定性的影响[6]。该方法融合了化学评价的精准性和可行性的优势与生物评价关联功效和安全性的技术优势,实现了通过化学成分检测即可评价中药的药效品质。ECI方法操作简便,测定一定的效应成分的量同时测定这些成分的效应值后,建立数学模型对效应成分赋予一定的权重进行评价,即可实现通过测定成分的量而体现中药之“效”,更有集成性和综合性的特点[7]。ECI还可以为中药质控指标的选择提供了强有力的证据,效应权重大小直接说明了成分的活性大小或效应指标的贡献度大小[8]。ECI方法的主要限制和挑战是如何确证药材中与临床活性相关联的活性成分以及这些活性成分之间的协同或拮抗作用如何表征[9]。
中药配方颗粒是饮片的一种新的形式,是将单味中药饮片经提取、浓缩、干燥等工艺制成的单味中药产品,具有使用方便、疗效确切等优点[10],发展中药配方颗粒行业是推动我国中医药现代化的重要举措[11]。金银花为忍冬科植物忍冬Thunb.的干燥花蕾或带初开的花,具有清热解毒、凉散风热的功效,在中药处方中具有悠久的使用历史。金银花是最常用于清热解毒的传统中药之一,现代药理学研究表明金银花具有抗炎的作用,可以认为抗炎是金银花清热解毒的药理学基础[12-14]。因此本研究以金银花抗炎活性表征其清热解毒活性,建立基于抗炎ECI的金银花配方颗粒质量评价方法,并应用于多批次不同标准的金银花配方颗粒的质量一致性评价,以期为中药配方颗粒的质量评价的研究及应用提供科学参考。
1 材料
1.1 细胞
小鼠单核巨噬细胞系RAW264.7购自上海信裕生物科技有限公司。
1.2 药品与试剂
金银花配方颗粒共收集到3个厂家生产的22批样品,编号为S1~S22,见表1;对照品新绿原酸(批号906-33-2)、绿原酸(批号327-97-9)、木犀草苷(批号5373-11-5)、异绿原酸A(批号89919-62-0)、异绿原酸B(批号14534-61-3)、异绿原酸C(批号57378-72-0)、断氧化马钱子苷(批号58822-47-2)、隐绿原酸(批号905-99-7)、断马钱子酸(批号60077-46-5)购自成都克洛玛生物科技有限公司,质量分数均≥98%;纯净水购自杭州娃哈哈集团有限公司;磷酸(批号4821551)、甲醇(批号11092007019)、乙腈(批号JA100630)均为色谱纯,购自默克股份两合公司;DMEM培养基(批号20230907)、胎牛血清(批号FA35213)、胰酶购自北京索莱宝科技有限公司;PBS(批号20230902)购自江苏凯基生物技术股份有限公司;CCK-8试剂(批号K10182633EF5E)购自美国APExBIO公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒(批号KL01NPJH0657)、白细胞介素-1β(interleukin-1β,IL-1β)试剂盒(批号AK02TDPB4866)、环氧合酶-2(cyclooxygenase-2,COX-2)试剂盒(批号AK04D28J2524)均购自武汉伊莱瑞特生物科技公司;脂多糖(lipopolysaccharides,LPS,批号0000114326)购自美国Sigma公司;COX-2抑制剂筛选试剂盒(批号S0168)购自上海碧云天生物技术有限公司。

表1 22批次金银花配方颗粒信息
1.3 仪器
Waters Acquity UPLC H-Class超高效液相色谱仪(PDA检测器,Empower 2色谱工作站);Waters Acquity UPLC®BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);VARIOSKAN FLASH酶标仪、Multiskan FC酶标仪(美国Thermo Fisher Scientific公司);XS105型十万分之一电子分析天平(梅特勒-托利多公司);KQ-100DE型数显超声波清洗器(昆山市超声仪器有限公司);DZKW-S-6型电热恒温水浴锅(北京市永光明医疗仪器有限公司);BS2000型生物统计软件(中国食品药品检定研究院)。
2 方法
2.1 基于超高相液相色谱(UPLC)的金银花配方颗粒质量评价
2.1.1 色谱条件 Waters symmetry C18Analytical色谱柱(150 mm×4.6 mm,5 μm),流动相为0.1%磷酸水溶液(A)-乙腈(B),梯度洗脱:0~1 min,4%~5% B;1~9 min,5%~6% B;9~13 min,6%~10% B;13~15 min,10%~14% B;15~30 min,14%~17% B;30~33 min,17%~100% B;33~35 min,100% B;35~38 min,100%~4% B。柱温30 ℃;体积流量0.30 mL/min;进样量2 µL;检测波长为238、326、352 nm。
2.1.2 溶液的制备
(1)混合对照品溶液的制备:精密称取新绿原酸、绿原酸、木犀草苷、异绿原酸A、异绿原酸B、异绿原酸C、断氧化马钱子苷、隐绿原酸、断马钱子酸对照品适量,加1 mL 70%甲醇涡旋振荡1 min,4 ℃保存备用。分别吸取以上9个对照品母液适量,配制成质量浓度为1 mg/mL的混合对照品溶液,并按照2、5、10、20、50、100倍数加入70%甲醇稀释,配制成质量浓度为1 000、500、200、100、50、20、10 µg/mL的混合对照品溶液,取200 µL上清液待测。
(2)供试品溶液的制备:取适量22批次金银花配方颗粒研细,精密称定10 mg置EP管中,精密加入70%甲醇2.5 mL,称定质量,500 W、40 kHz超声处理30 min,放冷,再称定质量,用70%甲醇补足减失的质量,滤过,取续滤液,即得供试品溶液,取200 µL上清液待测。
(3)抗炎活性成分溶液的制备:精密称取9种抗炎生物活性成分(新绿原酸、绿原酸、木犀草苷、异绿原酸A、异绿原酸B、异绿原酸C、断氧化马钱子苷、隐绿原酸、断马钱子酸)对照品适量,配制成1 280、320、80、20、5 µg/mL的对照品溶液,涡旋振荡1 min,4 ℃保存备用。
2.1.3 方法学考察
(1)线性关系考察:分别取200 µL质量浓度为1 000、500、200、100、50、20、10 µg/mL的混合对照品溶液,注入UPLC进行测定,记录色谱峰面积。以峰面积为纵坐标(),各样品实际质量浓度为横坐标(),绘制标准曲线。回归方程为新绿原酸=19 408 606.67,绿原酸=20 252 920.63,木犀草苷=15 328 284.49-252.73,异绿原酸A=25 368 359.55,异绿原酸B=20 116 208.37,异绿原酸C=22 615 751.77,断氧化马钱子苷=10 931 506.74-8 461.64,隐绿原酸=15 980 107-4 328.69,断马钱子酸=5 784 352.17。结果表明新绿原酸、绿原酸、木犀草苷、异绿原酸A、异绿原酸B、异绿原酸C、断氧化马钱子苷、隐绿原酸、断马钱子酸在一定质量浓度范围内的线性关系较好,值均大于0.999。
(2)精密度试验:取200 µg/mL的混合对照品溶液,按“2.1.1”项下色谱条件连续进样8次,记录目标化合物的色谱峰面积,计算RSD。结果显示,金银花配方颗粒中新绿原酸、绿原酸、木犀草苷、异绿原酸A、异绿原酸B、异绿原酸C、断氧化马钱子苷、隐绿原酸、断马钱子酸峰面积的RSD分别为0.44%、3.05%、0.22%、0.21%、0.32%、0.29%、0.29%、0.37%、0.94%,表明仪器的精密度良好。
(3)重复性试验:取S4批号的金银花配方颗粒样品适量,平行制备6份供试品溶液,按“2.1.1”项下色谱条件连续进样,记录目标化合物的色谱峰面积,计算RSD。结果显示,金银花配方颗粒中新绿原酸、绿原酸、木犀草苷、异绿原酸A、异绿原酸B、异绿原酸C、断氧化马钱子苷、隐绿原酸、断马钱子酸质量分数的RSD分别为0.32%、0.62%、0.58%、0.62%、0.53%、0.56%、0.57%、0.57%、0.82%,表明该方法重复性较好。
(4)稳定性试验:取S4批号的金银花配方颗粒样品适量,按“2.1.2”项下方法制备供试品溶液,按“2.1.1”项下色谱条件于1、3、6、12、24 h进样,记录目标化合物的色谱峰面积,计算RSD。结果显示,金银花配方颗粒中新绿原酸、绿原酸、木犀草苷、异绿原酸A、异绿原酸B、异绿原酸C、断氧化马钱子苷、隐绿原酸、断马钱子酸在24 h内峰面积的RSD分别为0.79%、1.04%、0.78%、0.62%、0.86%,0.90%、1.12%、1.79%、1.14%,表明供试品溶液在24 h内的稳定性良好。
(5)加样回收率试验:取S4批号的金银花配方颗粒样品粉末,置于5 mL EP管中,分别加入相等质量的对照品(以各化合物的对照品溶液形式加入),最后加入一定量甲醇溶液至总体积为2.5 mL,按“2.1.2”项下方法制备供试品溶液,进样测定,计算回收率和RSD。结果显示,金银花配方颗粒中新绿原酸、绿原酸、木犀草苷、异绿原酸A、异绿原酸B、异绿原酸C、断氧化马钱子苷、隐绿原酸、断马钱子酸的回收率为95.0%~104.9%,RSD分别为0.79%、0.68%、0.78%、0.56%、0.67%、0.91%、1.17%、0.70%、0.59%,表明方法的准确性较好。
2.2 基于抗炎活性生物效价的测定
2.2.1 基于抗炎活性生物效价的方法测定
(1)供试品溶液的制备:取适量22批金银花配方颗粒样品于研钵中均匀混合后,制备成混样,称取1 mg混样,加入1 mL COX-2 Assay Buffer制备成1 mg/mL的混样母液,制备成640、320、160、80、40、20、10、5、2.5 μg/mL的溶液。
(2)工作参照液的制备:以试剂盒中的塞来昔布为工作参照品,20 μL塞来昔布溶液中加入980 μL COX-2 Assay Buffer,再加入640 μg β-环糊精惰性物质,将塞来昔布配制成640 μg/mL的母液,制备成640、320、160、80、40、20、10、5、2.5 μg/mL的溶液。
(3)样品检测:取96孔黑板,空白对照孔加入80 μL COX-2 Assay Buffer、5 μL COX-2 Cofactor工作液、5 μL样品溶剂,100%酶活性对照孔加入75 μL COX-2 Assay Buffer、5 μL COX-2 Cofactor工作液、5 μL COX-2工作液、5 μL样品溶剂,阳性抑制剂对照孔加入75 μL COX-2 Assay Buffer、5 μL COX-2 Cofactor工作液、5 μL COX-2工作液、5 μL塞来昔布,样品孔加入75 μL COX-2 Assay Buffer、5 μL COX-2 Cofactor工作液、5 μL COX-2工作液、5 μL待测样品。混匀,37 ℃孵育10 min。激发波长为560 nm,发射波长为590 nm,进行荧光测定。记录每个样品孔和空白对照孔的平均荧光值(RFU),计算每个样品的抑制率。
抑制率=(RFU100%酶活性对照-RFU样品)/(RFU100%酶活性对照-RFU空白对照)
2.2.2 基于抗炎活性生物效价方法的建立
(1)工作对照品的赋值:选用试剂盒中的塞来昔布为工作对照品,约定其效价为100 U/mL作为金银花供试品溶液的参照效价,通过与工作对照品约定的效价对比来评价各批次金银花供试品的品质。
(2)线性关系考察:供试品溶液、工作参照液质量浓度为640、320、160、80、40、20、10、5、2.5 μg/mL,按照生物效价测定方法测定每个质量浓度的吸光度()值,计算COX-2酶抑制率,考察抑制率与对数剂量之间是否呈良好的对称“S”形曲线,来确定选取质量浓度在2.5~640.0 μg/mL与抑制率是否具有良好的线性关系。
(3)可靠性检验:经量效关系考察,条件优化后,选取剂间比为1∶0.125的低、中、高浓度作为金银花配方颗粒抗炎生物效价测定浓度,通过BS2000生物统计软件,选用量反应平行线(3.3)法,输入T估计效价为100 U/mL,T最大剂量为320 μg/mL,S最大剂量为320 μg/mL,剂间比为1∶0.125,并输入低、中、高浓度供试品溶液、工作参照液样品的抑制率,采用完全随机设计实验,计算得到可靠性检验结果。
(4)方法学考察:方法学考察分为精密度考察、重复性考察和稳定性考察,主要对仪器的精密度是否良好、方法的重复性是否良好、供试品溶液的配置时间等因素进行考察。
精密度考察:选取低、中、高质量浓度分别为5、40、320 μg/mL的供试品溶液、工作参照液测定浓度,以工作参照液为S组,供试品溶液为T组,通过BS2000生物统计软件,选用量反应平行线3.3法,输入T估计效价为100 U/mL,T最大剂量为320 μg/mL,S最大剂量为320 μg/mL,剂间比为1∶0.125,并输入低、中、高质量浓度供试品溶液、工作参照液的抑制率,采用完全随机设计实验,计算得到效价值(Pt),连续测定6次。结果显示,连续6次测定均能够通过可靠性检验,求得效价的RSD值为2.51%,说明仪器的精密度良好。
重复性考察:选取低、中、高质量浓度分别为5、40、320 μg/mL的供试品溶液、工作参照液测定浓度,平行制备6份,同精密度考察方法连续进行6次测定。结果显示,供试品溶液均通过可靠性检验,效价的RSD值为1.64%,表明方法重复性良好。
稳定性考察:选取低、中、高质量浓度分别为5、40、320 μg/mL的供试品溶液、工作参照液测定浓度,平行制备4份,分别于制备好后的0、1、2、3、4 h,同精密度考察方法进行测定。结果显示,5次测定的效价的RSD值为1.19%。表明为了保证结果的准确可靠,供试品最好现配现用。
(5)样品的测定:分别制备供试品溶液、工作参照液,以工作参照液为S组,供试品溶液为T组,通过BS2000生物统计软件,选用量反应平行线(3.3)法,输入T估计效价为100 U/mL,T最大剂量为10 mg/mL,S最大剂量为10 mg/mL,剂间比为1∶0.125,并输入低、中、高质量浓度供试品溶液、工作参照液的抑制率,采用完全随机设计实验,计算得到Pt和可信限率(FL)[15]。
2.2.3 COX-2试剂盒测定抗炎活性成分的半数抑制浓度(half inhibitory concentration,IC50) 按照“2.2.1”项下方法制备9种抗炎活性成分溶液,按照“2.2.1”项下方法测定抑制率,通过GraphPad Prism 9.0软件,输入各成分的浓度和抑制率,计算得到IC50。
2.2.4 抗炎生物效价权重系数(ECF)和ECI的建立 根据COX-2试剂盒选用不同质量浓度对照品来测定金银花各个抗炎成分的IC50,计算各个抗炎成分的ECF。

通过整合ECF和含量测定结果计算抗炎ECI,以表征金银花中9种具有抗炎生物活性成分对本实验中抗炎作用的贡献总和。

ECF代表成分的抗炎活性生物效价权重系数,C代表金银花中单体成分的实际含量
2.2.5 相关性统计分析 采用SPSS 25.0和GraphPad Prism 9.0软件上进行相关性分析。根据相关系数()评估每种单体成分与实际测得的抗炎生物效价之间的相关性。
2.2.6 细胞实验验证
(1)细胞毒性实验:RAW264.7细胞用含10%胎牛血清的完全培养基制成细胞悬液,以5 000个/孔接种到96孔板上,于37 ℃、5% CO2的孵箱中培养过夜。接种24 h后,用纯水配制S9批次金银花配方颗粒药液使其质量浓度为0、62.5、125、250、500、1 000、2 000、4 000、8 000 μg/mL,弃去孔板中的培养基,每孔加入200 μL对应质量浓度的药液。加药结束后,继续置于孵箱中培养24 h,培养结束后,取出孔板,每孔加入CCK-8溶液后继续培养1~4 h。取出孔板,避光,于摇床上轻轻摇晃3~5 min后,采用酶标仪测定450 nm处的值。
(2)上清液中TNF-α、IL-1β、COX-2水平的检测:RAW264.7细胞用含10%胎牛血清的完全培养基制成细胞悬液,以5 000个/孔接种到96孔板上,于37 ℃、5% CO2的孵箱中培养过夜。接种12 h后,设置对照组、模型组和给药组,弃去孔板中的培养基,模型组和给药组加入2 ng/mL LPS,给药组加入0.5 mg/mL药液,对照组加入不含药物的培养基,于孵箱培养6 h。培养结束后,取出孔板,收集细胞上清液,按照试剂盒说明书检测TNF-α、IL-1β、COX-2水平。

3 结果
3.1 基于UPLC的金银花配方颗粒含量测定
混合对照品溶液和不同批次样品溶液的色谱图见图1,采用UPLC法测定金银花中9种具有抗炎活性成分的含量测定,如表2所示,9种单体成分含量存在较大的差异,其中国标批次(S1~S11)和企标批次(S12~S22)之间在单体成分的含量高低也存在显著差异,如S8批次中绿原酸的含量比S16批次中该成分含量高3.3倍(43.0612.98 mg/g)。在9个抗炎活性成分中,成分2(绿原酸)和成分4(断马钱子酸)的含量显著高于其他成分的含量,并且国标的成分含量平均值要普遍高于企标,国标的成分2、成分4及总体的RSD要小于企标,从含量测定结果中初步说明国标的质量一致性和稳定性比企标的更好。
3.2 金银花配方颗粒效价结果
3.2.1 线性关系考察结果 金银花配方颗粒和阳性药塞来昔布均能通过可靠检验,样品量效曲线形状与工作参照物相同,且线性回归方程(=31.983+5.659)与对照药塞来昔布(=31.983+7.789)较为一致,提示两者作用趋势和规律相同,抑制率与对数剂量之间呈良好的对称“S”形曲线,说明质量浓度在2.5~640 μg/mL与抑制率的线性关系良好,最终确定低、中、高质量浓度分别为5、40、320 μg/mL。
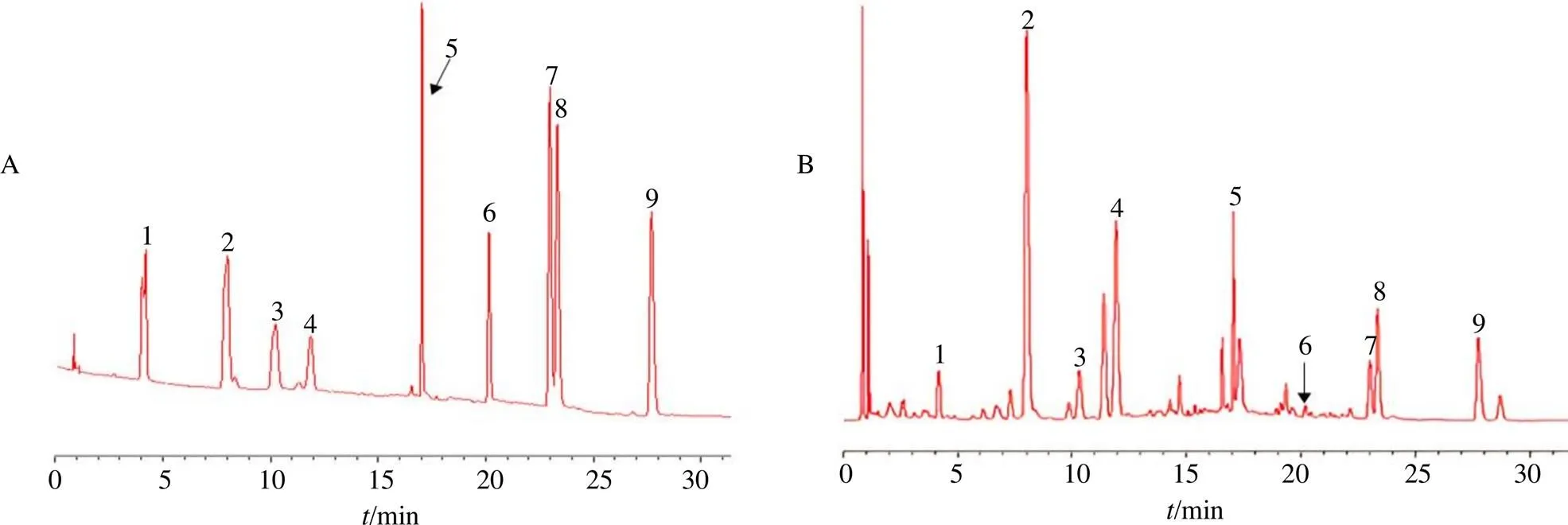
1-新绿原酸;2-绿原酸;3-隐绿原酸;4-断马钱子酸;5-断氧化马钱子苷;6-木犀草苷;7-异绿原酸B;8-异绿原酸A;9-异绿原酸C。
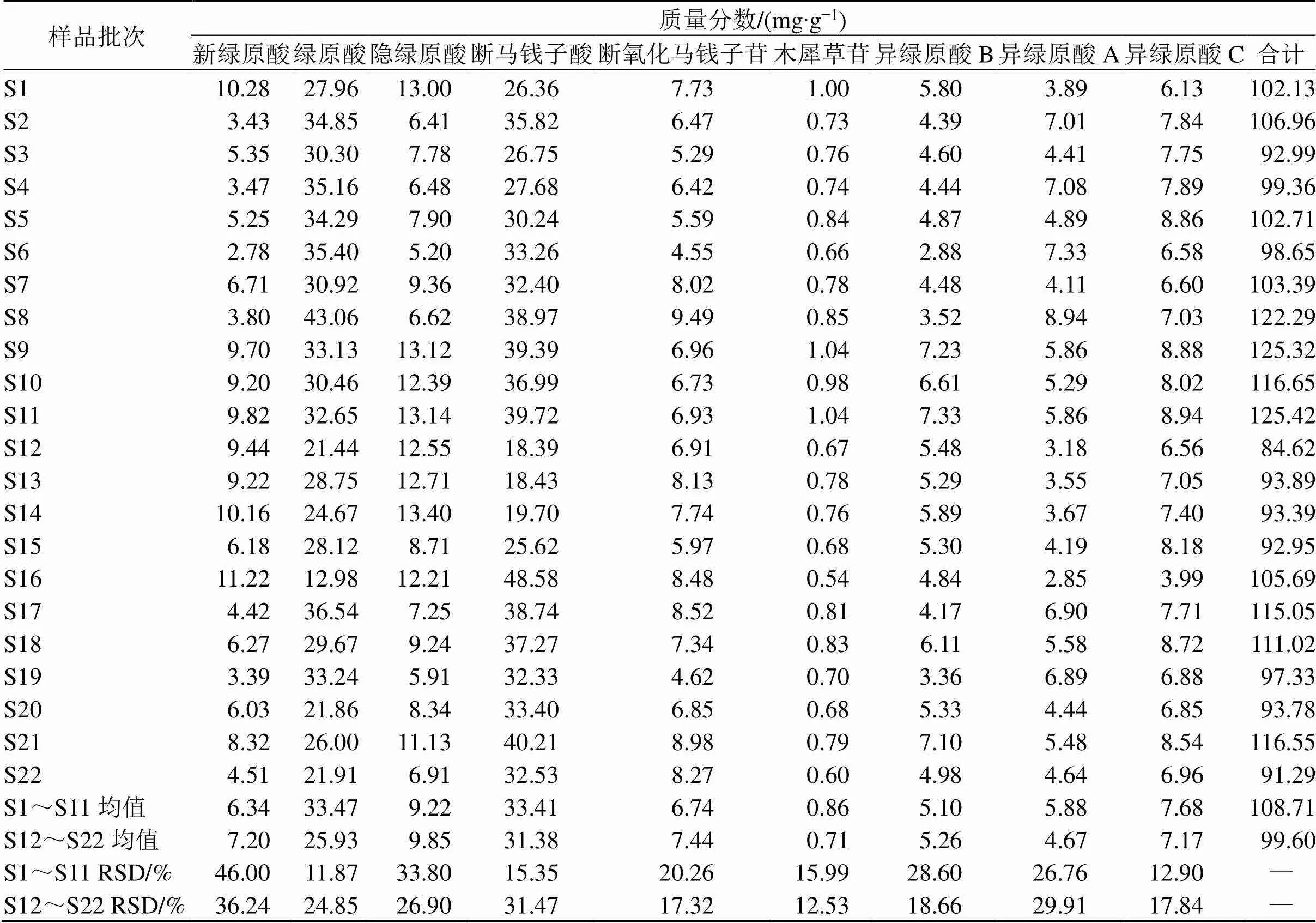
表2 22批次金银花配方颗粒样品中9种具有抗炎活性的单体成分的含量
3.2.2 可靠性检验结果 根据《中国药典》2020年版四部中量反应平行线法可靠性检验结果成立的判别要求,量反应平行线(3.3)法可靠性测验的结果,回归项应非常显著(<0.01),偏离平行、二次曲线、反向二次曲线各项均应不显著(>0.05)。可靠性检验中回归项和二次曲线项用来检验S和T是直线还是二次曲线关系,结果中回归项极显著(<0.01),说明随着工作参照物S和T的给药剂量的增加。偏离平行项和反向二次曲线用来检验S和T的平行性,回归项极显著,偏离平行以下各项都不显著,则S和T为平行直线。如表3所示,结果中偏离平行、二次曲线、反向二次曲线均不显著(>0.05),说明S和T 2条直线是平行关系。表明本方法能通过可靠性检验,可认为S和T具有同质性,所以T的生物效价可看作为稀释或浓缩一定倍数的S的生物效价。

表3 金银花配方颗粒样品效价可靠性检验
3.2.3 金银花配方颗粒抗炎生物效价测定和抗炎活性成分IC50测定 如表4所示,国标批次(S1~S11)的生物效价在100.28~106.35 U/mL,企标批次(S12~S22)的生物效价在88.06~95.49 U/mL。如表5所示,9种指标性成分的IC50在6.84~210.40 μg/mL,成分之间的IC50差异较大。

表4 22批次金银花配方颗粒样品的效价

表5 金银花配方颗粒9个成分的IC50
3.3 ECI的理论计算
如表6所示,国标批次(S1~S11)的金银花配方颗粒ECI为10.82~14.11,企标批次(S12~S22)的金银花配方颗粒ECI为9.32~12.58,表明国标金银花配方颗粒样品的ECI相对较高,而企标金银花配方颗粒样品的ECI相对较低,说明金银花国标批次配方颗粒整体质量、稳定性和抗炎药效要高于企标批次。

表6 22批次金银花配方颗粒样品的ECI和效价
3.4 ECI和单体成分含量与实际测得抗炎效价之间的相关性分析
根据比较构建的ECI与实际测得金银花样品抗炎作用效价和9个指标性单体成分的含量与抗炎效价之间的相关性[以相关系数()表示],来分析ECI和抗炎作用单体成分含量来表征金银花配方颗粒实际测得抗炎效价的准确性。结果分析显示,与9个指标性单体成分含量的相关性相比较,ECI与金银花实测抗炎生物效价之间有较好的相关性,=0.673(图2-A),提示ECI可作为评价金银花配方颗粒各样品是否具有强抗炎作用的质量评价指标。估计值与金银花生物效能的实际测量值之间的差异,即统计残差,可用于评估ECI的准确性。残差分布图显示ECI的离散度非常窄(图2-B),提示当评价不同来源的抗炎效果时,ECI是一个更准确评价指标。采用残差平方和作为量化指标反映出ECI(=10)作为一张金银花质量控制指标的准确度优于其余评价指标(图2-C)。统计分析结果表明,ECI作为金银花抗炎活性的一种评价指标的准确性是相对比较可靠的。
图3结果表明单一指标性成分的含量高低与配方颗粒实际测得抗炎生物效价之间相关性最好的是绿原酸(=0.644),其次是木犀草苷(=0.581)。新绿原酸、隐绿原酸、断氧化马钱子苷的含量与金银花样品实际测得的生物效价之间的相关性普遍较差间的相关性普遍较差,为−1.44~−0.194。
3.5 细胞验证结果
3.5.1 金银花配方颗粒对RAW264.7细胞存活率的影响 如图4所示,0.062 5~0.500 0 mg/mL的金银花配方颗粒对RAW264.7细胞存活率无明显影响。以质量浓度为0.5 mg/mL的金银花配方颗粒用于后续细胞实验。

A-金银花配方颗粒样品的ECI与实际测得的生物活性之间的相关性分析,蓝线代表线性拟合,红线代表置信带,黑线代表预测带,=0.673;B-ECI的标准化残差分布图;C-残差的平方和。
A-correlation analysis between ECI and actual measured bioactivities ofdispensing granules samples, blue line represents the linear fit, red line represents the confidence band, and black line represents the prediction band,= 0.673; B-standardized residual distribution map of ECI; C-sum of squares of residuals.
图2 相关性分析结果
Fig. 2 Results of correlation analysis
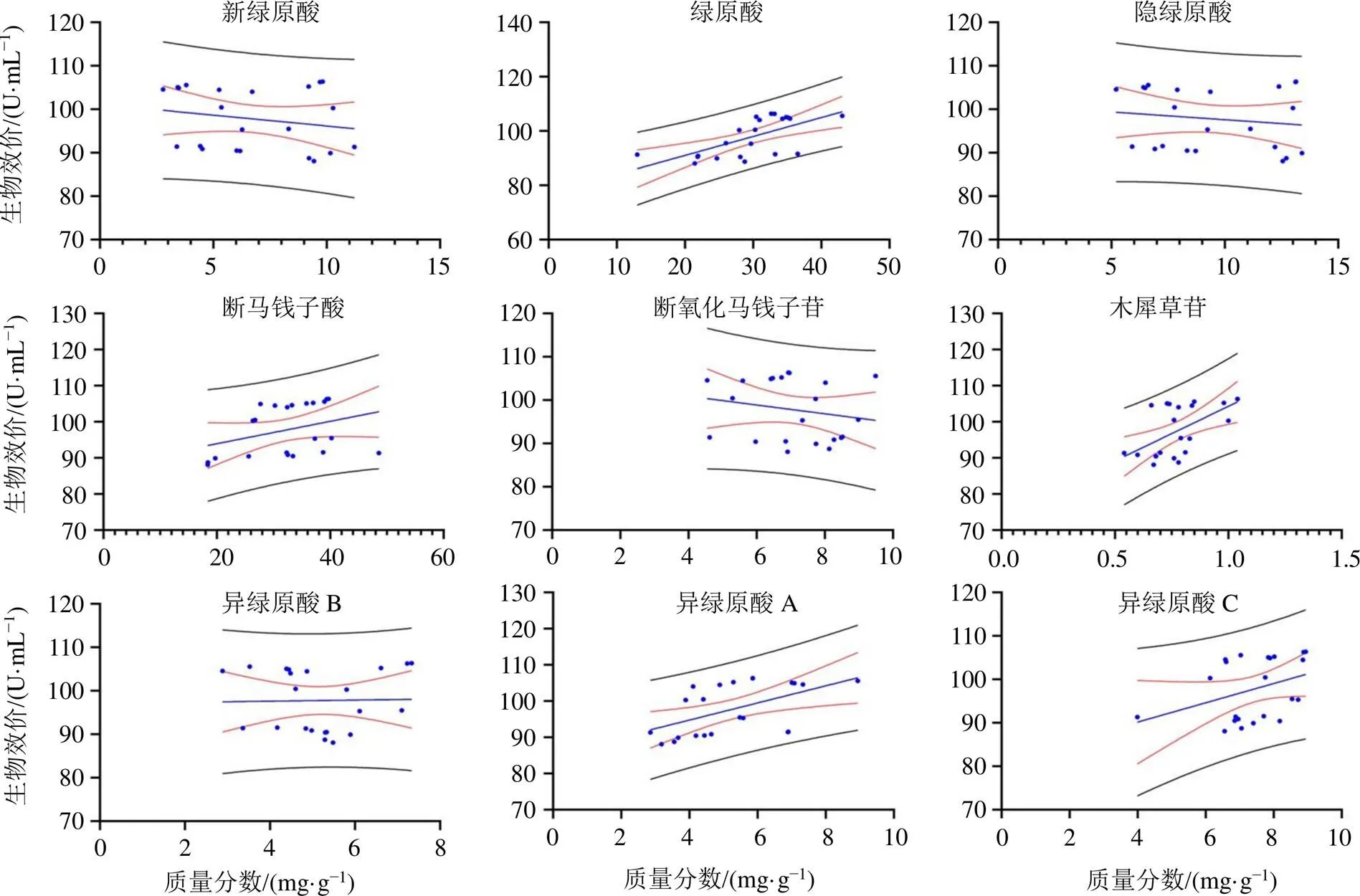
图3 金银花配方颗粒样品中各生物活性成分含量与实际测得的抗炎作用之间的相关性分析
3.5.2 金银花配方颗粒对LPS诱导的RAW264.7细胞上清液中TNF-α、IL-1β、COX-2水平的影响 如图5所示,与模型组比较,22批次金银花配方颗粒均可显著抑制上清液中TNF-α、IL-1β、COX-2水平(<0.05)。从国标组和企标组的对比结果(图6)可以看出,国标组降低炎症因子水平的效果比企标组好,提示该结果与金银花配方颗粒的效价结果和ECI结果相符合。
4 讨论
生物效应评价的方法是实现中药质量标准现代化的有效途径,是连接临床疗效与中药质量的桥梁[16]。中药ECI是基于单体成分分析和生物效价检测共同加权的质量评价指标,其可通过中药中活性成分的“量-效”关系方程来建立。肖小河教授提出构建“中药品质标准评控力金字塔”,在基于化学基准的基础上增加效应基准,逐步建立以生物评价为核心手段和指标之一的中药质量标准体系,这将是中药质量标准化建设的重要发展方向[17]。

与对照组(0 mg∙mL−1)比较:**P<0.01。
本研究通过在单体成分含量测定的基础上,增加了金银花抗炎的生物效价测定方法,并构建了一种基于生物效价权重系数加权的多组分化学定量分析的中药质量评控方法,并且通过细胞实验水平验证了该方法的结果,说明方法可行、可靠。本研究的含量测定结果显示,绿原酸的含量最高,其次是断马钱子酸,其他7种成分含量较低,该结果与魏悦等[18]的含量测定结果一致,说明建立的含量测定分析方法准确、可行、重复性良好。本研究在谭鹏等[19]研究金银花配方颗粒方法的基础上,对22批不同标准(国标/企标)的金银花配方颗粒样品进行质量一致性评价,结果表明国标样品抗炎活性和稳定性要优于企标,国标样品的质量一致性较好,说明国标的出台,一定程度地结束了“异地异标准,各厂各规范”现象,成为中药配方颗粒生产质量的“指南针”,更能保障中药配方颗粒整体质量稳定和均一。从相关性结果分析显示,绿原酸、木犀草苷的含量与金银花发挥抗炎作用的关联度较大,这与Zhang等[20]、施春燕[21]、熊乐文等[22]的研究相似,这2个成分同样也是作为《中国药典》2020年版[18]和金银花配方颗粒国家药品标准质量评价的指标性成分,说明该相关性分析结果准确、可靠、具有参考意义。

与对照组比较:*P<0.05;与模型组比较:#P<0.05。

图6 国标组和企标组TNF-α、IL-1β、COX-2水平的对比
综上,本研究建立了基于抗炎活性检测的ECI测定方法,用于金银花配方颗粒的质量一致性评价,测定结果稳定可靠,适应性强,本研究可以为其他具有类似抗炎作用的中药配方颗粒的质量评价研究及应用提供科学参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 孙婷婷, 马晓慧, 李欣欣, 等. 中药生物效价研究现状及开发思路探讨 [J]. 中草药, 2017, 48(9): 1906-1911.
[2] 叶霁, 李睿旻, 曾华武, 等. 基于整体观中药质量标志物的发现及研究进展 [J]. 中草药, 2019, 50(19): 4529-4537.
[3] 肖小河, 肖培根, 王永炎. 基于道地药材和生物效价检测的中药质量控制与评价模式的研究[A] // 2007年中华中医药学会第八届中药鉴定学术研讨会暨中国中西医结合学会中药专业委员会全国中药学术研讨会论文集[C]. 长沙: 中国中西医结合学会, 2007: 4.
[4] 张萌, 封亮, 贾晓斌. 基于生物活性与效应基准的中药质量评价技术发展现状与展望 [J]. 世界中医药, 2020, 15(15): 2234-2239.
[5] 肖小河, 王伽伯, 鄢丹. 生物评价在中药质量标准化中的研究与应用 [J]. 世界科学技术—中医药现代化, 2014, 16(3): 514-518.
[6] 李寒冰, 吴宿慧, 唐进法, 等. 中药质量生物标志物研究进展 [J]. 中草药, 2019, 50(19): 4556-4561.
[7] 熊吟, 肖小河, 鄢丹, 等. 综合量化集成的中药品质评控策略: 中药效应成分指数 [J]. 中草药, 2014, 45(1): 1-7.
[8] 张海珠, 肖小河, 王伽伯, 等. 中药质量评控的第一要义: 效应当量一致性 [J]. 中草药, 2015, 46(11): 1571-1575.
[9] 谭鹏, 王伽伯, 张定堃, 等. 效应成分指数在中药金银花质量评价中的应用研究[J]. 药学学报, 2019, 54(12): 2141-2148.
[10] 孙源源, 施萍. 借助中药配方颗粒推进中药国际化的对策研究 [J]. 中草药, 2013, 44(8): 929-934.
[11] 鲁萍, 邓勇. 中药配方颗粒行业试点20年政策梳理与优化建议 [J]. 中草药, 2022, 53(4): 1277-1284.
[12] Su X R, Zhu Z H, Zhang L,. Anti-inflammatory property and functional substances of[J]., 2021, 267: 113502.
[13] Lee S J, Son K H, Chang H W,. Antiinflammatory activity of[J]., 1998, 12(6): 445-447.
[14] 马涵玉, 钱琪, 牛丽颖. 基于文献计量学的金银花研究现状与热点分析[J]. 药物评价研究, 2022, 45(7): 1426-1434.
[15] 张宇航, 杨静, 吴宿慧, 等. 基于抗凝血活性的丹红注射液生物效价测定方法的建立 [J]. 中草药, 2022, 53(8): 2348-2355.
[16] 曹梦珍, 黄倩, 牛明, 等. 基于抗肝纤维化生物活性及近红外谱效相关的鳖甲质量评价研究[J]. 中草药, 2023, 54(10): 3150-3157.
[17] 肖小河, 张定堃, 王伽伯, 等. 中药品质综合量化评控体系: 标准评控力金字塔 [J]. 中国中药杂志, 2015, 40(1): 7-12.
[18] 魏悦, 曹静亚, 张丽先, 等. 金银花药材、标准汤剂、中间体、配方颗粒指纹图谱及过程质量评价研究 [J]. 中国现代应用药学, 2022, 39(4): 495-499.
[19] 谭鹏, 张海珠, 张定堃, 等. 基于化学表征和生物效价检测的金银花配方颗粒质量评价研究[J]. 中国中药杂志, 2017, 42(14): 2683-2690.
[20] Zhang B, Nan T G, Xin J,. Development of a colloidal gold-based lateral flow dipstick immunoassay for rapid detection of chlorogenic acid and luteoloside in[J]., 2019, 170: 83-88.
[21] 施春燕. 木犀草苷的镇痛作用及其机制研究[D]. 上海: 上海中医药大学, 2023.
[22] 熊乐文, 金莹, 王彦予, 等. 金银花酚酸类化学成分、药理活性及体内代谢研究进展 [J]. 中成药, 2022, 44(3): 864-871.
Quality evaluation ofFlos dispensing granules based on anti-inflammatory effect component index
JIA Jinhao1, CHEN Xiaofei2, 3, LI Hanbing2, LI Weixia2, WANG Xiaoyan2, ZHANG Hui2, ZHANG Mingliang2, WANG Bin1, HAN Bing1, JI Qiuru1, XIAO Xiaohe3, TANG Jinfa1, 2
1. School of Pharmacy, Henan University of Chinese Medicine, Zhengzhou 450046, China 2. Henan Key Laboratory of Clinical Pharmacy of Traditional Chinese Medicine, Henan Engineering Research Centre for Clinical Application, Evaluation and Translation of Traditional Chinese Medicine, Department of Pharmacy, the First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, China 3. The Fifth Medical Center, Chinese People’s Liberation Army General Hospital, Beijing 100039, China
To establish a method for quality consistency evaluation of Jinyinhua () dispensing granules based on effect-constituents index (ECI) by taking anti-inflammation as an example.Ultra performance liquid chromatography (UPLC) was used to determine the contents of nine monomer components (neochlorogenic acid, chlorogenic acid, cryptochlorogenic acid, secologanic acid, secoxyloganin, cymaroside, isochlorogenic acid B, isochlorogenic acid A, isochlorogenic acid C) with anti-inflammatory activity in 22 batches ofdispensing granules of different standards (national standard/enterprise standard, NS/ES), and the anti-inflammatory potency of the above samples and half inhibitory concentration (IC50) of the relevant monomer components were determined by using the cyclooxygenase-2 (COX-2) kit, and then the weight coefficient of anti-inflammatory potency of the above components was obtained by integrative analysis, and ECI was calculated through the integration of weight coefficients and effectors, and finally, the feasibility of the constructed ECI was verified by cellular experiments.The results of anti-inflammatory component content determination showed that there were large differences in the contents of nine individual components, of which there were also significant differences in the content of individual components between the NS batch (S1—S11) and the ES batch (S12—S22), for example, the content of chlorogenic acid in the NS batch (S8) was 3.3 times more than the content of this component in the ES batch (S16) (43.0612.98 mg/g). The overall stability of NS (S1—S11) samples was not much different from that of ES (S12—S22) samples (RSDNS= 211.55, RSDES= 215.71). The bioefficacy assay passed the methodological examination, and the results showed that the anti-inflammatory potency and stability of the NS samples were better than those of the ES samples (potencyNS= 100.28—106.35 U/mL, potencyES= 88.06—95.49 U/mL; RSDNS= 1.98, RSDES= 2.56). The theoretical calculations of ECI showed that the results of the method were consistent with the experimental results, which could reflect the pharmacodynamic relationship of thedispensing granules samples (ECINS= 10.82—14.11, ECIES= 9.32—12.58; RSDNS= 9.51, RSDES= 10.02). Correlation analysis showed that the better positive correlation between the content of single indicator components and anti-inflammatory potency was chlorogenic acid (= 0.644), followed by cymaroside (= 0.581), suggesting that these two components played a major role in anti-inflammatory activity.This study establishes the quality evaluation method ofdispensing granules based on ECI by taking anti-inflammation as an example. It can be applied to the quality consistency evaluation of multiple batches ofdispensing granules with different standards (NS/ES), and provide scientific reference for the quality evaluation research and application of other Chinese medicine dispensing granules with similar anti-inflammatory effects.
quality evaluation; effect-constituents index; anti-inflammation;; dispensing granules; neochlorogenic acid; chlorogenic acid; cryptochlorogenic acid; secologanic acid; secoxyloganin; cynaroside; isochlorogenic acid B; isochlorogenic acid A; isochlorogenic acid C
R285
A
0253 - 2670(2024)08 - 2630 - 11
10.7501/j.issn.0253-2670.2024.08.014
2023-11-22
河南省高校科技创新团队(23IRTSTHN026);国家自然科学基金面上项目(82173993);国家中医管理局中医药高质量发展协同创新转化工程自主立项项目(CXZH03)
贾金浩,研究方向为中药炮制机制及饮片标准化研究。Tel: (0371)66245342 E-mail: jjh970423@163.com
通信作者:肖小河,男,博士生导师,研究员,主要从事临床中药学与安全用药研究。E-mail: pharmacy302@126.com
唐进法,男,博士,主任药师,主要从事中药质量评价与合理用药研究。E-mail: a0519@163.com
[责任编辑 李亚楠]

