姜黄素联合阿扎胞苷对急性髓系白血病细胞增殖的影响及机制研究
王萍 蒋玲琳 廖存香
(1.陆军军医大学附属西南医院血液病中心,重庆 400038;2.中国人民解放军75750部队卫生所,广西 柳州 545606)
急性髓系白血病(Acute myeloid leukemia,AML)是一种高度异质性的造血恶性肿瘤,其特征是骨髓中存在过度增殖和积累的未成熟髓系细胞[1]。尽管AML的诊断和治疗取得了极大进展,但其发病率和死亡率仍然很高[2]。目前,传统化疗方法是AML治疗的主要手段,但其无法根除白血病干细胞(Leukemia stem cells,LSCs),而LSCs是AML患者耐药和复发的根源[3]。因此,探索新的AML治疗策略是当前研究的重要课题。阿扎胞苷是一种去甲基化药物,在低剂量下可以抑制DNA甲基转移酶,并逆转肿瘤抑制基因的转录沉默[4],可用于新诊断的老年AML患者[5]。姜黄素可抑制组蛋白去乙酰化酶并诱导肿瘤细胞凋亡,并具有对正常细胞毒副作用小的特点[6]。有研究报道,姜黄素可增强沙利度胺诱导的AML细胞凋亡作用[7]。但姜黄素是否会影响阿扎胞苷对人急性髓系白血病细胞KG-1α的增殖抑制作用尚不清楚。故本研究旨在探讨姜黄素联合阿扎胞苷对KG-1α细胞增殖抑制的作用,并进一步探讨其潜在机制,为AML治疗提供实验依据。
1 材料与方法
1.1 实验材料和仪器 人急性髓系白血病细胞KG-1α购自广州赛库生物公司,姜黄素、阿扎胞苷购自美国Sigma公司,RPMI-1640购自美国Gibco公司,胎牛血清购自德国PAN-Seratech公司,CCK-8试剂购自上海MedChemExpress公司,逆转录试剂盒、RT-qPCR试剂盒购自日本Takara公司,兔抗人CDK2、p27KIP1、γH2A.X抗体购自沈阳万类生物,兔抗人p-AKT购自美国CST公司,Caspase-3抗体购自美国Immunoway公司,小鼠抗人β-actin抗体购自天津三箭生物公司,辣根过氧化物酶(HRP)标记山羊抗兔IgG、HRP标记山羊抗小鼠IgG、BCA试剂盒、青-链霉素购自上海碧云天生物技术公司,酶标仪为美国Thermo scientific公司产品,流式细胞仪为美国Beckman Coulter公司产品,凝胶成像仪为法国Vilber Lourmat公司产品。
1.2 方法
1.2.1 细胞培养 KG-1α细胞用含有10%胎牛血清、1%青-链霉素的RPMI-1640培养基中培养,并置于37 ℃,5% CO2的饱和湿度的孵箱中,每2~3 d传代一次。
1.2.2 CCK-8法检测细胞增殖 取对数生长期细胞,以3×103个/100 μL接种于96孔板中,姜黄素浓度:1、5、10、20、40 μmol/L;阿扎胞苷浓度:5、10、20、40、80 μmol/L。每个浓度设置3个复孔,药物处理后,分别培养24、48和72 h。在各个时间点分别加入10 μL/孔 CCK-8溶液,37 ℃孵育3 h,用酶标仪检测450 nm处的光密度(OD)值。增殖抑制率(%)=(OD对照组-OD实验组)/(OD对照组-OD空白组)×100%。
1.2.3 流式细胞术检测细胞周期和凋亡 取对数生长期细胞,将1×106个细胞接种于6孔板中,予以不同浓度药物处理48 h。然后收集细胞,PBS清洗细胞两次。对于细胞周期检测,细胞用预冷的75%乙醇在4 ℃固定过夜,加入含RNA酶(100 μg/mL)的碘化丙啶(PI),室温避光孵育30 min。细胞凋亡检测:用500 μL PBS重悬细胞,加入PI和Annexin V-FITC/7-AAD各5 μL,室温避光孵育15 min。最后,用流式细胞仪检测细胞周期分布和凋亡情况。
1.2.4 Western blot检测相关蛋白表达水平 用RIPA裂解液(含1 mM PMSF)提取细胞总蛋白,BCA法测定蛋白浓度后,按每孔40 μg上样,电泳后将蛋白转移到PVDF膜上,再用5%脱脂奶粉在室温封闭蛋白条带2 h,4 ℃孵育相应一抗,过夜。TBS-T洗膜3次后,条带在室温孵育相应二抗1 h。TBS-T洗膜3次后,用化学发光试剂进行凝胶成像。条带灰度值用Fusion软件分析,β-actin作为内参。

2 结果
2.1 姜黄素联合阿扎胞苷对细胞增殖的影响 CCK-8结果显示,姜黄素和阿扎胞苷均能抑制KG-1α细胞生长,且这种作用呈时间浓度依赖性,处理48 h后,联合用药组细胞增殖抑制率明显高于对照组和各单药组(P<0.05),见图1。CompuSyn计算不同浓度姜黄素和阿扎胞苷的CI值结果显示,5 μmol/L姜黄素和40 μmol/L阿扎胞苷的CI值最小,见表1。故选择此联合方案进行后续实验。
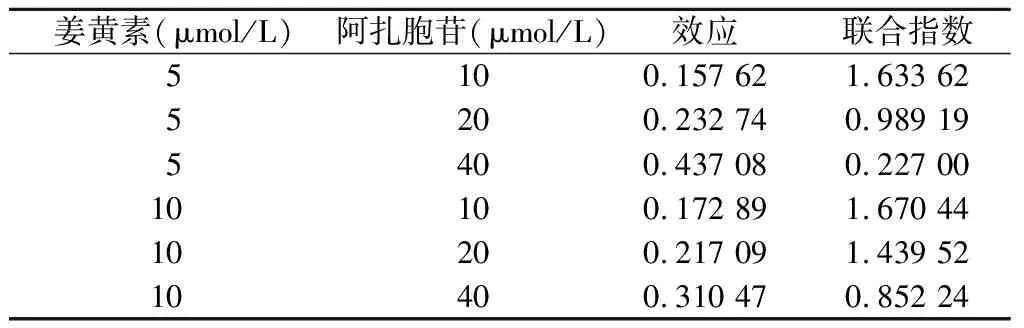
表1 不同浓度姜黄素和阿扎胞苷的联合指数
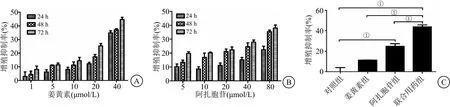
图1 姜黄素和阿扎胞苷对KG-1α细胞增殖的影响
2.2 姜黄素联合阿扎胞苷对细胞周期的影响 KG-1α细胞可被阿扎胞苷阻滞于G2/M期,而姜黄素对其细胞周期无明显影响,但联合用药组S期细胞百分比高于对照组和各单药组(P<0.05),见图2。
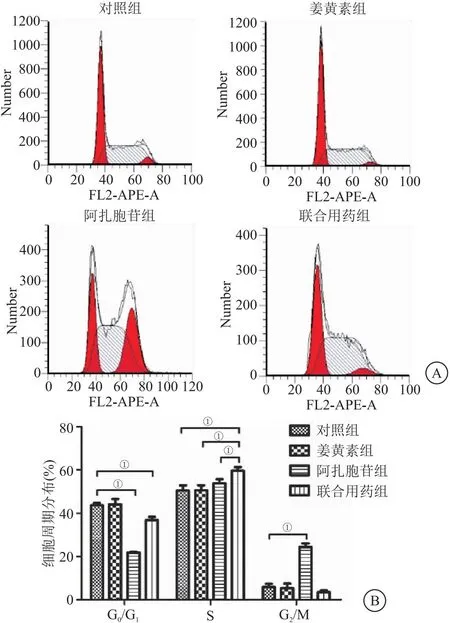
图2 姜黄素联合阿扎胞苷对KG-1α 细胞周期的影响
2.3 姜黄素联合阿扎胞苷对细胞凋亡的影响 单用姜黄素和阿扎胞苷处理48 h后,细胞凋亡率无明显变化,而联合用药组的细胞凋亡率明显高于对照组和各单药组(P<0.05),见图3。

图3 姜黄素联合阿扎胞苷对KG-1α细胞凋亡的影响
2.4 姜黄素联合阿扎胞苷对细胞周期和凋亡相关蛋白以及AKT通路蛋白表达的影响 药物处理48 h后,与对照组相比,联合用药组的p27KIP1、Caspase-3和DNA双链断裂标志物γH2A.X的蛋白表达水平显著增高(P<0.05),而联合用药组的CDK2的蛋白表达水平显著降低,同时低于姜黄素组(P<0.05);此外,联合用药组p-AKT表达水平也较对照组明显降低(P<0.05),见图4。

图4 姜黄素联合阿扎胞苷对细胞周期和凋亡相关蛋白以及AKT通路蛋白表达的影响
3 讨论
阿扎胞苷目前主要用于骨髓增生异常综合征和AML的治疗,具有诱导细胞分化及凋亡的作用,但并非所有患者均能受益于阿扎胞苷,部分患者可出现耐药[8]。姜黄素具有多种抗肿瘤活性,并且能逆转细胞对化疗药物的耐药性[9-11]。KG-1α是一种具有LSCs特性的AML细胞系,高表达CD34,缺失CD38抗原,可作为研究LSCs较好的替代模型[12]。然而,姜黄素能否增强阿扎胞苷对KG-1α细胞的影响并不明确。
本研究发现,姜黄素和阿扎胞苷可抑制KG-1α细胞增殖,并呈时间浓度依赖性。同时,我们发现药物不同浓度组合的联合效应也不同,部分联合方案甚至存在拮抗效应,这可能与药物代谢方式和作用靶点相互影响有关。经CompuSyn软件计算可知,5 μmol/L姜黄素和40 μmol/L阿扎胞苷对KG-1α细胞增殖抑制的协同作用最明显。
单用阿扎胞苷处理KG-1α细胞后,细胞周期主要被阻滞于G2/M期。这与Logan等[13]研究结果类似,阿扎胞苷可将人子宫内膜基质细胞阻滞于G2/M期。Deng等[14]也发现,阿扎胞苷可诱导白血病K562细胞阻滞于G2/M期。单用姜黄素处理后,KG-1α的细胞周期分布无明显变化。而在Zhou等[15]的研究中,姜黄素可诱导AML细胞系OCI-AML5和ML-2的细胞周期阻滞于G0/G1期,这种差异可能是因为此研究使用的细胞系和姜黄素剂量与我们的不一致。本研究发现,阿扎胞苷和姜黄素共处理可将KG-1α细胞阻滞于S期,提示两者在细胞周期方面存在协同作用,同时说明姜黄素可增强KG-1α细胞对阿扎胞苷敏感性可能和阻滞细胞周期有关。本研究结果与Shi等[16]研究结果类似,姜黄素与柚皮素联用可通过阻滞细胞周期于S期从而抑制AML细胞系THP-1增殖。
阿扎胞苷具有去甲基化作用,可通过重新表达肿瘤抑制基因,从而促使白血病细胞死亡[17]。此外,姜黄素也有去甲基化作用,但其与阿扎胞苷的作用机制不同。阿扎胞苷可掺入DNA,与DNA甲基转移酶DNMT1共价结合,诱导细胞凋亡[18]。姜黄素则是通过破坏DNMT1的合成,抑制酶活性,进而诱导细胞凋亡[19]。流式细胞术结果显示,阿扎胞苷和姜黄素对KG-1α细胞凋亡无明显影响,而当两者联合使用时细胞凋亡水平显著增高,表明姜黄素与阿扎胞苷促进KG-1α细胞凋亡具有协同效应,而这种效应可能与两者均具有去甲基化作用有关。这与Martín等[20]研究结果一致,发现姜黄素联合阿扎胞苷可显著促进AML细胞系(HL-60、U937)凋亡。
研究显示,单用姜黄素和去甲基化药物均能显著下调白血病细胞中AKT磷酸化水平[15,21]。AKT在AML中经常被过度激活,其磷酸化是AML患者总体生存期的一个独立预后不良因素[22]。据报道,AKT参与多种细胞生物学进程,包括细胞增殖、凋亡和血管生成[23]。CDK2能被AKT正向调节[24],当Cyclins/CDK2复合物形成受抑时,细胞周期可被阻滞于S期[25]。p27可抑制Cyclins/CDK2复合物的形成,并受到AKT的负调控[24]。此外,AKT受抑后可激活Caspase-3的表达并促进AML细胞的凋亡[26]。组蛋白H2A.X第139位丝氨酸磷酸化形成γH2A.X,γH2A.X是DNA双链损伤标志物[27]。有文献报道,AKT可负调控肿瘤细胞中H2A.X磷酸化水平进而影响细胞生存[28-29]。本研究结果显示,姜黄素联合阿扎胞苷可显著下调AKT磷酸化和CDK2表达水平,上调p27KIP1、Caspase-3和γH2A.X的蛋白表达水平,表明姜黄素联合阿扎胞苷抑制KG-1α细胞增殖可能与下调AKT磷酸化水平调控其下游分子相关。
4 结论
姜黄素联合阿扎胞苷通过阻滞细胞周期,诱导细胞凋亡,发挥协同抗KG-1α细胞增殖的效应,这可能与调控AKT信号通路有关。本研究为姜黄素联合阿扎胞苷治疗AML,特别是耐药和复发患者,提供了一定的实验室依据,但其具体分子机制和作用疗效还需进一步探索。

