不同温度单增李斯特菌和金黄色葡萄球菌混合培养生物被膜的形成
齐龙升,孙 博,韩志东,汪伦记
(河南科技大学食品与生物工程学院,河南洛阳 471023)
单增李斯特菌和金黄色葡萄球菌都是常见的人畜共患病原菌[1-2],广泛存在于自然界中。单增李斯特菌可在低温下生长繁殖[3],会污染各类冷冻食品[4],对其他肉类食品也会造成污染。金黄色葡萄球菌近年来的检出报道较多[5-6],对各类食品尤其是肉制品污染较多[7]。在对食品的安全抽检中,单增李斯特菌和金黄色葡萄球菌经常会被同时检出,尤其肉类制品[8-11],给食品安全带来很大威胁。
生物被膜是指微生物为了适应生存环境而分泌的胞外多聚物[12]。在食品安全领域,食源性致病菌可在固体表面形成生物被膜,且长时间黏附于固体表面[13-14],这些生物被膜的形成引起了食品、用品卫生安全的隐患。现有研究表明,80%的食源性疾病与食源性致病菌形成的生物被膜有关[15-16],生物被膜极易黏附于食品接触表面,27%的食品污染皆来自食品机械设备表面存在的生物被膜[17]。关于单增李斯特菌和金黄色葡萄球菌的单物种生物被膜的研究已有很多[18-19],但关于单增李斯特菌和金黄色葡萄球菌的混合生物被膜研究还未见报道,而混合培养的微生物生长状况与生物被膜的形成不同,主要体现在对一些微生物的生物被膜清除剂的抵抗作用与单物种培养形成的生物被膜不同[20-21]。研究了不同温度下单增李斯特菌和金黄色葡萄球菌混合培养生物被膜的形成,为在食品中控制单增李斯特菌和金黄色葡萄球菌的污染提供参考。
1 材料与方法
1.1 试验材料
1.1.1 菌株
单增李斯特菌(Listeria monocytogenes,简写为LM)、金黄色葡萄球菌(Staphylococcus aureus,简写为SA),河南科技大学食品与生物工程学院实验室保存。菌株保存于专用菌种保藏管中,使用前挑出管中瓷珠,在液体培养基中活化后接种于平板上,于37 ℃条件下培养24 h 后挑取单菌落使用。
1.1.2 材料与试剂
胰蛋白胨大豆肉汤(TSB)培养基、胰蛋白胨大豆琼脂(TSA)培养基,北京奥博星生物技术有限责任公司提供;单增李斯特菌增菌(LEB)肉汤培养基,青岛海博生物技术有限公司提供;结晶紫(AR),天津市科密欧化学试剂有限公司提供;DAPI(4',6 -二脒基-2 -苯基吲哚二盐酸盐)溶液(即用型),北京索莱宝科技有限公司提供;MTT 细胞增殖检测试剂盒,生工生物工程(上海)股份有限公司提供;磷酸氢二钠、氯化钠、冰乙酸、氯化钾等试剂,均为分析纯。
1.1.3 试验仪器
UV1800PC 型紫外可见分光光度计,上海菁华科技仪器有限公司产品;Infinite F50 型酶标仪,瑞士帝肯(Tecan)公司产品;TM3030Plus 型扫描电镜,日本日立高新技术公司产品;Leica DM2500 型荧光正置显微镜,莱卡显微系统贸易有限公司产品;FV3000 型激光扫描共聚焦显微镜,奥林巴斯公司产品。
1.2 试验方法
1.2.1 菌种活化和菌悬液制备
无菌条件下用接种环挑取1 环LM 接入LEB 培养基中,SA 接入TSB 培养基中,置于摇床,于37 ℃条件下以转速180 r/min 培养24 h。用紫外分光光度计调细菌浓度为OD600nm=0.1。将制好的LM 和SA 菌悬液1∶1 等体积混合即为混合菌液。
1.2.2 单增李斯特菌和金黄色葡萄球菌混合培养生物被膜的制备
将1.2.1 中制备的菌悬液用TSB 培养基稀释103倍,取LM 和SA 混合菌液1 mL 加入96 孔细胞培养板中或LM和SA 混合菌液2 mL 加入24 孔细胞培养板中,分别于4 ℃条件下培养1,3,7,10,15,20 d;于25 ℃条件下培养12,24,36,48,60,72 h;于37 ℃条件下培养12,24,36,48,60 h以形成生物被膜。同时,对LM和SA 按相同方法进行单独培养作为对比。
1.2.3 不同温度单增李斯特菌和金黄色葡萄球菌混合培养生物被膜的形成量
采用结晶紫染色法测定不同温度单增李斯特菌和金黄色葡萄球菌混合培养生物被膜的形成量。参照顾玉卿等人[21]的方法进行结晶紫染色,酶标仪测量OD595吸光度。试验重复3 次,取平均值。
1.2.4 不同温度单增李斯特菌和金黄色葡萄球菌混合培养生物被膜的代谢活性
采用MTT 法测定不同温度单增李斯特菌和金黄色葡萄球菌混合培养生物被膜的代谢活性。参照孙月林[22]的方法进行MTT 染色,酶标仪测量OD595吸光度。试验重复3 次,取平均值。
1.2.5 荧光显微镜观察
参照顾玉卿等人[21]的方法进行生物被膜制备:24 孔板每孔加入无菌的2%琼脂溶液,凝固后,插入1 片无菌盖玻片(14 mm×14 mm),然后加入2 mL 制备的菌悬液,置于4 ℃条件下孵育15 d,于25 ℃条件下孵育48 h,于37 ℃条件下孵育24 h。参照顾玉卿等人[21]的方法荧光染色后进行观察。
1.2.6 扫描电镜观察
生物被膜制备同1.2.5,参照顾玉卿等人[21]的方行扫描电镜制片和观察。
1.2.7 激光共聚焦显微镜观察
生物被膜制备同1.2.5,参照陈萍等人[23]的方法进行制片与染色,然后进行激光共聚焦显微镜观察。
1.3 数据分析
采用SPSS 20.0 统计软件进行数据分析,结果以平均值±标准差来表示。
2 结果与分析
2.1 不同温度单增李斯特菌和金黄色葡萄球菌混合培养生物被膜的形成
采用结晶紫法研究了不同温度下LM 和SA 混合培养生物被膜形成量随时间变化的情况。
4 ℃时LM和SA 混合培养生物被膜形成量见图1,25 ℃时LM 和SA 混合培养生物被膜形成量见图2,37 ℃时LM和SA 混合培养生物被膜形成量见图3。

图1 4 ℃时LM 和SA 混合培养生物被膜形成量
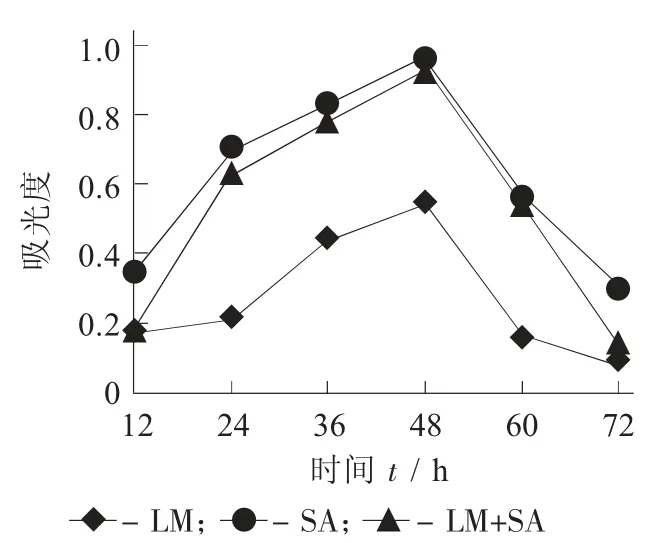
图2 25 ℃时LM 和SA 混合培养生物被膜形成量
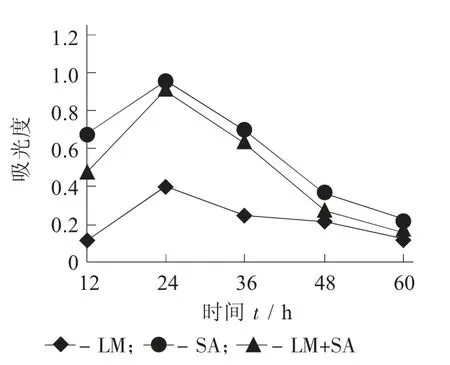
图3 37℃时LM 和SA 混合培养生物被膜形成量
由图1 可知,4 ℃时,LM 和SA 生物被膜的形成能力比较弱,但LM对外界环境的耐受性强,4 ℃的低温条件下仍能生长。4 ℃时,LM 生物被膜量随着时间的增加逐渐增多,15 d 达到最大值。LM 和SA 混合培养的生物被膜量的增加趋势与LM 单独培养时几乎一致,表明在4 ℃混合形成的生物被膜中单增李斯特菌占优势。由图2 和图3 可知,25 ℃和37 ℃SA 和LM都具有较强的生物被膜形成能力,但金黄色葡萄球菌生物被膜的形成能力高于单增李斯特菌。25 ℃和37 ℃单独培养LM 和SA 时,生物被膜量分别在48 h 和24 h 时达到最大。LM 和SA 混合培养时,形成的生物被膜的量低于SA,高于LM。表明LM 和SA 混合培养时存在拮抗作用,混合生物被膜的量与生长趋势跟SA 较为接近,说明2 种菌共培养时SA 是优势菌。
2.2 不同温度下单增李斯特菌和金黄色葡萄球菌混合培养生物被膜的代谢活性
采用MTT 法分析了不同培养温度下LM和SA 混合培养生物被膜的代谢活性。
4 ℃时LM 和SA 混合培养生物被膜的代谢活性见图4,25 ℃时LM和SA 混合培养生物被膜的代谢活性见图5,37 ℃时LM和SA 混合培养生物被膜的代谢活性见图6。

图4 4 ℃时LM 和SA 混合培养生物被膜的代谢活性

图5 25 ℃时LM 和SA 混合培养生物被膜的代谢活性

图6 37 ℃时LM 和SA 混合培养生物被膜的代谢活性
由图4 可知,在4 ℃时,LM 和SA 单独培养和混合培养生物被膜的代谢活性都较低,但SA 的生物被膜的代谢活性显著低于LM 与LM 和SA 混合培养的生物被膜代谢活性。表明在4 ℃混合培养形成的生物被膜中单增李斯特菌代谢活性占优势。由图5和图6 可知,25 ℃和37 ℃SA 和LM 都具有较强的生物被膜代谢活性,但金黄色葡萄球菌的生物被膜的代谢活性高于单增李斯特菌。25 ℃和37 ℃单独培养LM和SA 时,生物被膜代谢活性分别在48 h和24 h时达到最大。LM 和SA 混合培养时,生物被膜代谢活性低于SA,高于LM。表明从生物被膜代谢活性看,LM 和SA 混合培养时存在拮抗作用,混合生物代谢活性跟SA 较为接近,说明2 种菌共培养时SA是优势菌,结论与2.1 相符。
2.3 荧光显微镜
用荧光显微镜观察了不同温度下LM 和SA 混合培养生物被膜荧光图。
不同温度LM和SA 混合培养生物被膜荧光图见图7。

图7 不同温度LM 和SA 混合培养生物被膜荧光图
由图7 可知,4 ℃时对LM 和SA 单独培养或混合培养,显微镜观察到的图像荧光都非常弱,没有生物被膜量的形成;25 ℃和37 ℃时显微镜观察到的图像荧光则比较强,能观察到有大量的生物被膜形成,特别是37 ℃培养时,形成的生物被膜连成一片。与2.1 和2.2 的结果相同,LM和SA 混合培养的荧光强度和形成的生物被膜量比对其单独培养的荧光强度要弱和低。试验结果进一步证实LM和SA 混合培养时存在拮抗作用。
2.4 扫描电镜
用扫描电镜观察了不同温度下LM 和SA 混合培养生物被膜形成情况。
不同温度LM和SA 混合培养生物被膜扫描电镜图见图8。

图8 不同温度LM 和SA 混合培养生物被膜扫描电镜图
由图8 可知,4 ℃培养时,没有生物被膜形成,菌体散布分开;25 ℃培养时,菌体聚集成团,堆叠在一起形成生物被膜;37 ℃培养时,更多的菌体堆积聚集在一起,堆叠在一起形成生物被膜区域也变大。LM 和SA 混合培养的生物被膜量要低于金黄色葡萄球菌,且聚集成团形成生物被膜是金黄色葡萄球菌,生物被膜中也有少量的单增李斯特菌分布。
2.5 激光共聚焦显微镜
用激光共聚焦显微镜观察了LM和SA 混合培养时生物被膜的形成随培养时间延长的变化情况。
37 ℃培养不同时间LM和SA 混合培养生物被膜激光共聚焦显微镜图见图9。

图9 37 ℃培养不同时间LM 和SA 混合培养生物被膜激光共聚焦显微镜图
由图9 可知,37 ℃培养24 h 时,生物被膜形成量达到最大;48 h 时,生物被膜一部分已发生解聚,只有部分生物被膜存在;60 h 时,生物被膜已大部分解离,菌体量非常少,且呈零散分布。
3 结论
研究了不同温度下LM和SA 这2 种食源性致病菌混合培养生物被膜的形成情况。试验结果表明,在4 ℃时,LM 和SA 生长和生物被膜的形成能力都受到抑制,但仍能缓慢生长,混合培养时,优势菌是LM;25 ℃和37 ℃时LM 和SA 都能快速生长,并有较强的生物被膜形成能力,混合培养时,优势菌是SA。

