32 株碳青霉烯类耐药的高毒力肺炎克雷伯菌血清荚膜、毒力基因及多位点序列分型
金晓立,陈飞,叶雯凝,曾云祥
肺炎克雷伯菌(klebsiella pneumoniae,KP)是一种在医院和社区中都能引起严重感染的细菌,特别是高毒力肺炎克雷伯菌(hypervirulent klebsiella pneumoniae,hvKP),能导致肝脓肿、肺炎等严重疾病,尤其影响免疫力低下的人群。随着对抗生素的广泛使用,KP 对许多抗生素产生耐药性,尤其对于治疗多重耐药感染的耐碳青酶烯类肺炎克雷伯杆菌(carbapenem-resistant klebsiella pneumoniae,CRKP),这使得治疗变得更加困难。过去认为KP 的高毒力和多重耐药性是分开的,但最近出现的耐碳青霉烯高毒力肺炎克雷伯菌(carbapenemase resistant hypervirulent klebsiella pneumoniae,CR-hvKP)打破了这一认识。CR-hvKP 兼具高侵袭性和强耐药性,使得感染更难治疗,对公共卫生构成重大威胁。
CR-hvKP的出现和扩散加剧了抗生素耐药性问题,使得原本就复杂的KP 感染治疗更加困难。因此,对CR-hvKP 的研究具有重要的临床意义和紧迫性,需要加强对其分子机制、传播途径和耐药性机制的研究,以便开发有效的预防和治疗策略。本研究对KP 及其耐药性和毒力进行监测,以提高临床医师对这一重要病原体的认识,现报道如下。
1 资料与方法
1.1 菌株来源 选取2018 年2 月至2022 年11 月在浙江中医药大学附属温州市中医院收治住院患者中分离的CRKP 菌株,剔除重复菌株,共得230 株。将收集菌株采用冷冻干燥法进行保存待用。本研究获得温州市中医院伦理委员会批准,所有研究对象均同意参加本研究并签署书面知情同意书。
1.2 细菌鉴定及药敏试验 对收集菌株进行复苏并接种于哥伦比亚血平板上培养,于37 ℃培养箱中培养(24 h),取单个菌落于金属靶板上均匀涂布,经MALDI-TOF 质谱仪(德国布鲁克)鉴定,确认菌株。使用全自动微生物分析系统(型号:VITEK-2 Compact)药敏试验确证CRKP,分纯至哥伦比亚血平板中。标准菌株肺炎克雷伯菌ATCC700603 和大肠埃希菌ATCC25922 购于温州康泰生物科技有限公司。
1.3 表型筛查 挑取新鲜血平板上单克隆的大肠埃希菌,用无菌0.9%氯化钠注射液调制0.5 麦氏浊度,涂布至琼脂(mueller-hintot,MH)平板。同时取10g/片的药敏纸片(亚胺培南),放置于中心位置。以纸片为起点,取待测菌株划线,长度为20 ~25 mm。之后将平板倒置,37 ℃培养16 ~20 h。待测菌株产碳青霉烯酶的判定标准为:待测菌株线与大肠埃希菌抑菌圈交汇处出现苹果蒂样的生长增强现象,即为改良Hodge 试验结果阳性[1]。
1.4 黏液丝实验 将目标菌株接种于血平板,37 ℃孵育24h,用接种环挑起菌落。阴性:不能挑起或挑起的黏液丝长<5mm,阳性:挑起的黏液丝长≥5mm。
1.5 表型确认 参照标准方法及试剂说明进行待测耐药菌株表型检测。在平板上放置亚胺培南纸片(4张、10 mg),分别添加试剂乙二胺四乙酸(A 组)、硼酸(B 组)、乙二胺四乙酸+硼酸(C 组)、空白液(D组)。24 h 后记录抑菌圈直径。A 组抑菌圈直径较D组增大5 mm 以上,表明细菌产B 类碳青霉烯酶(如NDM);B 组抑菌圈直径较D 组增大5 mm 以上,表明细菌产A 类碳青霉烯酶(如KPC);C 组抑菌圈直径较D 组增大5 mm 以上(A、B 组较D 组无明显增大),表明细菌同时产A 类和B 类碳青霉烯酶[2]。
1.6 基因确证
1.6.1 DNA模板制备 刮取分纯后的2 ~5 个单克隆菌落至含有200l 无菌水的1.5ml 离心管中,离心管震荡混匀后甩离,100 ℃金属浴加热10min,于4 ℃条件14 000 r/min 离心10 min 后取上清液分装。
1.6.2 PCR 法检测目的基因 引物设计参照文献[3-4],检测菌株的血清分型和毒力基因及耐药基因。聚合酶链反应体系25l,包括DNA 模板1l、正向引物1l、反向引物1l、TaqPCR Master Mix 12.5l、双蒸水9.5l。聚合酶链反应条件:94℃预变性5min,94℃变性60s,退火30(s退火温度根据产物大小略有不同),72 ℃延伸60s,72℃延伸7min,共32 个循环。
1.7 CR-hvKP耐药基因、血清荚膜型及毒力基因检测 采用煮沸法进行DNA 模板制备,反转录PCR(reverse transcription-PCR,RT-PCR)扩增CR-hvKP的碳青霉烯耐药基因、血清荚膜分型及毒力基因。条件:94 ℃,5 min预变性;94 ℃变性30 s,退火30 (s各基因序列及退火温度见表1),72 ℃延伸1 min,72 ℃延伸10min,扩增35 个循环。取PCR 扩增产物5.0l,用2.0%琼脂糖凝胶电泳(100 mV)检测,反应产物由紫外灯照射观察条带位置和亮度,PCR 产物由上海生物工程科技有限公司测序。PCR 仪采用ABI 7900荧光定量对样本进行PCR 处理,检测菌株碳青霉烯耐药基因(KPC、NDM、SME、GES、IMP、OXA-48、SME、GES、VIM),引物设计见表1。
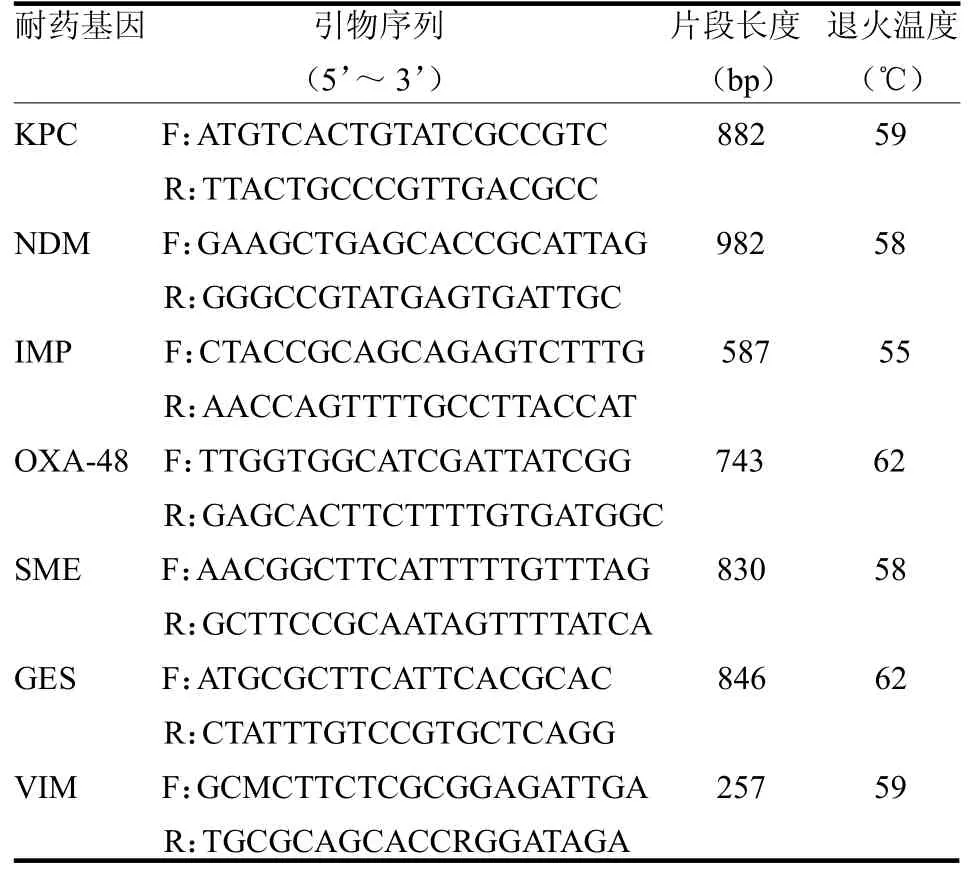
表1 CR-HvKP 耐药基因、血清荚膜型、毒力基因引物序列及反应参数
1.8 血清型和毒力基因检测 采用ABI 7900 荧光定量PCR 仪对样本进行PCR ,检测菌株的血清分型和毒力基因,引物设计见表2。

表2 血清型和毒力因子引物序列及反应参数
1.9 MLST 分型 参照肺炎克雷伯菌MLST 数据库(http://bigsdb.pasteur.fr/klebsiella/klebsiella.html)对hvKP 菌株的7 个管家基因进行扩增和测序,以序列型(sequence type,ST)表示结果。细菌基因组DNA 提取同1.6.1 部分所示,目的基因包括gapA、phoE、pgi、infB、mdh、rpoB、tonB;PCR反应体系共25l,其中上游引物、下游引物各0.5l、DNA模板5l、2×Taq PCR masterMix 12.5l、ddH2O 6.5l。条件:94℃预热2min,94℃变性30s、50℃退火1min、72℃延伸30 s,共35 个循环,72 ℃终延伸7 min。引物由上海生物工程技术有限公司完成,并与美国Blastn 公司的分析软件进行比对,获得菌株ST 号。
2 结果
2.1 碳青霉烯耐药hvkP 菌株的流行情况 CRKP 230 株,排除同一患者的重复分离株,其中分离出CR-hvKP 32 株(13.91%),痰液18 株、尿液9 株、血液2 株、引流液1 株、肺泡洗液1 株、大便1 株。
2.2 32 例患者的临床特征 32 株CR-hvKP 涉及22 例患者,其中男占53.13%(17/32),年龄>72 岁占43.75%(14/32),平均年龄(78.8±14.1)岁。临床诊断包括肺部感染、脑出血后遗症、脑动脉瘤破裂、脑梗死后遗症、脑外伤后综合征、脑动静脉窦及运动障碍等。
2.3 32 株CR-hvKP 菌株的耐药性分析 32 个CRhvKP 样本全部表现为多重耐药,特别是对亚胺培南、卮他培南、哌拉西林/他唑巴坦、氨苄西林/舒巴坦的耐药率达到100%,见表3。
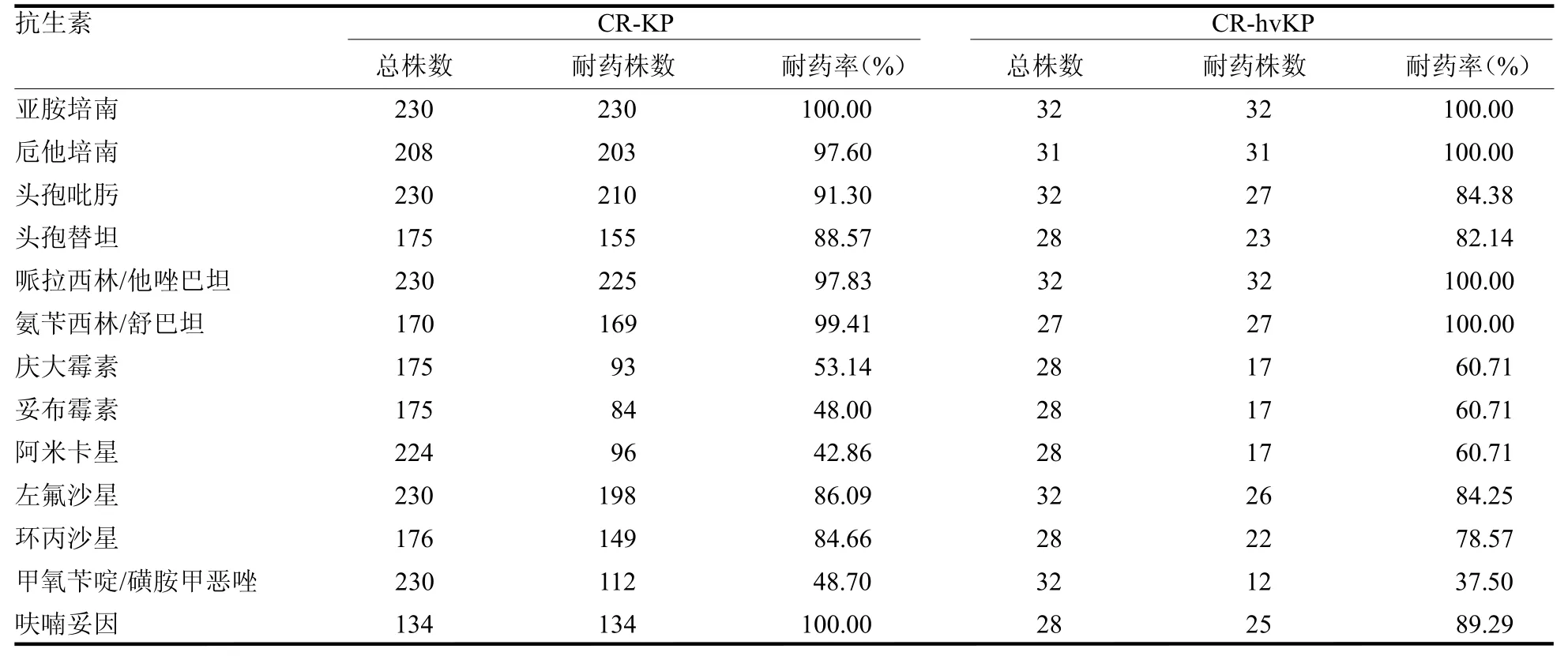
表3 CR-KP 和CR-hvKP 常见抗菌药物耐药率
2.4 表型筛查 在待测菌株线与大肠埃希菌抑菌圈交汇处出现苹果蒂样的生长增强现象,提示结果阳性,待测菌株产碳青霉烯酶,见封三彩图3。
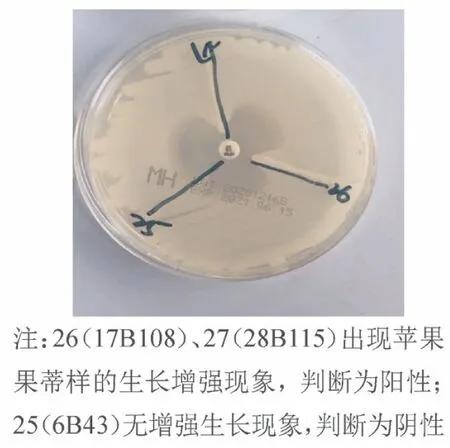
图3 改良Hodge实验(部分)结果
2.5 表型确认 按照碳青霉烯酶表型检测缓冲液说明书对耐药菌株的碳青霉烯酶表型进行检测,见封三彩图4。

图4 碳青霉烯抑制剂增强实验
2.6 毒力基因、耐药基因及血清型基因的PCR检测结果 这些菌株中,93.75%(30/32)携带KPC-2 基因,3.13%(1/32)携带NDM 基因,而18.75%(6/32)携带GES 基因。所有菌株均表现出高黏附性。在血清型方面,K1 和K2 型各有2 株,K5 型有1 株。常见的毒力基因中,rmpA 和iroN 的携带率分别为56.25%(18/32)和59.38%(19/32),而aerobactin 和magA的携带率较低,分别为18.75%(6/32)和6.25%(2/32)。这些数据突出了CR-hvKP 在耐药性和毒力特性方面的多样性,见表4。
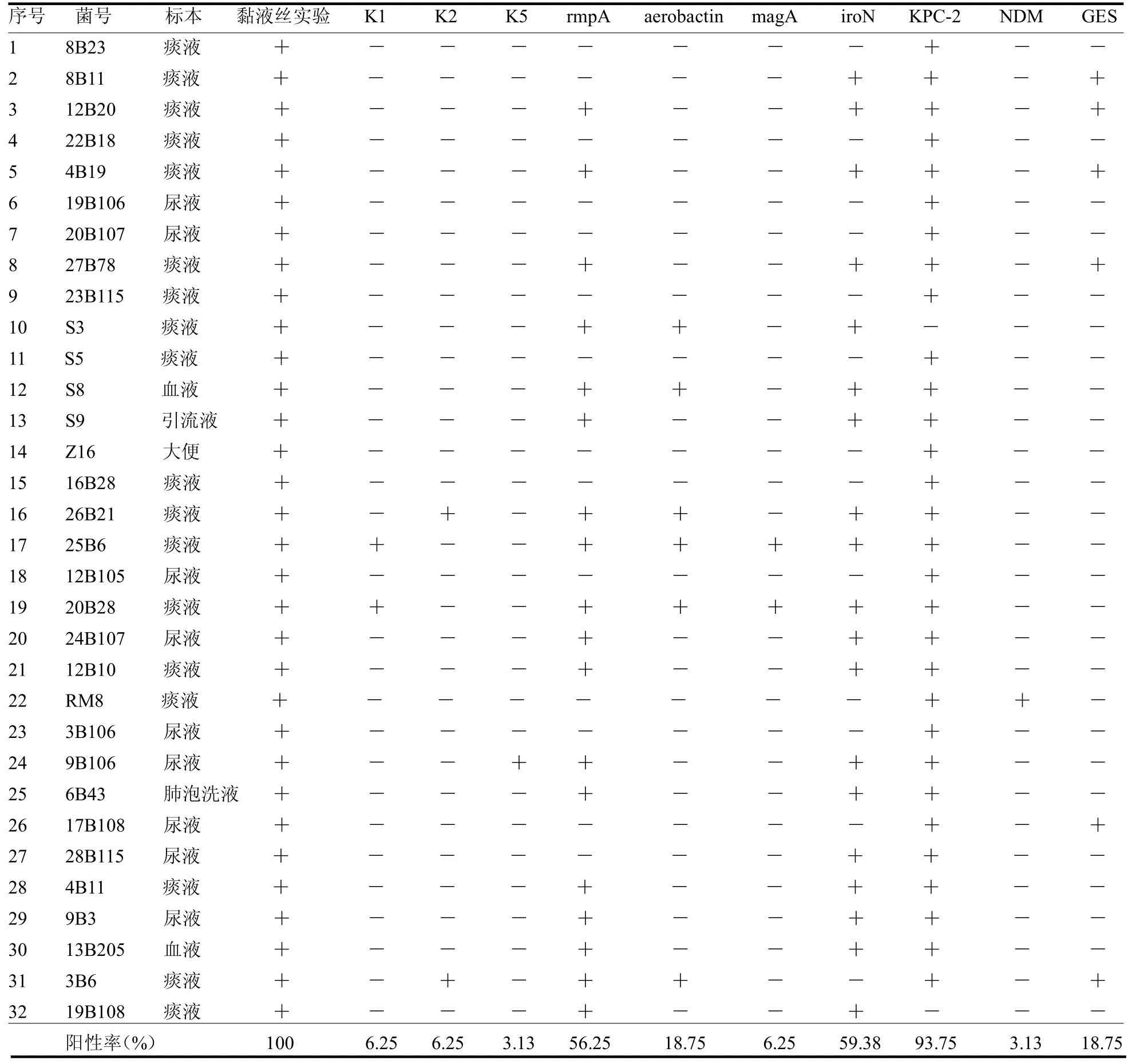
表4 32 株碳青霉烯类耐药血清型及高毒力肺炎克雷白菌基因型
2.7 hvKP 的MLST 分型 32 株hvKPMLST分型如下,ST11占40.63%(13/32),ST15占6.25%(2/32),ST188占3.13%(1/32),ST65 6.25%(2/32),ST23 占18.75%(6/32),ST869.38%(3/32),未分型占15.63%(5/32)。
3 讨论
hvKP所致感染性疾病越来越受研究者重视,一些研究证实,hvKP的多重耐药相关基因和高毒力相关基因之间不存在相互重叠状况,大多数使用频率较高的抗生素(除氨苄西林)广泛应用于hvKP感染,极为敏感,耐药率极低,临床上对hvKP 感染的诊治比较即时[5]。目前,产超广谱-内酰胺酶大肠埃希菌(ESBL-EC)、头孢菌素酶(AmpC)等多重耐药菌致使重症感染的首选用药为碳青霉烯类抗生素[6],然而,包括CRKP 在内的CRE,随着这些药物广泛应用于临床而上升幅度明显[7],检出率呈逐年上升态势。
研究发现,CR-hvKP 感染主要影响免疫力低下的患者,尤其是脑血管疾病患者,这加剧了多重耐药性问题。老年人尤其是年龄>78 岁的更容易受到CR-hvKP 侵袭。这一点与以往研究认为青少年更易受hvKP 影响的观点相对立[8],然而其他研究表明老年人易受hvKP 感染[9-10]。此外,本研究结果显示CRhvKP 感染主要通过呼吸道、血流和尿路途径,这对预防措施的制定具有指导意义。
本研究也揭示了CR-hvKP 的耐药性特征,特别是对关键抗生素如亚胺培南和哌拉西林/他唑巴坦的高耐药率,与常见的CRKP 耐药性相似[11]。32 例感染CR-hvKP 的患者有多病合并,免疫力低,独立杀灭细菌能力弱的临床特点。因此,及时根据药敏试验结果进行治疗是非常重要的。如有必要,可找到感染部位,并通过引流和清创进行治疗。
本研究结果显示CR-hvKP 分离株中大多数携带KPC-2 型碳青霉烯酶基因,这是国内CR-hvKP中最常见的耐药机制;少量产NDM 型碳青霉烯酶,未探测到OXA-48、VIM、IMP 等基因。同时,本研究发现有1 株CR-hvKP 菌株未检测到任何碳青霉烯酶基因,笔者猜测可能是ESBLs 或AmpC 酶合并孔膜蛋白缺失或低表达所致[12]。此外,毒力基因的分析结果显示,rmpA 和magA 等关键基因在CR-hvKP中普遍存在,这些基因与细菌的致病能力和生物膜形成能力相关[13]。rmpA 是肺炎克雷伯菌的重要致病因子之一,主要负责调控荚膜的合成,是黏液表型的重要调节因子,促进细菌表面保护性生物膜的形成[14],负责调控荚膜合成rmpA的基因主要位于毒力质粒,如pLVPK、pLVPK-like 质粒[15]。magA 也是肺炎克雷伯菌的致病因子,主要见于K1 型hvKP 菌株引起的肝脓肿,可对抗补体系统、抗白细胞吞噬[12]。
本研究结果发现与hvKP 相比,CR-hvKP 的血清型分布较为分散,没有明显的集中趋势,提示CRhvKP可能具有多样的演化背景和传播途径,与早前研究结果不同[15]。这提示收集更多的CR-hvKP 菌株去探求其血清荚膜型的分布情况尤为重要。荚膜多糖、毒力相关基因、铁载体系统与hvKP 的临床侵袭能力和致病能力相关联。荚膜为肺炎克雷伯菌细胞壁的特殊结构,在多个过程,如肺炎克雷伯菌黏附、抗血清杀菌、抗白细胞吞噬和定植等发挥作用[16]。
利益冲突 所有作者声明无利益冲突
作者贡献声明 金晓立:实验操作、论文撰写;陈飞、叶雯凝、曾云祥:数据整理、统计学分析、研究指导

