血清25羟维生素D水平与宫颈高危型人乳头瘤病毒感染及宫颈上皮内瘤变的关系
唐伊蔓,陈力畅,陈思思,金海红,孙咏梅,姜晓丹
1 河北北方学院研究生院,河北张家口 075000;2 河北北方学院附属秦皇岛市第一医院妇科;3 秦皇岛市第一医院妇科;4 秦皇岛市第二医院妇科
人乳头瘤病毒(HPV)是一种无包膜的球形DNA病毒,具有嗜上皮性,主要引起人类皮肤、黏膜的增生性病变。研究显示,高危型HPV(hr-HPV)持续感染可对患者宫颈上皮组织造成持续性损伤,是导致宫颈上皮内瘤变及宫颈癌发生的主要危险因素[1]。目前,已知hr-HPV的高危型级别及病毒载量是导致其持续感染的主要危险因素,但其他影响因素尚不明确。因此,进一步探究导致hr-HPV持续感染的危险因素,可能会为预防宫颈上皮内瘤变及宫颈癌进展提供新思路。维生素D是类固醇激素骨化三醇的重要前体,在人体中以25羟维生素D[25(OH)D]形式存在,除了参与体内的钙磷代谢外,还参与调节机体的免疫力、恶性肿瘤细胞增殖及分化[2]。维生素D参与调节免疫反应,较低水平的血清25(OH)D会导致先天免疫功能降低和感染易感性升高[3]。研究表明,血清25(OH)D水平与感染性疾病的发生关系密切,维生素D可通过介导体液免疫应答发挥免疫调节及抗病毒作用,其水平不足与多种类型肿瘤的发生风险有关[4-5]。目前关于血清25(OH)D与宫颈hr-HPV感染及宫颈上皮内瘤变关系的研究较少,为此我们进行了如下研究。
1 资料与方法
1.1 临床资料 纳入标准:①年龄21~65岁的女性;②有性生活;③行hr-HPV检查;④非妊娠状态。排除标准:①既往或正在接种HPV疫苗;②合并免疫系统疾病;③有宫颈疾病治疗病史;④合并肿瘤或接受放化疗;⑤近3个月内接受维生素D治疗。选取2022年8月—2023年7月于秦皇岛市第一医院体检并符合上述标准的女性1 197例,年龄50(44, 56)岁,其中hr-HPV阳性180例为阳性组、阴性1 017例为阴性组,年龄分别为48(41, 56)、50(45, 56)岁,两组年龄具有可比性(P>0.05)。选取2023年2月—11月因宫颈筛查异常于秦皇岛市第一医院妇科门诊行阴道镜检查者437例,依据阴道镜检查结果及活检病理结果分为非宫颈上皮内瘤变组237例(正常宫颈131例、慢性宫颈炎106例)、宫颈上皮内瘤变组200例[低度鳞状上皮内病变(LSIL)93例、高度鳞状上皮内病变(HSIL)95例、宫颈鳞状细胞癌12例]。非宫颈上皮内瘤变组年龄≤45岁116例、>45岁121例,BMI ≤24 kg/m2154例、>24 kg/m283例,产次<2次177例、≥2次60例,文化程度为高中及以下136例、大学及以上101例,每日户外日照时间<2 h 163例、≥2 h 74例,初次性生活年龄<18岁12例、≥18岁225例,性生活频率<4次/周171例、≥4次/周66例,性伴侣个数<2个219例、≥2个18例,使用避孕套102例,居住环境为城市164例、农村73例,有吸烟饮酒史24例。宫颈上皮内瘤变组年龄≤45岁106例、>45岁94例,BMI ≤24 kg/m2127例、>24 kg/m273例,产次<2次135例、≥2次65例,文化程度为高中及以下108例、大学及以上92例,每日户外日照时间<2 h 142例、≥2 h 58例,初次性生活年龄<18岁28例、≥18岁172例,性生活频率<4次/周121例、≥4次/周79例,性伴侣个数<2个160例、≥2个40例,使用避孕套77例,居住环境为城市145例、农村55例,有吸烟饮酒史45例。宫颈上皮内瘤变组初次性生活年龄<18岁、性生活频率≥4次/周、性伴侣个数≥2个、有吸烟饮酒史的比例高于非宫颈上皮内瘤变组(P均<0.05)。本研究通过医院伦理委员会审核(2022C017),受试者均签署知情同意书。
1.2 血清25(OH)D检测 采用化学发光免疫法。所有受试者入组后采集空腹静脉血2 mL,严格按照试剂盒说明书进行操作,检测血清25(OH)D水平。
1.3 统计学方法 采用SPSS26.0统计软件。计量资料采用K-S法检验正态性,呈正态分布以±s表示,两组间比较采用两独立样本t检验;非正态分布以M(P25,P75)表示,两组间比较采用Mann-WhitneyU检验。计数资料以n(%)表示,组间比较采用χ2检验。采用二元Logistic回归分析血清25(OH)D水平对hr-HPV感染的影响。比较非宫颈上皮内瘤变组和宫颈上皮内瘤变组的一般资料和血清25(OH)D水平,对差异有统计学意义的指标进行多因素Logistic分析。绘制血清25(OH)D水平预测宫颈上皮内瘤变的受试者工作特征(ROC)曲线,分析其预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 阳性组与阴性组血清25(OH)D水平比较 阳性组和阴性组血清25(OH)D水平分别为38.00(13.03, 131.43)、41.73(13.40, 236.70)nmol/L,两组比较P<0.05。
2.2 血清25(OH)D水平对hr-HPV感染的影响二元Logistic回归分析结果显示,血清25(OH)D水平降低是hr-HPV感染的独立危险因素(B为-0.013,SE为0.004,OR为0.987,95%CI: 0.978~0.995,P<0.05)。
2.3 宫颈上皮内瘤变组与非宫颈上皮内瘤变组血清25(OH)D水平比较 宫颈上皮内瘤变组与非宫颈上皮内瘤变组血清25(OH)D水平分别为40.8(34.9, 47.3)、45.1(38.25, 55.15)nmol/L,两组比较P<0.05。宫颈上皮内瘤变组中LSIL、HSIL、宫颈鳞状细胞癌患者血清25(OH)D水平分别为43.5(37.1, 50.5)、39.5(34.4, 45.3)、30.6(21.3,37.8)nmol/L,两两比较P均<0.05。
2.4 血清25(OH)D水平及一般资料对宫颈上皮内瘤变的影响 多因素Logistic分析结果显示,血清25(OH)D水平降低、初次性生活年龄<18岁、性生活频率≥4次/周、性伴侣个数≥2个、有吸烟饮酒史是影响宫颈上皮内瘤变的独立危险因素(P均<0.05)。见表1。
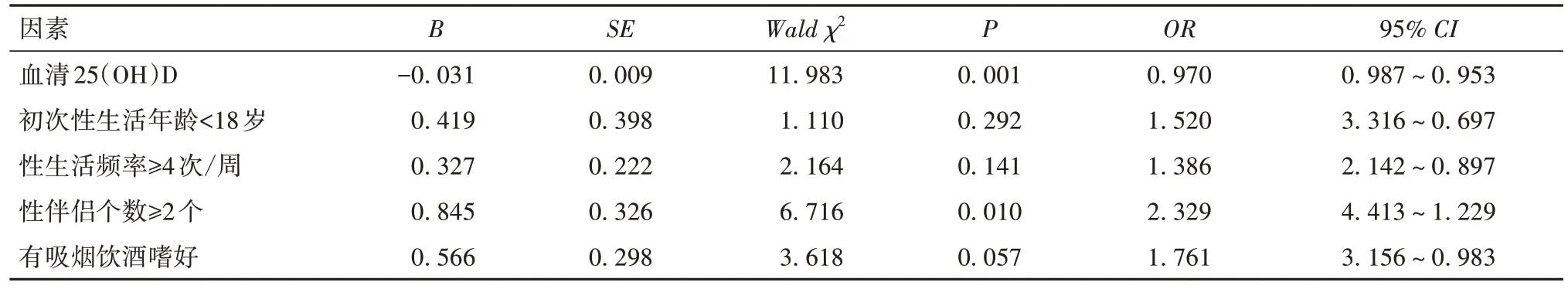
表1 影响宫颈上皮内瘤变的多因素Logistic回归分析结果
2.5 血清25(OH)D水平对宫颈上皮内瘤变的预测价值 血清25(OH)D水平预测宫颈上皮内瘤变的ROC曲线分析结果显示,血清25(OH)D水平预测宫颈上皮内瘤变的最佳临界值为49.15 nmol/L,此时约登指数最大,其预测宫颈上皮内瘤变发生的敏感度为83%、特异度为41%、曲线下面积为0.628(95%CI: 0.680~0.576,P<0.05)。见图1。

图1 血清25(OH)D水平预测宫颈上皮内瘤变的ROC曲线
3 讨论
据流行病学研究显示,hr-HPV持续感染是导致宫颈上皮内瘤变及宫颈癌的重要因素[6]。据统计,每年HPV引起的肿瘤占全球肿瘤的4.5%以上,其中HPV所致宫颈癌是排名全球第四的肿瘤,但同时也是可预防的肿瘤之一[7]。大多数HPV感染机体后会被自身清除,只有少数女性的HPV呈持续感染状态,并最终发展为癌前病变和癌变,这表明宿主防御机制在抵抗病毒感染的过程中发挥重要作用。当机体免疫力低下或感染其他病原体时,持续的HPV感染会造成宫颈上皮细胞内遗传物质失去稳定性,引发肿瘤细胞恶性增殖[8]。目前,针对宫颈HPV感染尚无特效药,只能通过定期随访、及时发现宫颈上皮内瘤变并在必要时进行干预来达到预防宫颈癌的目的。因此,关注宫颈HPV感染及宫颈上皮内瘤变的影响因素至关重要。
维生素D在体内作为一种免疫调节剂,多以25(OH)D形式存在。研究发现,低水平的血清25(OH)D可能会导致先天免疫功能降低,增加感染易感性和持续时间。研究显示,上呼吸道和下呼吸道感染(如流感、呼吸道合胞体感染)与血清25(OH)D水平呈负相关关系,并在冬季达到峰值,而冬季维生素缺乏更为普遍,而高水平的血清25(OH)D可以使急性呼吸道感染的发生率减少两倍,并缩短感染持续时间[9]。维生素D已被证实具有抗炎功能,分子及其代谢物缺乏可能是HPV持续感染和导致宫颈上皮内瘤变的一个原因[10]。一项来自美国2 353例性活跃女性的横断面研究表明,宫颈HPV感染率与血清维生素D水平降低相关[9]。本研究结果显示,阴性组血清25(OH)D水平高于阳性组,且血清25(OH)D水平降低是hr-HPV感染的独立危险因素,这与上述研究结果一致。
目前关于维生素D与HPV感染、宫颈上皮内瘤变相关性的研究较少。岳云[11]研究表明,随着宫颈上皮内瘤变程度的加重,患者血清维生素D水平逐渐降低。夏良萍等[12]、李湘等[13]研究均表明,低水平维生素D可能会增加宫颈癌的发病风险。本研究结果显示,血清25(OH)D水平随宫颈上皮内瘤变程度的加重呈递减趋势,且其水平降低是影响宫颈上皮内瘤变的独立危险因素;其预测宫颈上皮内瘤变的最佳临界值为49.15 nmol/L,此时预测宫颈上皮内瘤变发生的敏感度为83%、特异度为41%、曲线下面积为0.628。
分析维生素D水平影响宫颈HPV感染及宫颈上皮内瘤变发生发展的机制可能是:①女性的阴道和宫颈内皮细胞可以产生抗菌肽(AMPs),AMPs可将吞噬细胞吸引到感染部位,灭活病原体并增强固有免疫反应,而维生素D水平不足或缺乏可能会限制人体产生和调节AMPs表达的能力,从而降低了清除病毒能力[3,14];②维生素D通过上调促进紧密连接、间隙连接和黏附连接相关蛋白,使包括皮肤、呼吸道和泌尿生殖道在内的物理屏障对细菌和病毒的抵抗力更强,而充足的维生素D可能通过增强黏膜屏障而干扰HPV向基底层的渗透,相反维生素D不足则会增加阴道及宫颈上皮对HPV的易感性、降低宿主清除病毒的能力[15];③hr-HPV可产生E6和E7两种蛋白,干扰细胞周期、抑制细胞凋亡,与宫颈癌的发生发展密切相关,T淋巴细胞特异性免疫能够识别这两种蛋白,并通过免疫反应抑制其表达,实现抗肿瘤免疫反应,而维生素D被认为参与调节细胞介导的免疫反应,可通过调节T淋巴细胞的活性而达到抗肿瘤作用[16]。但具体机制尚未明确,有待进一步研究。
综上所述,血清25(OH)D水平下降可导致宫颈hr-HPV感染及宫颈上皮内瘤变的发生风险升高,血清25(OH)D水平有助于预测宫颈上皮内瘤变的发生,临床上能否通过补充维生素D达到减少HPV感染及宫颈上皮内瘤变发生的目的仍有待进一步研究。

