肺腺癌组织转化生长因子β1、鼠双微体2表达变化及其与患者临床病理特征的关系
韩晓丽,黄景涛,赵宝山,孙光蕊,朱翠敏,梁宗英
1 承德医学院附属医院胸外科,河北承德 067000;2 承德医学院附属医院肿瘤放化疗科
肺癌是全世界范围内发病率和病死率最高的肿瘤,约占肿瘤总病死率的20%[1]。肺腺癌是肺癌最常见的病理类型,也是非小细胞肺癌的病理类型之一。肺腺癌患者预后普遍较差,且具有遗传易感性。转化生长因子β1(TGF-β1)基因定位于染色体19q3,其配体存在于多种细胞表面,与多种肿瘤密切相关。TGF-β1经横跨细胞膜的丝/苏氨酸激酶受体发出,使Smad蛋白磷酸化,并将信号传导至细胞核,通过激活靶基因转录而发挥作用[2]。在肿瘤进展过程中,这种作用模式会影响上皮或间质蛋白表达,促进癌细胞发生上皮—间质转化(EMT),从而促进肿瘤转移。鼠双微体2(MDM2)是E3泛素连接酶RING家族成员之一,参与多种人体生命活动,包括肿瘤的发生和发展[3]。MDM2在肺腺癌组织中表达升高,与肺癌的进展和化疗耐药性等多个机制有关。2020年9月—2022年3月,本研究观察了肺腺癌组织中TGF-β1和MDM2的表达变化,并探讨二者与患者临床病理参数的关系,为研究肺腺癌发生发展相关的新型肿瘤标志物提供依据。
1 资料与方法
1.1 临床资料 纳入标准:①经外科手术切除且病理检查确诊为肺腺癌;②术前未接受过放化疗及免疫治疗;③临床资料完整。排除标准:①伴有严重感染或肝、肾功能严重异常;②合并其他恶性肿瘤或存在其他恶性肿瘤病史;③手术切除术后、术后辅助治疗开始前出现疾病复发、进展甚至死亡。选取同期我院收治并符合上述标准的肺腺癌患者60例,术中收集其肺腺癌组织和癌旁正常肺组织(距癌组织边缘>6 cm,病理证实为正常组织)各60例份。60例肺腺癌患者中,男21例、女39例,≥60岁36例、<60岁24例,吸烟22例,TNM分期:Ⅰ期25例、Ⅱ期22例、Ⅲ期13例,组织学分级:高分化10例、中分化41例、低分化9例,局部淋巴结转移23例。本研究通过承德医学院附属医院伦理委员会批准(LL2021028),患者及家属均签署知情同意书。
1.2 肺组织TGF-β1、MDM2蛋白检测 ①定位检测:采用免疫荧光法。将肺腺癌组织和癌旁正常肺组织脱水后石蜡包埋,连续5 μm厚度切片;烤片机65 ℃烤片120 min,常规脱蜡水化,PBS清洗,微波抗原修复打开甲醛固定造成的交联键暴露抗原表位,10%山羊血清封闭;加入TGF-β1、MDM2一抗(稀释比例分别为1∶ 100、1∶ 300),4 ℃孵育过夜。第二天温箱复温45 min,PBST清洗(曲拉松0.1%),加入荧光二抗,37 ℃孵育1 h,PBST清洗。避光条件下,使用DAPI试剂对细胞核染色,室温条件下PBST清洗3 min × 3次;滴加抗荧光淬灭剂,中性树脂稀释后,封片固定。荧光免疫结果判定:荧光显微镜下根据荧光的分布位置及强度,确定相应抗原是否存在及其所在部位。TGF-β1蛋白使用Alexa Fluor 488-conjugated羊抗兔荧光抗体标记信号显绿色,MDM2使用ATTO 594-conjugated羊抗鼠荧光抗体标记信号显红色,细胞核使用DAPI染色标记信号显蓝色。每张标本随机取5个不重复的高倍视野,按照荧光强度确定蛋白定位。②半定量检测:采用免疫组化法。将肺腺癌组织和癌旁正常肺组织脱水后石蜡包埋,连续5 μm厚度切片,冰冻切片恢复至室温,60 ℃烤箱烤片30 min~1 h,或80 ℃烤片15~20 min。将石蜡切片常规脱蜡复水,微波炉火力修复,自然冷却或放入通风橱中冷却至室温,PBS漂洗5 min × 3次。3%过氧化氢消除内源性过氧化物酶活性,37 ℃条件下加入10%山羊血清封闭45 min,加入TGF-β1、MDM2一抗(稀释比例分别为1∶ 100、1∶ 300),4 ℃孵育过夜,BSA代替一抗作为阴性对照;第二天37 ℃复温45 min,PBS漂洗5 min × 3次;滴加通用型酶标山羊抗小鼠/兔IgG聚合物,37 ℃温箱孵育20 min,PBS漂洗5 min × 3次。滴加配置好的DAB染色剂,并进行镜下实时观察,以控制最合适的显色时间。流水冲洗10 min,超纯水浸泡1 min,苏木素复染细胞核,依次梯度乙醇脱水,二甲苯透明。将中性树脂用二甲苯稀释至合适浓度,封片固定。免疫组化结果判定:每张切片在光学显微镜下连续观察10个高倍视野,以细胞核与细胞质中呈现棕黄色定义为阳性,计算阳性率,阳性率<5%为0分、5%~<25%为1分、25%~<50%为2分、50%~<75%为3分、≥75%为4分;按照着色强度评分:无色为0分、淡黄色为1分、棕黄色为2分、棕黑色为3分;两项评分相乘,0~3为阴性,>3为阳性。
1.3 统计学方法 采用SPSS25.0统计软件。计数资料以n(%)表示,结果比较采用χ2检验。肺腺癌组织中TGF-β1、MDM2蛋白表达的关系采用Spearman等级相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 肺腺癌组织和癌旁正常肺组织TGF-β1、MDM2蛋白定位情况 与癌旁正常肺组织比较,肺腺癌组织中TGF-β1、MDM2蛋白均呈过表达状态,TGF-β1大量表达于细胞质、少量表达于细胞核,MDM2绝大多数表达于细胞质。见OSID码图1。
2.2 肺腺癌组织和癌旁正常肺组织TGF-β1、MDM2蛋白阳性表达率比较 肺腺癌组织TGF-β1蛋白阳性表达42例份(70.00%)、MDM2蛋白阳性表达47例份(78.33%),癌旁正常肺组织分别为24例份(40.00%)、24例份(40.00%);肺腺癌组织TGF-β1、MDM2蛋白阳性表达率均高于癌旁正常肺组织(P均<0.05)。见OSID码图2。
2.3 不同临床病理特征的肺腺癌患者癌组织TGF-β1、MDM2蛋白阳性表达率比较 不同性别、年龄、吸烟情况的肺腺癌患者癌组织TGF-β1、MDM2蛋白阳性表达率比较差异均无统计学意义(P均>0.05)。淋巴结转移、TNM分期为Ⅲ期及低分化的肺腺癌患者癌组织TGF-β1、MDM2蛋白阳性表达率均高于无淋巴结转移、TNM分期为Ⅰ~Ⅱ期及高中分化者(P均<0.05)。见表1。
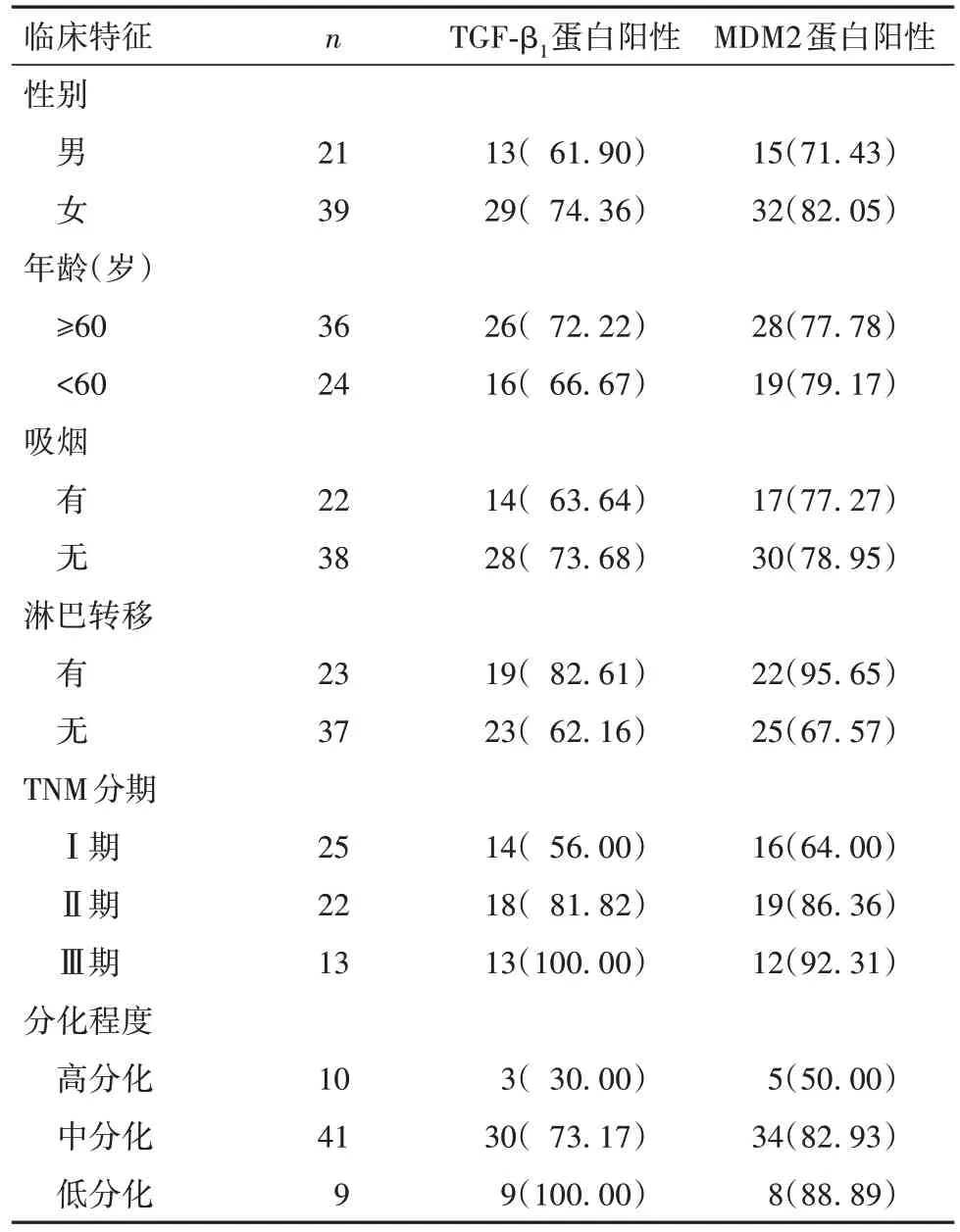
表1 不同临床病理特征的肺腺癌患者癌组织TGF-β1、MDM2蛋白阳性表达情况比较[例(%)]
2.4 肺腺癌组织中TGF-β1、MDM2蛋白表达的关系 肺腺癌组织中TGF-β1、MDM2蛋白表达呈正相关关系(r= 0.539,P<0.05)。见表2。
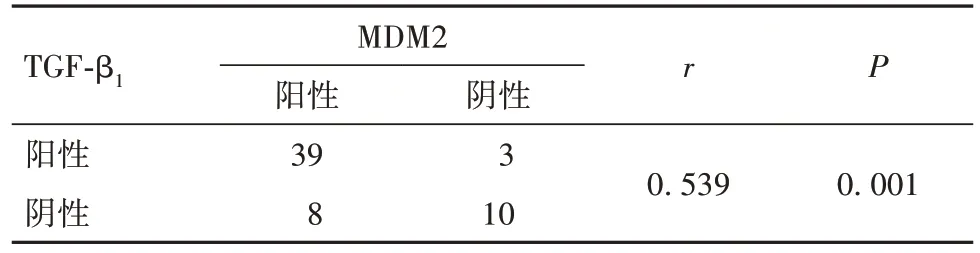
表2 肺腺癌组织中TGF-β1、MDM2蛋白表达的相关性分析结果
3 讨论
肺癌早期症状并不明显或典型,其诊断标志物尚不明确,导致检出率较低,部分患者被发现时已处于中晚期。而肺癌转移往往在早期就已发生,导致其病死率一直居高不下。因此,深入研究肺癌的生物学机制,及时有效地发现早期诊断标志物意义重大。
TGF-β1本质上是个多功能的多肽细胞因子,在早期胚胎发育和成人体内代谢平衡的维持中发挥重要作用。TGF-β1主要以复合物的形式存在于细胞外基质中,只有被激活才能与受体结合发挥功能[4]。研究表明,TGF-β信号失调与肿瘤发生有关,且其在肿瘤发生中的作用有明显双向性,在癌前细胞中是肿瘤抑制因子,在癌细胞中是肿瘤促进因子[5]。TGF-β参与肿瘤发生的典型通路为TGF-β/Smad通路,被外来信号刺激的TGF-β1配体结合并激活由Ⅰ型/Ⅱ型丝氨酸/苏氨酸受体(TGF-βRⅠ/Ⅱ)组成的四聚体复合物,激活的TGF-βRⅠ/Ⅱ随即磷酸化其下游的R-SmadS (Smad2和Smad3),Smad2和Smad3进一步与 Smad4结合,形成Smad2/3/4复合体后共同移位进细胞核,结合到特定DNA区域发挥作用[6]。研究显示,TGF-β1作为促癌因子,通过该通路经诱导EMT的方式促进乳腺癌[7]、肝癌[8]、宫颈癌[9]和甲状腺癌[10]等多种肿瘤进展,但其在肺腺癌中的报道较少。FAN等[11]研究发现,长链非编码RNA lnc01137可靶向增强TGF-β1Ⅰ型受体(TbRⅠ)的多泛素化和蛋白酶体降解,从而抑制TGF-β1/Smad信号通路传导,阻断肺腺癌的EMT转化。WU等[12]研究显示,lnc00941通过直接结合Smad4蛋白的MH2结构域来阻止Smad4蛋白降解,并与β-TrCP竞争性激活EMT,从而激活TGF-β/Smad2/3信号通路,加速结肠癌裸鼠的肺转移。除此之外,被有丝分裂蛋白激酶PLK1磷酸化的波形蛋白会进一步激活TGF-β1信号通路,这能使磷酸化Smad2/3蛋白募集到细胞程序性死亡配体1(PD-L1)启动子上,激发PD-L1产物的转录和翻译,同时催化肺腺癌发生EMT和免疫逃逸[13]。在TGF-β1的诱导下,PLK1还可以结合并磷酸化β-catenin第311位丝氨酸,使β-catenin稳定性增强,并与E-钙黏蛋白分离,推动非小细胞肺癌中EMT的发生[14]。本研究结果显示,肺腺癌组织中TGF-β1呈过表达状态,且其高表达与肺腺癌患者的TNM分期、分化程度及淋巴结转移有关,这提示TGF-β1促进了肺腺癌的发生,同时可能推进了肺腺癌的恶性转化和转移。
MDM2作为一个E3泛素连接酶,因与肿瘤抑制因子p53存在特异性泛素化结合位点而成为最重要的p53负性调节因子,其含有的环指结构可促进p53从细胞核向细胞质转移,从而减少p53转录,而其N端则存在结合位点标记p53,诱导p53的泛素化降解。MDM2在多种肿瘤中过表达,是主要的凋亡抑制蛋白之一,通过参与周期阻滞、细胞凋亡和DNA损伤修复等途径促进肿瘤的迁移和侵袭。研究显示,MDM2抑制剂处理的弥漫性大B淋巴瘤组织细胞周期阻滞在G1期,细胞凋亡率升高、细胞增殖能力受限,同时伴有p53蛋白表达升高[15]。MDM2对肿瘤的诱导作用可能还与基因扩增有关。LI等[16]研究发现,核糖体蛋白S27a(RPS27a)与RPL11在肺腺癌细胞p53的激活调控中存在相互作用,敲低RPS27a能在减弱该相互作用的同时,增强RPL11与MDM2结合,从而抑制MDM2对p53的泛素化降解,稳定p53,诱导肺腺癌细胞活力被抑制、细胞周期阻滞和细胞凋亡。本研究结果显示,肺腺癌组织中MDM2阳性表达率升高,并且与肺腺癌患者的TNM分期、分化程度及淋巴结转移有关,这提示MDM2可能通过某种途径促进了肺腺癌细胞的恶性转化,使其有了更强的侵袭和转移能力。
既往研究表明,TGF-β1可通过Smad依赖的方式激活MDM2,诱使其表达升高;MDM2也可激活信号通路中Smad的磷酸化水平,促进肺腺癌细胞增殖和EMT,而TGF-β1是主要的EMT诱导因子,因此EMT节点蛋白可能是二者联系的桥梁[17]。TGF-β1最重要的靶分子之一Snail是E-钙黏蛋白的强阻遏因子。Snail蛋白氨基末端存在一个高度保守的SNAG转录阻遏结构域,可特异性结合靶基因上游调控区,以起到特异性抑制基因转录的作用。因此,Snail作为转录抑制因子在肺癌等多种肿瘤中存在异常表达。国外研究报道,Snail的SNAG结构域可以与E-钙黏蛋白的CDH1启动子区域偶联,通过和组蛋白脱乙酰酶(HDAC)形成多分子复合物,从而阻滞E-钙黏蛋白转录而抑制其表达[18]。TGF-β1异常激活可促进Snail表达,进而使E-钙黏蛋白表达降低,而沉默MDM2会使E-钙黏蛋白表达升高和EMT进程受阻,提示二者在肿瘤发生发展中的作用存在联系。目前,关于TGF-β1和MDM2是否存在直接联系鲜见报道。本研究结果显示,肺腺癌组织中TGF-β1和MDM2的表达呈正相关关系。这说明TGF-β1和MDM2或许相互影响,共同促进肺腺癌的发生和恶性转化。其机制有两种可能:一是TGF-β1可能存在特异性泛素化结合位点,受MDM2泛素化调节而影响肿瘤进程,两者同时高表达可能是相互促进的结果;二是TGF-β1在肺腺癌中的过度表达可通过异常激活Smad,使得MDM2表达增加,同时影响E-钙黏蛋白和Snail的功能及表达情况,使肺腺癌细胞进一步发生EMT,进而导致肺腺癌恶性进展的表观遗传学基础。
综上所述,肺腺癌组织中TGF-β1、MDM2蛋白阳性表达率均升高,且淋巴结转移、TNM分期为Ⅲ期及低分化的肺腺癌组织升高更明显,二者可能共同参与了肺腺癌的发生发展,但其具体机制仍有待进一步研究,本研究结果或可为肺腺癌分子靶向治疗提供新的理论支持。

