黄酮类中药单体对溃疡性结肠炎信号通路调控作用的研究进展
毛琼 郑凯
溃疡性结肠炎(ulcerative colitis,UC)是一种多因素、难治性和复发性肠道免疫性疾病,以反复发作的里急后重、腹痛、黏液脓血便为主要特征。目前使用的5-氨基水杨酸(5-aminosalicylic acid,5-ASA)、糖皮质激素、生物制剂等西药可以用于UC的缓解,然而这些药物的副作用、高昂的成本、个体化的疗效和耐药性限制了它们在临床上的应用。近年来从中医药角度出发对UC的防治在医学界愈来愈受欢迎,中药的活性成分被深度研究,其中黄芩、金银花、姜黄、甘草、淫羊藿等中草药中黄酮类单体成分具有代表性。
黄酮类物质常见分子式是C15H10O2,分子量一般在200~500之间,以C6-C3-C6为基本碳架,由两个苯环及三个碳原子组成。根据中央三碳的氧化程度、是否成环、B环的连接位点等特点进行不同的化学成分分类,主要有黄酮、异黄酮、黄酮醇、黄烷酮、二氢黄酮、查尔酮等。研究证明黄酮类中药单体,如黄芩苷、芦丁、姜黄素、柚皮苷、木犀草素、苦参酮等通过不同机制起到抗自由基、抗氧化、抗肿瘤、抑制炎症反应、抑制细胞凋亡和抑制自噬反应等较强的缓解UC的作用。故本文对近年来黄酮类中药单体调控相关信号通路缓解UC的机制进行综述,旨在为中药减轻UC的研究提供理论依据。
1 干预NF-κB信号通路
核因子-κB(nuclear factor kappa-B,NF-κB)是细胞内重要的核转录因子,是许多信号转导通路的汇合点。作为一条经典的信号通路,其在UC的发病中占据重要的地位,是目前研究最多的治疗UC潜在作用靶点。本通路缓解UC的黄酮类中药单体数量众多,大多通过下调通路中下游中间产物的表达减轻UC症状。目前为止属黄芩苷的作用靶点最多,临床研究最广泛。
1.1 NF-κB信号通路及其与UC的关系
NF-κB广泛存在于人体各类组织中,调节控制机体的炎症反应、免疫应答,调节细胞凋亡及应激反应,对免疫系统的稳态至关重要。一般来说,NF-κB蛋白家族由p65(Rel A)、c-Rel、Rel B、p50和p52五个不同的成员组成,它们可以异源和同源地形成至少12种不同的识别二聚体。NF-κB是抗炎药物开发的重要靶分子[1],其中Toll样受体4(Toll-like receptors,TLR4)/髓样分化因子88(myeloid differentiation factor88,MyD88)/NF-κB p65通路在炎症过程中被广泛关注。TLR4作为先天免疫受体之一[2],可通过与脂多糖(lipopolysaccharide,LPS)等融合,经历构象改变和二聚化,募集到MyD88,继而诱导其下游影响因子κB抑制因子激酶(inhibitor of kappa B kinase,IKK)激活κB抑制因子(inhibitor of kappa B,lκB)蛋白,进行靶向磷酸化、泛素化和降解,最终释放出胞质中的NF-κB p65进入胞核发挥转录作用,产生各种促炎和炎症介质,包括肿瘤坏死因子-α(tumor necrosis factor- α,TNF-α),环氧合酶-2(cyclooxygenase-2,COX-2),白介素-6(interleukin-6,IL-6)等。大量研究证实了MyD88依赖性信号通路在UC发生发展中的重要性[3]。
1.2 涉及NF-κB信号通路的缓解UC的黄酮类中药单体
黄芩苷是众多黄芩有效成分中含量最高、研究最广、相对安全的[4]。黄芩作为葛根芩连汤、黄芩汤、白头翁汤等经典治痢方中的主药,具有清热燥湿、泻肺肠火之功,偏治热痢。黄芩苷早先被证实消除实验性结肠炎的机制是靶向抑制TLR4/NF-κB通路激活[5]。SHEN等[6]进一步发现采用不同剂量的黄芩苷作用于三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid sol,TNBS)诱导的UC大鼠模型,机体氧化应激指标超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性均增加,丙二醛(malondialdehyde, MDA)含量降低,凋亡因子半胱天冬氨酸蛋白酶-9(Caspase-9),炎症因子白介素1β(interleukin 1β,IL-1β)和TNF-α以及通路相关因子NF-κB p-65、IKK、IKB的含量相比模型组水平显著降低。当对500 ng/ml LPS诱导的RAW264.7离体结肠炎细胞使用IκBα抑制剂、IKK抑制剂和黄芩苷时,结果显示黄芩苷能显著抑制p-IKBα/IKBα含量的变化,但对p-IKKβ/IKKβ无显著影响,提示黄芩苷通过IKK/IKB/NF-kB信号通路发挥保护粘膜的氧化应激损伤、抑制结肠细胞凋亡、对抗炎症因子的作用。
黄芩素也是从黄芩中分离的一种黄酮类中药单体,其在黄芩中含量较少,约0.04%~0.28%[7]。相比黄芩苷善于调节UC大鼠的大肠损伤,黄芩素对小肠治疗效果更好[8]。研究发现黄芩素能够通过调节NF-κB的活性达到抗炎效果[9-10]。另有研究通过连续7天使用3.5%的葡聚糖硫酸钠(dextran sulfate sodium,DSS)处理小鼠建立UC模型,在造模前后给予两种剂量的黄芩素, 结果显示两治疗组小鼠的肠上皮细胞中NF-κBp65的入核率明显低于结肠炎组,同时肠上皮细胞、单核巨噬细胞中异常激活释放的炎症因子以及NF-κB通路的相关因子信使RNA(messenger RNA,mRNA)表达水平均低于结肠炎组,提示黄芩素对UC的保护作用与其抑制TLR4/My D88/NF-κB信号通路有关[11]。
淫羊藿苷又名淫羊藿素。淫羊藿,性温不寒,具有强筋骨、温肾壮阳之功,善治真阳不足之痢。研究发现淫羊藿素对LPS诱导的小鼠巨噬细胞内NF-κB蛋白的表达具有明显的抑制作用,随后用淫羊藿素给结肠炎小鼠灌胃,其体内结肠组织的NF-κB蛋白也得出相同结果,同时体内结肠组织及体外巨噬细胞中一氧化氮(nitric oxide, NO)和IL-6的含量也降低,证实了淫羊藿素通过抑制NF-κB通路传导,下调其介导的炎症因子的表达,从而达到治疗UC的作用[12]。
毛蕊异黄酮是从豆科植物蒙古黄芪干燥根当中提取而来的一种异黄酮类中药单体。黄芪甘温而润,脏腑虚损诸病常用之,偏治“中气不足痢”。刘超等[13]进行体外细胞实验,发现毛蕊异黄酮可以抑制LPS诱导的巨噬细胞中炎症因子IL-6和TNF-α的mRNA表达。研究进一步发现,50 mg/kg毛蕊异黄酮可以抑制DSS或TNBS诱导的UC小鼠的疾病进展,减轻其杯状细胞及其隐窝形态的破坏性,降低黏膜损伤,减少炎症细胞浸润,调节大肠组织中氧化应激反应,并下调IKKα、IKKb、IkBα和p65蛋白磷酸化水平,提示这一过程与抑制NF-κB信号轴密切相关。
柚皮素属于从芸香科植物中提取的一种二氢黄酮类中药单体,是枳壳、骨碎补、化橘红等中药的主要有效成分之一。DONG等[14]建立了两种小鼠模型,使用DSS溶液模拟急性损伤的肠粘膜,结肠内注射TNBS则模拟T细胞介导的抗原免疫反应,运用转录组学结合功能实验发现过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor-γ,PPAR-γ)表达在两种结肠炎模型中均显著降低,柚皮素通过增加主要靶点PPAR-γ表达,使其与NF-κB p50/NF-κB p65二聚体结合,抑制IκBα的降解及核转录因子NF-κB的表达,降低炎症因子与凋亡相关蛋白的指标,在两种模型中均发挥其抗UC的作用,当使用PPAR-γ抑制剂后柚皮苷的保护作用被逆转。说明柚皮素能通过抑制NF-κB通路来减轻UC炎症损伤。
此外,还有研究表明木犀草素[15-16]、金丝桃苷[17]、芦丁[18]和蒙花苷[19]也能通过激活NF-κB通路减轻UC炎性损伤。
2 干预MAPK信号通路
丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)作为一条高度保守的信号通路,将细胞外信号转换成细胞内部的基因表达,参与人类多种疾病的发病机制,其与UC之间的关系是近年来新的研究热点。本通路发现的治疗UC的黄酮类中药单体数量上尚少,但其研究角度较广,不局限在其抗炎功能,还涉及肠细胞膜上基因表达的调节。
2.1 MAPK信号通路及其与UC的关系
在哺乳动物中,MAPK家族有三个主要组成部分:细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)、c-Jun N-末端激酶(c-Jun N-terminal kinases,JNKs)(JNK1/2/3)和p38MAPK家族(四种亚型α、β、γ和δ)。在炎症性肠病(inflammatory bowel disease,IBD)患者的肠粘膜中,p38α在MAPK家族中表现出最强的激酶活性[20]。p38MAPK这一概念早在1994年被提出,受物理因素、生长因子、细胞因子等细胞外刺激后,p38从胞浆转移到细胞壳上,介导下游转录因子磷酸化协调细胞反应,包括细胞凋亡、释放大量炎症因子TNF-α和IL-1β等[21-22]。使用p38MAPK抑制剂对IBD小鼠的治疗显著起效[23],再次证实了MAPK通路在IBD的肠道炎症因子产生和T细胞活化中起关键作用。
2.2 涉及MAPK信号通路的缓解UC的黄酮类中药单体
姜黄素对IBD患者肠道中关键疾病介质p38MAPK表达呈负向调节作用[24-25]。Epstein等[26]首次研究姜黄素在人离体肠道细胞和组织中的作用机制,用姜黄素预处理儿童和成人IBD患者离体的结肠粘膜活检组织和结肠肌成纤维细胞(colonic muscle fibroblasts,CMF),结果显示其抑制p38MAPK通路的激活,下调了IL-1β表达,上调了白介素-10(interleukin-10, IL-10)表达,同时其剂量依赖性地抑制CMF中的基质金属蛋白酶,抑制肠粘膜蛋白乙酰化,限制其进一步组织破坏,减少活化的中性粒细胞流入炎症应激的肠道,说明姜黄素能通过激活MAPK通路减轻的UC炎症损伤。
α-山竹黄酮又名倒捻子素。YOU等[27]用DSS溶液诱导结肠炎小鼠模型,结果显示α-山竹黄酮能抑制ERK1/2、应激活化蛋白激酶((stress-activated protein kinase, SAPK))/JNK和p38的磷酸化,上调α-山竹黄酮在UC靶组织中的分布,降低其在小肠和结肠中的代谢,恢复UC模型表面上皮细胞的损伤和粘膜下水肿等炎症反应,提示α-山竹黄酮在UC治疗中的有效性与激活MAPK信号通路密切相关。
甘草黄酮B是从豆科植物甘草中提取的含量极低的一种异戊二烯类黄酮。ZHANG等[28]用甘草黄酮B处理建立DSS诱导的UC小鼠模型,发现LB能抑制包括JNK、ERK1/2和p38等MAPK通路相关因子的激活,下调肠道相关促炎因子的浓度,升高抗炎因子IL-10的水平,改善包括溃疡、炎性细胞浸润、纤维肉芽组织增生和隐窝萎缩等粘膜损伤,直接作用于结肠上皮而保持肠屏障的完整性。同时中高剂量的甘草黄酮B可下调拟普雷沃氏菌属和啮齿真杆菌的数量,上调回肠杆菌的数量,恢复由DSS引起的细菌结构变化。从分子力学角度证实,甘草黄酮B通过阻断MAPK途径发挥抗UC作用。
此外,还有研究表明木犀草素[29]也能通过调控MAPK信号通路抑制炎性细胞因子的表达,减轻UC的损伤。
3 干预JAK/STAT信号通路
Janus激酶(the Janus kinase, JAK)/信号转导与转录激活子(signal transducer and activator of transcription, STAT)是继NF-κB信号通路后又一重要的炎症调节通路。近年来本通路相关缓解UC的黄酮类中药单体主要通过两个方面发挥作用:(1)抑制JAK/STAT通路,调节包括NF-κB、Th17/Treg等相关过程来直接抑制炎症因子的表达;(2)通过JAK/STAT通路发挥免疫应激及细胞凋亡等作用间接阻断炎症反应。
3.1 JAK/STAT信号通路及其与UC的关系
JAK是抑制促炎因子的重要靶点[30-31]。JAK/STAT信号通路由JAK、STAT和酪氨酸激酶(tyrosine kinase,TYK)相关受体3个成分组成。JAK被激活后转移三磷酸腺苷的磷酸到酪氨酸残基上进行磷酸化,随后激活STAT家族成员进入细胞核参与基因转录,完毕后返回胞质等待下一次的活化[32]。已知四种不同的JAK分子(JAK 1-3、TYK2)和STAT家族的七个成员(STAT1-4、5a、5b、6)[33]。在STAT家族成员中,STAT3对T细胞分化中的影响最为重要[34]。JAK/STAT3信号失调导致CD4+T细胞分化异常以及调节性T细胞(regulatory T cell, Treg)活性缺陷被认为是IBD发病机制中的重要因素[35-36]。与淋巴细胞相比,JAK/STAT通路对IBD中的髓细胞具有更大的影响,UC中高水平的促炎细胞因子及低水平的IL-10与髓系细胞中的STAT3密切相关[37-38]。
3.2 涉及JAK/STAT信号通路的缓解UC的黄酮类中药单体
苦参酮是一种二氢黄酮类中药单体。苦参性味苦寒,有清热祛湿之功,可用于治疗“湿热痢”。LI等[39]通过LPS诱导的RAW 264.7细胞从苦参总黄酮中筛选出苦参酮,随后在DSS诱导的UC小鼠模型中研究其作用,结果发现苦参酮能恢复脾脏和肠系膜淋巴结的免疫细胞分化平衡,并抑制肠道JAK2/STAT3信号传导,下调了介导辅助性T细胞17(T helper cell 17,Th17)分化的维A酸相关孤独受体-γt mRNA的表达,减少Th17细胞的浸润,增加Treg细胞的表达,证实苦参酮可通过阻断JAK2/STAT3信号通路,促进介导Th17/Treg平衡,维持肠道免疫的稳态环境。
芦丁又名芸香苷,是存在于中药荞麦及大黄叶中的柑橘属黄酮醇类中药单体。大黄性味苦寒,为芍药汤之主药,历代医家善用其荡积推陈。刘佳妮等[40]先通过Docking计算机模拟发现芦丁可与JAK2蛋白结合,后用SPR技术检测发现芦丁与JAK2蛋白之间具有极强的亲和力。采用2.5% DSS制备小鼠结肠炎模型,发现芦丁液灌胃可显著下调模型组中增加的一氧化氮合酶(inducible nitric oxide synthase, iNOS)和p-NF-κB-p65的表达,上调紧密连接蛋白表达,显著升高结肠组织杯状细胞数量,减少炎性细胞浸润,恢复黏膜结构,抑制凋亡蛋白活化半胱天冬氨酸蛋白酶-3(cleaved-Caspase-3)的表达,显著降低模型组中JAK2及STAT3蛋白磷酸化水平。提示芦丁可通过与JAK2蛋白结合抑制其磷酸化,进而抑制JAK2-STAT3信号通路的激活,阻断炎症反应,从而缓解了UC相关症状。
此外,还有研究表明姜黄素[25,41]、黄芩素[42]也能通过调控JAK-STAT信号通路抑制UC带来的炎症损伤。
4 干预Nrf2信号通路
近年来,核转录因子E2相关因子(nuclear factor E2-related factor 2, Nrf2)通路在氧化应激方面作用已得到广泛探索,过度氧化应激带来的肠粘膜损伤是UC密切相关的病理环节。本通路相关缓解UC的黄酮类中药单体均展现出强大抗氧化应激的肠粘膜保护功能,提示Nrf2有望成为UC治疗新靶点。
4.1 Nrf2信号通路及其与UC的关系
Nrf2是一种重要的细胞保护性转录因子,其活性主要由Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein,Keap1)负向调控[43]。当机体处在氧化应激状态时,Nrf2磷酸化并从Keap1结合位点释放进入细胞核,与相应启动子抗氧化反应元件(antioxidant response element,ARE)正向序列结合,激活细胞防御系统,提高细胞对活性氧(reactiveoxygenspecies,ROS)的清除能力,调控下游基因表达,如血红素氧合酶1(hemeoxygenase-1,HO-1)、GSH-Px等[44],起到抗氧化应激、抗炎症作用。研究表明,UC中存在明显的Nrf2/HO-1通路抑制,可能是导致其发生的关键因素之一[45]。机体受到刺激后,氧自由基生成增多,氧化失衡,机体代谢障碍,最终造成肠黏膜屏障功能损伤[46]。在DSS处理的Nrf2缺陷小鼠中,结肠脂质过氧化增加,氧化损伤严重,与Nrf2通路对抗氧化应激的关键作用一致[47]。还有体外实验研究发现使用Keap1-Nrf2-PPI抑制剂可以修复结肠炎细胞的保护作用,证实UC与Keap1/Nrf2信号传导途径相关[48]。
4.2 涉及Nrf2信号通路的缓解UC的黄酮类中药单体
山姜素多存在于姜科植物如姜黄、豆蔻、郁金等中。TAN等[49]用不同剂量的山姜素处理DSS诱导的UC小鼠模型,发现山姜素可以显著清除氧化自由基,减少过氧化产物产生,保护细胞免受氧化应激损伤,表现为HO-1表达增加,Nrf2的基因表达增加,MDA含量降低,SOD活性增加,另外山姜素还能调节肠屏障损伤,表现为肠紧密连接蛋白的上调。提示山姜素激活Nrf2/HO-1信号并调控下游IL-6/STAT3通路,从而改善UC肠上皮屏障功能。
葛根素又叫葛根黄素,属于异黄酮类中药单体。葛根性味甘、辛,凉,有解肌退热,升阳止泻之功,《伤寒论》中的葛根芩连汤为UC临床常用方之一。JEON等[50]通过DSS诱导结肠炎小鼠模型,发现葛根素呈剂量依赖性地降低了脂质过氧化产物MDA的活性,增强了抗氧化酶CAT、GSH和SOD的活性,显著提高Nrf2和下游抗氧化剂HO-1的蛋白质表达。研究进一步发现,葛根素通过防止紧密连接的丢失,改善了UC小鼠肠道屏障功能的破坏,与相同剂量的5-ASA起到相似效果。提示葛根素可通过Nrf2信号通路改善氧化应激,缓解UC的粘膜破坏。
刺芒柄花素又叫芒柄花素,是从中药黄芪中提取的一种异黄酮类单体。YANG[51]等通过DSS诱导有Nrf2基因和剔除Nrf2基因的两组结肠炎小鼠,发现刺芒柄花素能够抑制其TNF-α、IL-6和COX-2的表达,结肠组织中SOD、MDA、髓过氧化物酶(myeloperoxidase,MPO)和8-氧代鸟嘌呤(8-oxoguanine,o8G)的含量明显得到改善,从而达到治疗UC的目的。
此外,还有研究表明金丝桃苷[52]、木犀草素[53]等通过调控Nrf2通路来发挥改善UC氧化应激损伤的作用。
5 对其他信号通路的调控
5.1 Notch信号通路
Notch信号通路是目前自身免疫疾病研究的最新热点之一。Notch可调控肠上皮细胞更多地分化为吸收细胞,导致分泌细胞(如杯状细胞)减少[54]。人CD4+T细胞中Notch1信号的过度表达显著增加了促炎因子的分泌,介导炎症因子的失衡,可能是Notch信号通路导致UC发生发展的重要原因[55]。木犀草素是存在于金银花、紫苏等中药中的黄酮类单体,XIE等[56]发现木犀草素可以降低DSS诱导的UC小鼠炎症水平,增加肠道中紧密连接蛋白1(zona occludens 1,ZO-1)和闭合蛋白的表达,增加NCR+ILC3水平,促进环境稳态因子IL-22的产生,降低肠中促炎因子IL-17a和干扰素的水平,促进Notch1的表达,在微生物群对免疫反应的增强和抑制不断发生拉锯的环境中保持屏障完整性,从而缓解溃疡性结肠炎带来的肠屏障损伤。此外,还有研究表明姜黄素[57]也能通过调控Notch信号通路缓解UC。
5.2 PI3K/Akt信号通路
磷脂酰肌醇 3-激酶(phosphatidylinositide 3-kinases,PI3K)/蛋白激酶B(protein kinase B,Akt)通路近年来最多提及的是与肿瘤相关的研究,同时也参与着UC的炎症及癌变过程。细胞受体及配体相结合,活化PI3K二聚体,继而招募靶蛋白Akt至胞膜,活化的Akt由细胞膜释放至胞质内磷酸化其下游的叉头转录因子(forkhead box,FoxO),FoxO出核后调控凋亡相关蛋白及炎症因子的水平。朱磊等[58]采用TNBS法制备大鼠UC模型,发现黄芩苷能剂量依赖性地抑制大鼠UC的炎症反应,抑制PI3K磷酸化,下调Akt的活化,发挥其抗炎作用。此外还有研究发现槲皮素也能通过抑制PI3K/Akt信号传导,有效提高闭合蛋白的表达,降低IL-1β、TNF-α和IL-6的表达,恢复肠道屏障和调节肠道微生物群在UC治疗中的作用[59]。
5.3 NLRP3信号通路
核苷酸结合寡聚化结构域样受体蛋白3(nucleotide binding oligomerization domain-like receptor protein 3,NLRP3)近年来是固有免疫方面的研究热点,本通路相关缓解UC的黄酮类中药单体多集中炎症下游机制。NLRP3是NOD样受体 (Nod-like receptor, NLRs) 家族成员之一,与凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)及效应蛋白共同组装成NLRP3炎症小体,可发挥修复损伤的肠黏膜组织、调控细胞的增值和凋亡,并可能通过影响肠道菌群的分布来调节肠道炎症反应[60]。IL-1β是该信号通路中研究较多细胞因子之一,被认为与Th2细胞的聚集及Th17细胞的分化相关。忍冬苷又名木犀草素-7-O-新橙皮糖苷,是存在于忍冬科植物山银花、山茱萸等中药中的一种黄酮苷类单体。研究先在体外细胞中证实忍冬苷显著抑制结肠巨噬细胞中裂解的Caspase-1、IL-1β和IL-18的蛋白表达,显著降低了结肠中NLRP3的蛋白表达。随后在DSS诱导的结肠炎小鼠中发现忍冬苷对调味增强子同源物2(enhancer of zeste homolog,EZH2)的抑制直接使NLRP3炎症小体失活,减轻结肠炎症[61]。此外姜黄素[62]、芒柄花素[63]、芦丁[64]、柚皮素[65-66]、汉黄芩素[67]等也能通过调控NLRP3信号通路缓解UC。
黄酮类中药单体对UC信号通路的调控作用及其分子靶点简表见表1。
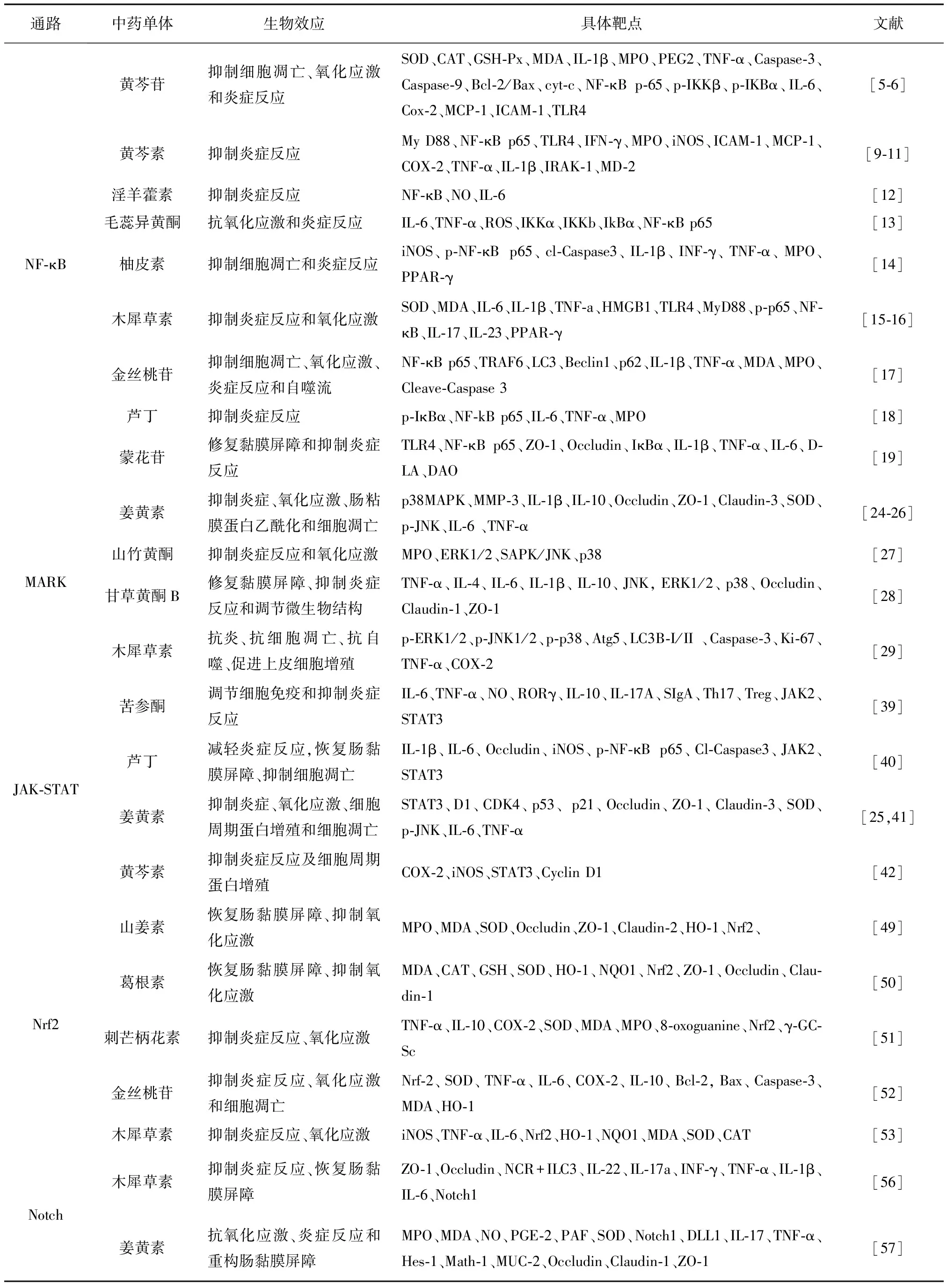
表1 黄酮类中药单体对UC信号通路的调控作用及其分子靶点
6 结语与展望
中医认为UC患者主要病机为湿热蕴肠,气血不调[68],本研究发现多靶点、多通路、疗效明确的黄酮类中药单体如黄芩苷、木犀草素、苦参酮等清热类中药提取物占最大比例,也证实清热法确是本病治疗一大关键。其次,多实验证明黄芪提取物毛蕊异黄酮和刺芒柄花素分别能多通路发挥中药的特点抑制UC,这与原生中药黄芪在临床应用上的表现也是高度符合,黄芪临床上用于治疗UC的频次可达25%[69],故其作为补脾要药治痢之功不可小觑。另外,姜黄、骨碎补等药物在中医古籍记载中并无治疗痢疾的功效,但实验研究进一步拓宽了中医治疗UC的药物品种。
综上所述,UC的发生与发展由不同信号机制参与,中药及其不同活性成分在不同的作用靶点上具有更复杂的药理特性,故中药缓解UC的机制必然涉及多个信号通路。但是现有研究仍存在不足,一是目前关于黄酮类中药的研究广度及深度不足,研究大部分集中在像NF-κB、MAPK等经典通路上,Notch、NLRP3等新兴通路研究报道较少,值得进一步挖掘。其次目前关于黄酮类中药调控UC信号通路的研究多以动物实验或者体外细胞为主,未来还可借助分子生物学、代谢组学等多组学技术进一步深入挖掘其药理作用机制。

