毕赤酵母中外源蛋白表达量的提升策略
茹扎·也里扎提 杨宇
(北京理工大学生命学院,北京 100081)
外源蛋白的重组表达是指将一个物种的蛋白质编码基因引入另一个物种的细胞(宿主细胞)中,从而允许宿主细胞表达外源蛋白质[1]。毕赤酵母(Pichia pastoris)已成为工业应用中蛋白质生产的常见菌株,被成功应用于1 000 多种外源蛋白的表达,许多外源蛋白基因在毕赤酵母中以g/L 水平表达,最高表达量已经突破10 g/L[2]。毕赤酵母表达系统具有三个方面的优势:(1)作为单细胞生物易于遗传操作,培养成本低;(2)在强大且严格调控的启动子下高效分泌外源蛋白;(3)具有进行翻译后修饰的能力,有益于生产可溶性和正确折叠的重组蛋白。虽然毕赤酵母表达系统经过多年研究已有较为深入的认识,但也存在一定的局限性。首先,毕赤酵母并不能重组表达所有我们感兴趣的蛋白。例如一些蛋白由于克隆变异、高糖基化、RNA 稳定性等问题导致的蛋白失活不表达的现象[3]。其次,有一部分外源蛋白尽管能在毕赤酵母系统中表达,但是表达水平仍有待提升的空间。因此,进一步探索提升毕赤酵母中外源蛋白表达量的原理和方法,将对降低赤酵母表达系统工业化生产成本,提高经济效益,具有重要的意义。
本文从基因水平、转录水平、翻译水平、折叠分泌水平、抗逆水平、发酵工艺六个方面归纳总结毕赤酵母提高外源蛋白表达的优化策略(图1),旨在全面地展示如何提高外源蛋白在毕赤酵母表达系统中的表达水平。为毕赤酵母作为工业规模的重组蛋白表达系统提供有益参考。
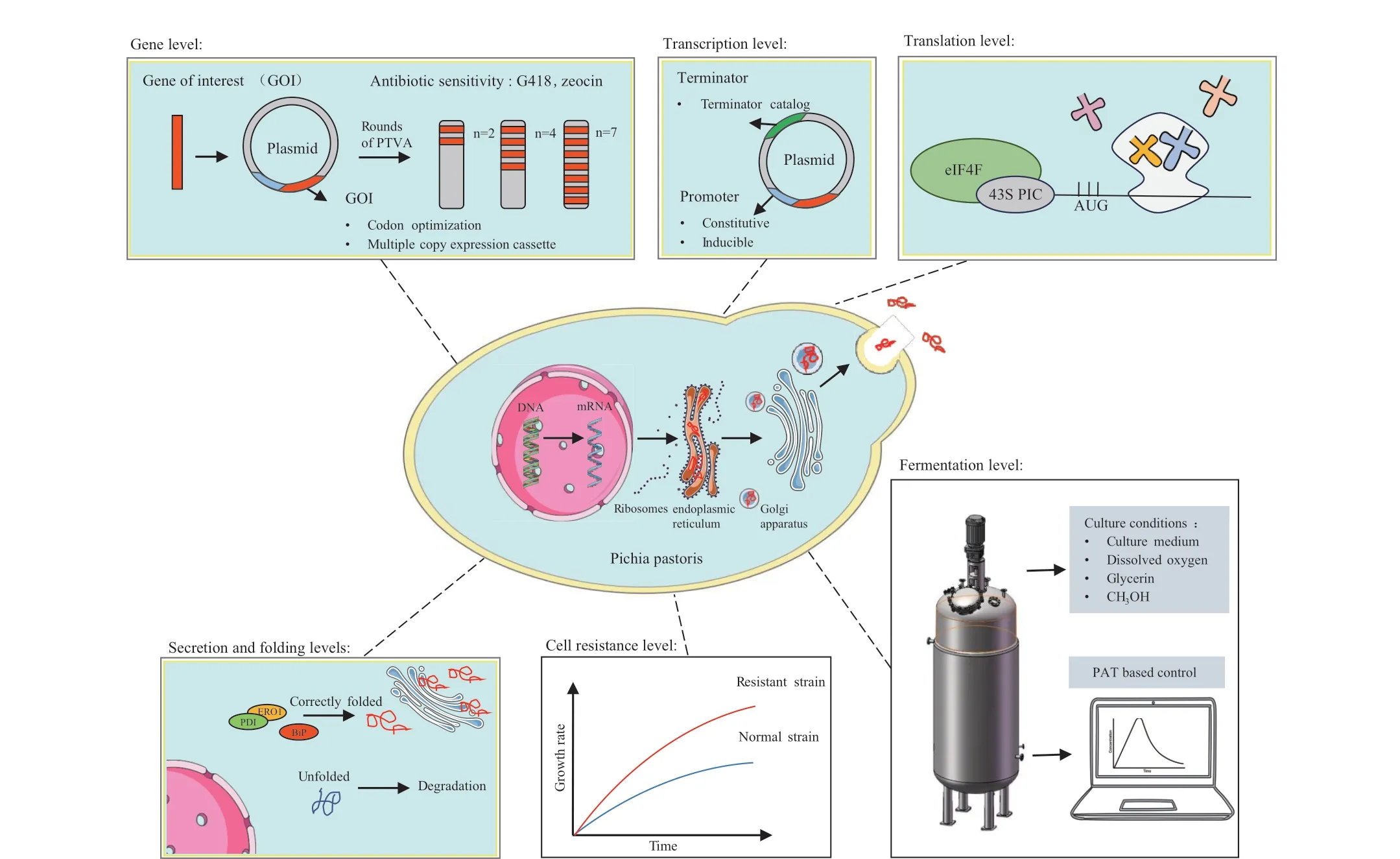
图1 毕赤酵母中外源蛋白表达的优化策略Fig.1 Strategies for increasing heterologous protein expression in Pichia pastoris
1 基因水平上提高外源蛋白在毕赤酵母中的表达量
毕赤酵母是工业中外源蛋白表达的成熟宿主系统,在基因水平上通过密码子优化和提高基因拷贝数是提高外源蛋白表达水平的常用方法。密码子优化常见的策略是使用首选密码子替换稀有密码子,以匹配密码子使用偏差。目的基因的高拷贝整合可以通过多拷贝表达载体或抗性筛选高拷贝转化子实现。
1.1 蛋白基因的密码子优化
不同的生物密码子使用偏好性不同,因此需要将外源基因的密码子优化为适合宿主的密码子。密码子偏好对基因表达的影响被认为是由于其介导翻译,密码子会通过翻译伸长率和准确性对翻译效率产生影响[4],并且密码子的tRNA 数量与该密码子的使用频率存在正相关关系。最新发现表明,密码子使用在决定基因水平上也有重要作用。使用不同密码子能微调mRNA 水平和稳定性[5],而mRNA 降解在调节细胞转录本水平中起关键作用,是调控基因表达的主要控制点。
在毕赤酵母中重组表达果胶酶时,序列经密码子优化后,果胶酶活性提高了20%[6]。Li 等[7]通过密码子替换,改变了20%乙酰胆碱酯酶基因总序列,使碱基GC 含量提高到46.85%,密码子适应指数(CAI)从0.70 提高到0.81。经密码子优化的乙酰胆碱酯酶酶活达到139.7 U/mL,是野生型菌株的62.2 倍。Wang 等[8]通过密码子优化显著提高了来自地衣芽孢杆菌的α-淀粉酶在毕赤酵母中的表达水平,经密码子优化的α-淀粉酶在5 L 和50 L 生物反应器中甲醇诱导50 h 后最高酶活为8 100 U/mL 和11 000 U/mL,分别是原来的2.31 倍和2.62 倍。
1.2 蛋白基因拷贝数的增加
基因拷贝数变化与转录水平的相关性较高,通过增加目的蛋白的基因拷贝数,可以提高生产率。迄今为止,毕赤酵母中高拷贝目的基因的构建主要通过体外法和体内法。前者是通过体外串联表达盒构建含有多拷贝的单个载体,获得含有多拷贝的重组质粒[9]。通过这种方法,Zheng 等[10]成功构建了含有甘露聚糖酶基因的1、2、4、6 个拷贝的载体并且在毕赤酵母中成功表达了具有功能活性的甘露聚糖酶。特别地,该研究表明4 拷贝的甘露聚糖酶表达水平大于6 拷贝的。同样地,Erden‑Karaoğlan等[11]使用不同DNA 拷贝数(1,2,3,4,5 和5 +)改善L‑天冬酰胺酶在毕赤酵母中的表达,发现3 拷贝菌株产量最高。可能是由于拷贝数的增加可能导致与蛋白质折叠相关的氧化应激以及碳和能量供应不足从而影响转录翻译水平。此类方法操作性强,但是由于载体大小的限制很难获得含有超过10 拷贝表达盒的载体[12]。
体内构建法是选择载体遗传标记检测,利用抗药性筛选(如G418、zeocin)富集载体拷贝数增加的菌株。转化后立即应用高浓度的药物通常导致耐药菌株的出现频率较低,所选序列的拷贝数较低,而转化后的多步选择往往诱导高耐药细胞的恢复,这些序列的拷贝数较多。所以通常采用转化后载 体 扩 增(posttransformational vector amplification,PTVA)的方法,利用抗生素浓度的增加逐步筛选高拷贝的抗生素耐药基因即目的基因[13]。该过程会导致抗性基因两侧同源臂片段而非整个载体的扩增,表明同源重组机制导致其产生多拷贝菌株[14]。如今,PTVA 法由于易操作以及成功率高等优点被广泛用于毕赤酵母,同时存在成本高的问题。后来有人对该法进行改进,提出了液体PTVA 法通过前期使用液体培养基的方式规避了费时费成本的问题[15]。
然而无论是体内、体外构建法,单纯追求高拷贝会影响转录翻译水平。实际上,不同蛋白有不同的最佳拷贝数,拷贝数并不是越高越好,增加拷贝数后产量不变或者减少可能是蛋白质折叠和分泌的限制。多拷贝菌株开发是影响毕赤酵母系统外源蛋白产生的关键因素,所以必须根据每种蛋白质的性质筛选合适的多拷贝菌株进行优化。
基因水平上提高外源蛋白在毕赤酵母中表达量的应用及效果详见表1。
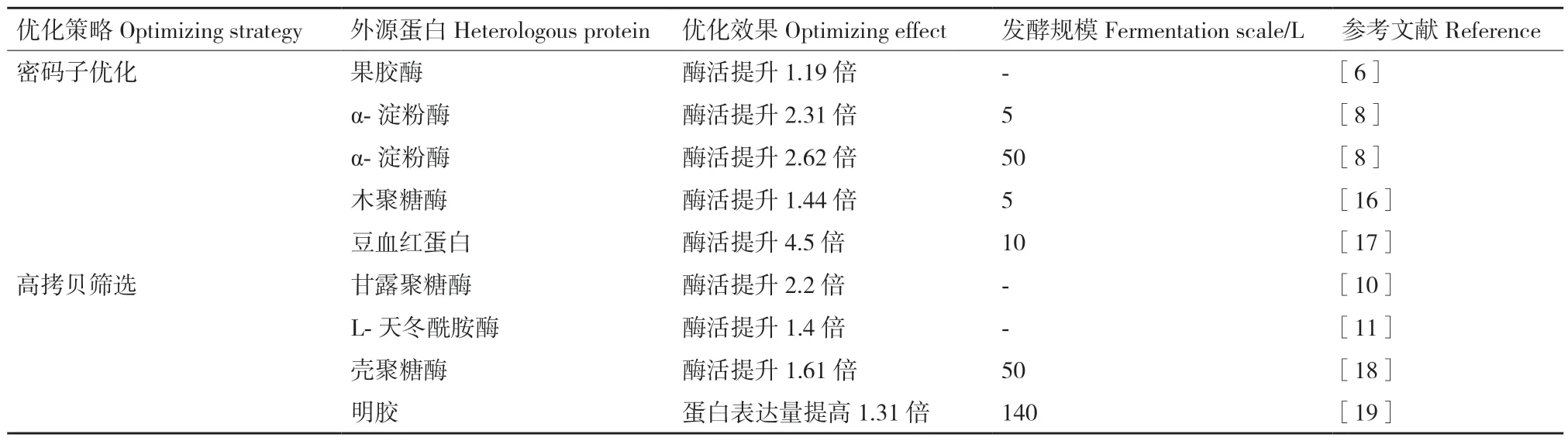
表1 外源蛋白在毕赤酵母中通过基因水平的优化提高表达策略Table 1 Gene level-optimizing strategies for enhancing heterologous proteins expression in P.pastoris
2 转录水平上提高外源蛋白在毕赤酵母中的表达量
启动子和终止子是特殊的DNA 序列,属于非编码区,负责调控基因的转录。选择合适的启动子和终止子可以提高毕赤酵母外源蛋白的表达。毕赤酵母转录时除了需要启动子、终止子等转录元件还需要转录因子协助,调节相关转录因子可克服外源蛋白的表达瓶颈(图2),因此识别和开发新的转录因子非常重要。
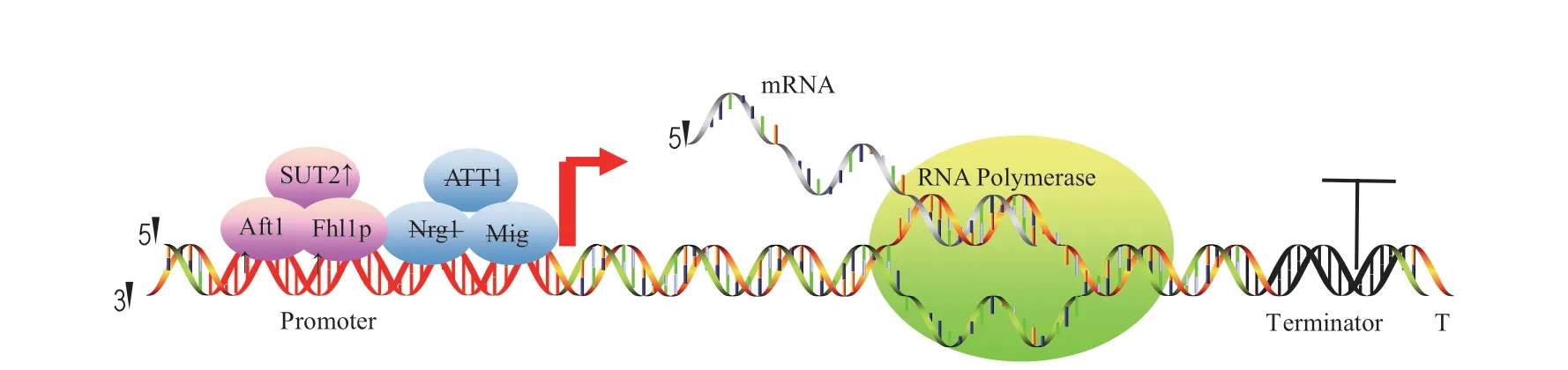
图2 转录水平上提高毕赤酵母中外源蛋白表达的示意图Fig.2 A workflow diagram of enhancing heterologous proteins expression in P.pastoris at transcription levels
2.1 启动子的合理选择
转录是外源蛋白生产的关键步骤,启动子作为转录过程的开关影响转录的起始及持续,最终控制目的基因表达的场所和地点[20]。因此,强大可控的启动子是高效异源蛋白的关键工具。毕赤酵母启动子主要分为诱导型启动子和组成型启动子,其中,最常用具有代表性的启动子为甲醇诱导醇氧化酶1(promoter alcohol oxidase 1, PAOX1)启动子和组成型甘油醛三磷酸脱氢酶(glyceraldehyde‑3‑phosp‑hate dehydrogenase, PGAP)启动子。
(1)PAOX1是一种在毕赤酵母中常用于生产重组蛋白的强效诱导启动子,外源基因在PAOX1的作用下表达量可高达 22 g/L(胞内蛋白)和14.8 g/L(胞外蛋白)[19],并且在生产过氧化氢酶[21]及腈水解酶[22]等重组蛋白时比另一大启动子PGAP更有效。由于毕赤酵母产生乙醇氧化酶(AOX),但AOX 对氧的亲和力很差,可以通过AOX1 和AOX2 两个基因的表达进行补偿,甲醇诱导的AOX1 启动子已被广泛用于构建载体。该载体有以下特征:①AOX1 启动子片段;②AOX1 终止区;③3'AOX1 区;④HIS4 标记基因;⑤ColE1 序列和用于亚克隆到大肠杆菌中的抗生素抗性基因;⑥通过同源重组将载体整合到宿主基因组[23]。上节中提到高拷贝菌株不一定高表达,其限制因素主要发生在转录水平上,原因是拷贝数增加伴有甲醇代谢和过氧化物酶生物合成的转录衰减,导致异源蛋白分泌水平下降[24]。甲醇代谢受Mit1 和Trm1p 转录因子影响,因此Mit1[25]或Trm1p[26]的上调可以提高PAOX1效率,通过过表达Mit1 可以提高外源蛋白表达。除此之外,poly(dA:dT)启动子元件的改变会影响PAOX1核小体形成及转录因子的结合,调整PAOX1的poly(dA:dT)元件可以调控启动子强度从而提升表达水平[27]。许多蛋白都能通过PAOX1成功表达,但是该启动子的缺陷在于需要甲醇诱导,而甲醇是一种有毒且易燃的化合物作为碳源存在危险。
(2)PGAP是一种表达水平与PAOX1相当的组成型启动子,因为消除了在大规模发酵中使用甲醇相关的安全问题,基于PGAP的毕赤酵母表达系统更适合大规模生产[28],许多基因已在该启动子驱动下在毕赤酵母中以g/L 水平表达[29]。几丁质酶通过PGAP调控在1.5 L 发酵罐中蛋白量可达300 mg/L[30]。为了重组蛋白的高效表达,PGAP常与目的基因多拷贝策略结合使用,最近研究显示葡聚糖酶首次通过PGAP高水平表达并在补料分批培养阶段体积生产率达到1 706 U/(L·h)[31]。PGAP已经通过上游调控序列的随机突变进行了工程化,AtaÖ 等[32]通过靶向删除或复制推测的转录因子结合位点(TFBS)构建了PGAP文库,并且使用PGAP突变体制备了滴度高于野生型PGAP启动子2.4 倍的人类生长激素重组蛋白。
(3)其他启动子。由于启动子在表达系统和生物过程效率中起着至关重要的作用,除了常用的PAOX1和PGAP,毕赤酵母启动子也在被不断开发和更新。甲醇诱导型启动子还有AOX2、DAS、FLD1,组成型启动子还有ENO1、YPT1 等[33]。其中,虽然AOX2 启动子表达外源基因水平是PAOX1的10%左右,但AOX2 在促进细胞成长中有所应用,可以用于生产高分子量透明质酸[34]。而DHAS 和FLD1启动子表达水平较强[35],类似于PAOX1。组成型启动子ENO1 表达水平是同类型PGAP的20%-70%[36]。YPTI 属于弱表达启动子,比用于表达目标蛋白的诱导型AOX1 启动子弱约1 000 倍[37],通过YPT1 启动子可以避免转录机制过载的问题,导致目标蛋白的表达水平降低。除了上述讨论的启动子,近年来新发现的毕赤酵母启动子也很有前景,如ADH3 启动子[38]、GCW14 启动子[39]、PDH 启动子[40]。不同类型的启动子对于外源蛋白的影响各有不同,为了使其在毕赤酵母中更好地发挥功能,应根据外源蛋白的结构、功能和特性选择适合的启动子或进行启动子工程改造达到研究目的。
2.2 终止子的合理选择
影响目的基因的转录水平的另一个因素是终止子,终止子在外源基因表达中的影响还没有得到太多的关注。终止子作为外源基因表达单元中的重要组成部分,它定义了3'‑非翻译区(3'‑ untranslated region,3'‑UTR),用于转录前RNA 分子的适当末端处理、切割和多腺苷酸化,以产生成熟的mRNA。已有证据表明,终止子通过影响mRNA 3'端加工、mRNA 稳定性和翻译效率等环节调节蛋白的表达水平[41]。Ramakrishnan 等[42]研究了终止子对Calb 基因表达的影响发现,终止子与低表达启动子PGAP偶联时,其影响被放大,展示出更高的酶活,以及显示出终止子相关的mRNA 稳定性增强。Ito 等[43]利用72 个终止子序列创建了“终止子库”,通过交换来自酿酒酵母或毕赤酵母的终止子可以在较宽范围(17 倍)内调节蛋白表达水平。
2.3 转录因子的过表达
转录因子是一种通过确定DNA 是否转录成RNA 来控制基因活性的分子,具有调节外源蛋白生产的巨大潜力,可用于增强蛋白表达。
Aft1 是一种亚铁运输的激活剂,在毕赤酵母中Aft1 并不直接参与铁的调节,而是参与碳响应调节。通过过表达Aft1,在补料分批生物反应器培养中能使羧基酯酶的分泌增加2.5 倍[44]。Aft1 的共表达显著提高了水蛭透明质酸酶的表达,在3 L 发酵罐中,水蛭透明质酸酶酶活达到2.12×106U/mL,产酶能力达到1.96×104U/(mL·h)[45]。
Fhl1p 是一种新的毕赤酵母转录因子,在毕赤酵母中调控rRNA 加工、高尔基体囊泡转运等过程,并有助于外源蛋白表达[46]。Fhl1p 的过表达对果胶酶和植酸酶的分泌具有显著的益处,活性分别提高了20%和35%,并导致细胞内mRFP 水平升高[46]。
锌簇蛋白SUT2 的表达可以被甲醇诱导但被甘油抑制,说明SUT2 可能参与甲醇代谢。SUT2 的过表达促进了AOX1 的表达,Yang 等[47]通过在不同位点截断假定的SUT2 启动子发现,ATG 起始的547-973 bp 区域被证明是诱导启动子PSUT2 的核心元件,该启动子对甲醇信号有强烈响应并驱动绿色荧光蛋白的表达提高了18%。
2.4 转录因子的去表达
毕赤酵母中转录因子的使用较广泛和灵活。一些情况下,可以通过敲除转录因子来改善酵母细胞对环境的适应能力以及提高外源蛋白的表达。
ATT1 是关于半乳糖代谢的转录因子,与糖代谢相关。糖代谢会改变糖基化途径对宿主细胞产生影响。沉默ATT1 基因使得人表皮生长因子受体‑2单抗产量提高了1.5 倍,达到1.98 g/L。不仅如此,ATT1 的去表达提高了宿主的耐热性,使其在35℃下能在15 L 发酵罐中生长150 h[48]。
Mig1 和Mig2 是抑制分解代谢的转录因子,能够抑制甲醇利用途径基因和PEX 基因[49]。毕赤酵母由于其强大的启动子PAOX1驱动的蛋白质表达能力而被广泛用于外源蛋白表达。但是关于该启动子甲醇诱导和分解代谢抑制的转录调控网络未完全阐明。Shi 等[50]发现毕赤酵母中PAOX1分解代谢的Mig 介导的转录抑制相关,敲除Mig 的酵母菌株在甘油作为碳源的条件下AOX 基因水平上调了30 倍,这表明Mig1 和Mig2 对PAOX1具有去抑制作用。
Nrg1 是一种转录抑制因子,作为DNA 结合抑制因子能消除葡萄糖对STA1 基因的抑制。与Mig 类似,可用于毕赤酵母中降低葡萄糖和甘油碳源环境对PAOX1的抑制[51]。而Mig1、Mig2 和Nrg1 三重基因敲除的突变体酵母菌株不仅能诱导AOX1 基因,还可以逆转过氧化物酶体增殖、生物发生和分裂缺陷[52]。
转录水平上提高外源蛋白在毕赤酵母中表达量的应用及效果详见表2。
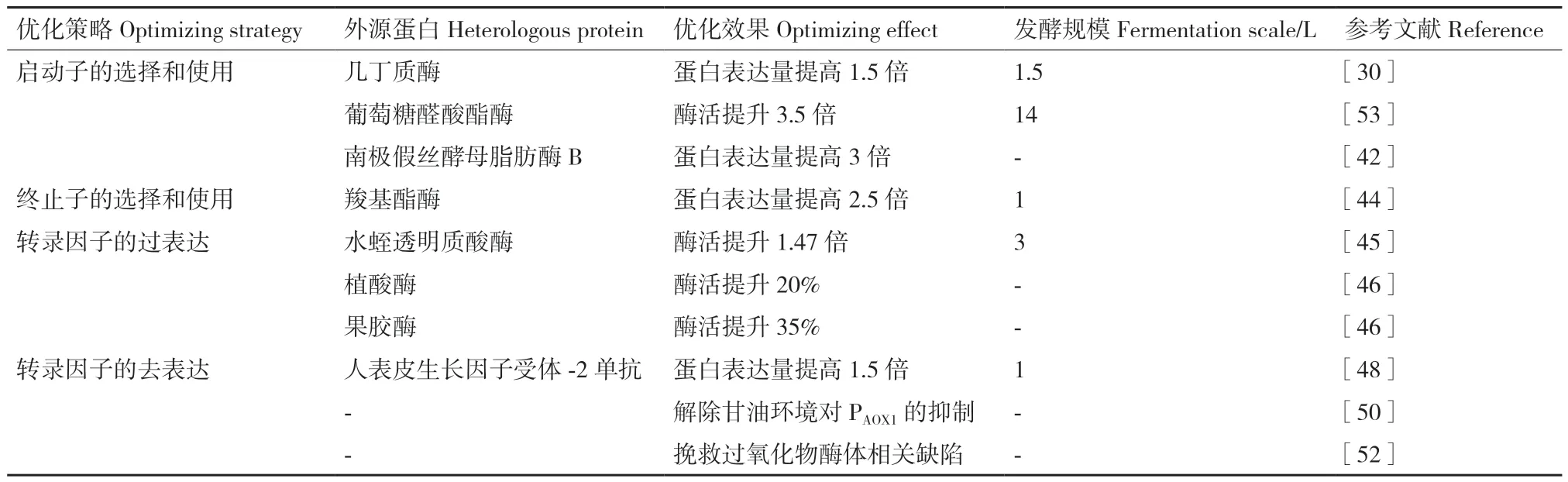
表2 外源蛋白在毕赤酵母中通过转录水平的优化提高表达策略Table 2 Transcription level-optimizing strategies for enhancing heterologous proteins expression in P.pastoris
3 翻译水平上提高外源蛋白在毕赤酵母中的表达量
翻译是基因表达过程中的重要步骤之一,但是目前利用毕赤酵母提高外源蛋白表达策略中翻译水平相关的报道较少。然而从mRNA 到蛋白的翻译过程还有大量变数,因此需要翻译调控快速应答。而翻译调控受翻译相关因子影响,通过上调相关因子的表达可以从翻译水平改善蛋白表达量。
3.1 翻译起始因子的过表达
酵母表达系统外源蛋白产率与酵母细胞生长密切相关,而酵母生长过程中不能持续保持高生长速率,使得蛋白产率的优化受到限制。翻译元件的过表达为提高翻译水平提供了思路,Rebnegger 等[54]分析了毕赤酵母的转录组数据并发现随着生长速度的降低,蛋白翻译相关基因明显下调。该团队观察到,翻译起始时Pab1 和eIF4F 分别与mRNA 3'poly(A)和5'cap 结合形成闭环结构。通过过表达与闭环结构相关的翻译起始因子eIF2、eIF3、Rli1、eIF4F 和Pab1 作为靶基因,证明翻译起始被确定为主要的限速步骤。过表达翻译起始因子可积极影响翻译活性和转录稳定性,且不依赖于使用的菌株、启动子以及模式蛋白,使不同重组蛋白产量提高3 倍[55]。该研究表明翻译起始的闭环结构相关的因子限制了酵母中蛋白质的合成。过表达此类翻译元件可以增强整体翻译活性,提高重组蛋白的产量。
3.2 核糖体生物合成因子的过表达
核糖体是mRNA 翻译的核心,是基因表达的关键过程。核糖体亚基组装过程涉及数百种非核糖体因子,称为核糖体生物合成因子(ribosome biogenesis factor, RBF),其功能是作为伴侣、修饰、加工、组装和重塑因子[56]。林影团队筛选出有利于外源蛋白表达的核糖体生物合成因子Bcy1,其过表达可以促进毕赤酵母细胞生长并提高报告蛋白荧光蛋白的产量[57]。对其进行进一步研究发现,Bcy1的过表达通过下调核糖体合成途径,提升了增强型绿色荧光蛋白和植酸酶的分泌积累并提高了植酸酶的产量[58]。
3.3 其他翻译相关元件的过表达
内部核糖体进入位点(internal ribosome entry site, IRES)具有募集核糖体的能力,无需依赖5'帽结构就可起始翻译启动蛋白质合成。林尧等发现,不同的 IRES 序列驱动的翻译效率会引起β-半乳糖苷酶活性的差异,并利用β-半乳糖苷酶α 肽为报告基因筛选出毕赤酵母中功能性的IRES[59]。
翻译水平上提高外源蛋白在毕赤酵母中表达量的应用及效果详见表3。

表3 外源蛋白在毕赤酵母中通过优化翻译水平提高表达策略Table 3 Translation level-optimizing strategies for enhancing heterologous proteins expression in P.pastoris
4 折叠分泌水平上提高外源蛋白在毕赤酵母中的表达量
为了表达感兴趣的蛋白,外源蛋白的正确折叠和分泌十分必要,该过程主要涉及信号肽的选择和分子伴侣的共表达。信号肽是引导新合成的蛋白质向分泌通路转移的位于蛋白N 端的短肽链,携带蛋白分泌信息,优化信号肽能将重组蛋白产量提高到具有商业意义的水平[60]。在分泌途径中,内质网在时空上维持着分子伴侣相互作用。分子伴侣形成的伴侣网络会影响蛋白质折叠、构象和稳定性。
4.1 信号肽的选择和优化
重组蛋白在酵母中的分泌表达需要信号肽引导进入内质网系统,这是新合成的蛋白质分泌表达的第一步[61]。常见的酵母信号肽有α-factor 信号肽、Killer 毒素信号肽、酸性磷酸酶信号肽(PHO1)、蔗糖酶信号肽(SUC)和菊粉酶信号肽(INU)等,其中α-factor 信号肽是毕赤酵母中最常用的信号肽,该分泌信号起作用的是19 个氨基酸α 因子的前体N 端部分,可以帮助外源蛋白翻译后易位到内质网[62],自身再被高尔基体中的Kex2 加工蛋白酶切割。α-factor 信号肽较其他信号肽更有效但也有进一步优化的空间,其翻译后易位机制容易导致一些蛋白在翻译后提前折叠,转移效率下降从而减少分泌。信号肽的效率决定了外源蛋白分泌表达,对α-factor 信号肽进行优化改造可以提高蛋白表达量。最近,张娜等[63]发现通过使用毕赤酵母高频密码子对α-factor 信号肽进行优化可以将葡萄糖氧化酶在毕赤酵母中的酶活力提高至野生型菌株的2.01 倍。Donelan 等[64]通过融合α-factor 信号肽与其他有益序列,利用嵌合前导序列OST1 与pro-αpp8 融合形成新型信号肽促进蛋白分泌,进一步提高了草酸氧化酶的产量和活性。而Püllmann 等[65]则是通过高通量筛选的办法开发了一种联合信号肽和启动子的洗牌系统,通过对11 个内源性和同源启动子与17种信号肽进行组合筛选,这种系统类似于定向进化可以用于在酵母中筛选真菌非特异性过氧化酶、脂肪酶CalB 和漆酶Mrl2 等。
教学实践中证明:在体育适性课堂中实施“一二·三六”教学模式,首先满足了学生的情感和兴趣,调动了学生的能动性;其次培养了学生学习的问题意识,让学生的学习有了重点,学会了学习动作技能的方法手段,为学生的终身体育能力打下了良好的基础;再次更是渗透了小班化理念,给学生提供了更大的学习空间,解决了利用场地器材、发挥教师专长等问题。体育适性课堂“一二·三六”教学模式目前还处于一个前期实践阶段,如何更有效、规范地开展,有待于我们在实践中不断深入探讨和完善。
4.2 分子伴侣的共表达
外源基因的高转录水平可能使毕赤酵母的蛋白折叠能力饱和,导致未折叠蛋白通过内质网相关蛋白 降 解(ER‑associated protein degradation,ERAD)。而分子伴侣蛋白可以通过帮助正确折叠(图3)新合成的蛋白质来减轻内质网的负担[61]。分子伴侣是一种辅助蛋白折叠,帮助其获得功能活性或者稳定构象,但不成为最后功能结构中的组分。常见的分子伴侣有二硫键异构酶(protein disulfide isomerase, PDI)、内质网蛋白折叠氧化还原辅助因子(endoplasmic reticulum oxidation 1, ERO1)、热休克蛋白(Saccharomyces cerevisiae heat shock protein SSA4,Ssa4)、免疫球蛋白结合蛋白(immunoglobulin heavy chain binding protein, BiP)等。

图3 分泌折叠水平上提高毕赤酵母中外源蛋白表达的示意图Fig.3 A schematic diagram of improving secretion and folding level of heterologous proteins in P.pastoris
PDI 在新折叠蛋白质中二硫键的形成和重排中起关键作用,通过参与内质网中二硫键的形成,PDI提高了毕赤酵母中内质网蛋白加工的能力。PDI 是一种常见的分子伴侣,在食品、药物和工业酶中被广泛研究。当巴西甜蛋白在毕赤酵母中与PDI 共表达后,其胞外蛋白量达到1 g/L[66],比先前报道的提高了2.5 倍。在另一则报道中,共表达PDI 提高了毕赤酵母表达人溶菌酶的酶活,虽然其胞外蛋白量没有明显上升但酶活提高了30.7%[67]。同样地,在毕赤酵母中共表达PDI 与杜邦嗜热菌脂肪酶(Thermomyces dupontii lipase,TDL)中酶活与蛋白浓度均提高了约1.4 倍[68],共表达PDI 在另一种杜邦嗜热菌脂肪酶(Talaromyces thermophilus, LIP1)中酶活也有提升[69]。共表达PDI 还能提高抗菌酶的活性,壳聚糖酶AqCoA 是一种抗菌抗炎类酶,它与PDI 共表达将酶活提高了31%[70]。为了提高分子伴侣PDI的效率,董聪等[71]构建了3 拷贝的PDI 与FAD 依赖的葡萄糖脱氢酶共表达的毕赤酵母重组菌株发现,其酶活比原来提高了83%。
ERO1 是一种内质网分子伴侣,ERO1 对于毕赤酵母中二硫键的形成至关重要。内质网应激诱导的ERO1 转录上调有助于改善蛋白质折叠,以提高细胞应对应激的能力[72]。研究发现,ERO1 也能增强毕赤酵母中AqCoA 的表达,特别地,当ERO1 与PDI 协同共表达使蛋白表达水平提高了42%[70]。分子伴侣共表达常常与多拷贝策略一起出现,例如,在毕赤酵母中表达腈水解酶时,分子伴侣ERO1 的共表达进一步提高了多拷贝菌株中腈水解酶的活性及腈水解酶基因的转录水平[22]。
Ssa4 是一种对外源蛋白具有积极影响的分泌辅助因子,属于hsp70(heat shock protein,热休克蛋白)基因家族。当细胞经历压力时会改变其基因表达模式,专注于制造恢复所需的蛋白质,于是大多数mRNA 被保存在细胞核内,而编码细胞恢复蛋白的转录本如Ssa4 被表达。Ssa4 蛋白通过重新折叠变性蛋白来帮助细胞从压力中恢复,负责转运初生蛋白到内膜,参与蛋白质折叠、转位及组装[73]。Jiao 等[74]发现,Ssa4 的共表达使米根霉脂肪酶的分泌水平增强45%,并且与其他协助因子Bmh2、Sso2 共表达活性会高于仅共表达Ssa4。Zahrl 等[75]对Hsp70 相关的分子伴侣蛋白做了细致研究发现,通过调节细胞质和内质网上的Hsp70因子循环会影响重组蛋白从细胞质到内质网的易位。当过度表达由Ssa1、Ydj1 和Snl1 组成的细胞质Hsp70 循环以及由Kar2、Erj5 和Sil1 组成的 内质网 Hsp70 循环时发现了最佳的协同效应,使得抗体片段Fabs 和scFvs 分泌量提高5 倍,滴度均达到1.3 g/L。
BiP 也属于Hsp70 热休克蛋白家族,是最重要的内质网伴侣蛋白。它在内质网中有两个作用:作为错误折叠蛋白的感应蛋白以及参与ERAD 途径减少蛋白错误折叠相关应激。据报道,共表达BiP 可以增强毕赤酵母中一些重组蛋白的分泌表达,但是效果参差不齐。在一项研究中,当BiP 与ERO1 共表达使红色念珠菌脂肪酶Lip1 酶产量提高46.5%[76]。同样地,过表达Bip 也可增强羧酸酯酶的表达,与原酶相比共表达BiP 蛋白的菌株活性提高了44%[77]。但应该注意的是,BiP 分子伴侣的作用具有蛋白质特异性。Yang 等[78]发现BiP 的共表达被证明对哺乳动物肽聚糖识别蛋白在毕赤酵母中的表达的分泌有害。
HAC1 是一种内质网响应蛋白,重组蛋白进入内质网后需要经历翻译后修饰并只有正确折叠才能离开内质网,最后进行胞外分泌。未折叠蛋白或错误折叠蛋白在内质网中的积累会触发未折叠蛋白响应(unfolded protein response, UPR)的激活[79]。而UPR 调节因子HAC1 的组成型表达可以减轻上游蛋白质合成并提高内质网中的下游蛋白质折叠效率,从而进一步改善了蛋白质生产。Bao 等[80]的研究证明,HAC1 的过表达能够将木聚糖酶在毕赤酵母中的产率从325 U/mL 提高到381 U/mL。Duan 等[81]通过3 种报告蛋白研究了HAC1 的作用,结果发现HAC1 的共表达使酵母增强型绿色荧光蛋白的细胞外产量提高了99%。
折叠分泌水平上提高外源蛋白在毕赤酵母中表达量的应用及效果详见表4。

表4 外源蛋白在毕赤酵母中通过优化分泌折叠水平提高表达策略Table 4 Protein secretion and folding levels-optimizing strategies for enhancing heterologous proteins expression in P.pastoris
5 细胞抗逆水平上提高外源蛋白在毕赤酵母中的表达量
在发酵过程中,毕赤酵母细胞会遇到来自溶解氧、温度等多种环境压力。这些环境压力可能会限制酵母细胞的生长,也会影响外源蛋白的表达。通过改善细胞抗逆水平可以提高酵母的环境耐受性以及提高外源蛋白的表达(图4)。

图4 毕赤酵母中提高细胞抗逆水平的示意图Fig.4 A Schematic diagram of improving cell resistance level in P.pastoris
5.1 溶氧量抗逆策略
溶解氧(dissolved oxygen, DO)是毕赤酵母发酵的关键参数,当酵母细胞在发酵过程中处于低溶解氧状态时,毕赤酵母的代谢途径会改变从而抑制外源蛋白合成。然而,透明颤菌血红蛋白(htreoscilla hemoglobin, VHb)可以通过促进酵母细胞的氧摄取效率增强呼吸和能量代谢[86]。因此,VHb 的共表达可以有效提高重组菌株在不同溶解氧浓度下利用氧气的能力,从而导致外源蛋白的产量更高。研究表明,通过胞内表达VHb 可以改善毕赤酵母中外源蛋白的表达。唐辉桂等[87]发现,在低氧条件下VHb 与植酸酶共表达,可将植酸酶的酶活提高3 倍,且对毕赤酵母细胞生长代谢无明显消极影响。汪小峰等[88]发现,在低氧条件下10 L 发酵罐中解脂耶氏酵母脂肪酶YlLip2 表达量提高了83%,总蛋白达6.79 g/L。最近该团队发现,在高DO 水平下(50%),当胞内VHb 和YlLip2 共表达时,YlLip2 活性达到7 650 U/mL,总蛋白达5.1 g/L,比对照组高出约21%。而在较低DO 水平下(10%),YlLip2 与VHb 共表达时,其活性为6 950 U/mL,是对照组的1.88 倍[89]。并且发现胞内表达VHb 的菌株与阴性对照菌株生长状态无明显差异,说明表达VHb 不影响毕赤酵母生长。同样地,限氧条件下VHb 与β-甘露聚糖酶共表达可将其表达量提高90%同时还提高了毕赤酵母对甲醇的耐受,缩短了发酵周期[90]。
5.2 热抗逆策略
温度是影响毕赤酵母发酵的重要因素,过高的温度会导致细胞存活率降低,影响外源蛋白的产量和活力。小热休克蛋白(sHSPs)在酵母热应激反应中起重要作用,可以作为分子伴侣在环境压力下帮助维持蛋白结构。研究发现,来自小热休克蛋白的热诱导基因CsHSP17.2 可以影响毕赤酵母耐热性。Wang 等[91]使用热激处理酵母菌株30-60 min 后,分析发现过表达CsHSP17.2 的菌株的生长速度高于对照,表明CsHSP17.2 的表达提高了毕赤酵母的耐热性。Lin 等[92]通过诱变和适应性进化获得了耐热的毕赤酵母突变体G14,并证明了G14 中的氧化应激反应(oxidative stress response,OSR)诱导了较强的过氧化物酶体,过氧化物酶体可以保护酵母免受耐热和氧化应激,起到OSR 缓冲作用。
5.3 氧化应激抗逆策略
甲醇诱导型毕赤酵母细胞由于代谢甲醇会产生过多的代谢副产物,如H2O2引起活性氧的积累,并通过损害活性氧清除系统诱导细胞氧化损伤,从而降低蛋白质表达能力[93],因此需要建立抗氧化防御系统。Lin 等[94]通过过表达与抗氧化相关基因CAT、SOD1、GLR1、AHP1、TRR1、ZWF1、GND2和GSH2,将脂肪酶的产量提高了1.6 倍。硫氧还蛋白(thioredoxin,Trx)能通过半胱氨酸硫醇-二硫键交换促进其他蛋白还原而起抗氧化剂作用。Li等[95]发现Trx 在毕赤酵母中显著增强了其对渗透压和氧化应激的抵抗力,并且充当二硫键还原酶和分子伴侣的角色。
细胞抗逆水平上提高外源蛋白在毕赤酵母中表达量的应用及效果详见表5。
6 发酵工艺上提高外源蛋白在毕赤酵母中的表达量
毕赤酵母非常适合发酵生长,在发酵过程中可以实现细胞的高密度生长。通过发酵可以提高蛋白产量,因此高密度发酵(high cell density fermentation, HCDF)成为毕赤酵母大规模生产外源蛋白的重要策略。将毕赤酵母HCDF 从实验室规模扩大到工业化示范具有重要意义,强力有效的HCDF 可以使外源蛋白表达达到商业生产水平。传统的HCDF 分为三个阶段:甘油分批阶段、甘油补料分批阶段和甲醇诱导阶段[96],其生物工艺操作参数,包括培养基组成、温度、pH、溶解氧、压力、接种量、诱导和进料策略,都会极大地影响产品的产量和质量。
6.1 培养基的选择和优化
培养基为毕赤酵母的生长提供必需的营养物质,其中碳源对菌体的生长和诱导表达有影响。毕赤酵母大多以甲醇作为碳源,而甲醇存在易燃易爆的安全隐患,Liu 等[97]报道以甲酸盐取代甲醇作为碳源和诱导剂,不仅安全、可持续还能使木聚糖酶产量增加(103.5±12.5)%。而Lee 等[98]则是通过开发了一种自诱导BYGM 培养基,缩短了筛选和培养时间并得到了与使用传统培养基表达水平相当的膜蛋白。Zhu 等[99]通过优化培养基将基础盐培养基盐浓度减少一半并纯化最终得到了产量高达17.47 g/L 的重组人血清蛋白,是迄今为止报道的最高的人血清蛋白产量。
6.2 溶解氧的控制
为了毕赤酵母作为好氧微生物,需要氧气参与代谢过程,溶解氧水平对于细胞和产物的生成密切相关。溶解氧过高或过低都会影响其代谢,毕赤酵母能在溶解氧水平为10%-50%范围内生长[100]。实验证明短暂缺氧和高甲醇会触发高水平重组蛋白的合成[101]。研究发现,毕赤酵母活性与活性氧积累有关,活性氧累积伴随细胞活性下降。Hu 等[93]发现,通过选择性平衡活性氧清除系统和减少对细胞的氧化损伤,控制0.051/h 的比生长速率能促进脂肪酶MAS1 表达。通过定期甘油和溶解氧浓度控制增强毕赤酵母的人类溶菌酶产量,Jia 等[102]利用该策略将活性氧控制在低水平,获得了更高的细胞密度。Liu等[103]则是专注于研究1 000 L 大体积发酵罐的优化策略,他们通过增加气压、降低溶解氧、调整甲醇进料速率替代纯氧补充的发酵策略提高了发酵水平,已在1 000 L 发酵规模下获得900 mg/L 的β 木糖苷酶。
6.3 分批补料策略的优化
选择合适的补料策略是至关重要的,近年来的补料流加策略主要有经典诱导策略、共饲养诱导策略和限制性诱导策略[104]。需要根据外源蛋白的特性选择合适的补料策略和工艺参数提升发酵水平,进一步提高毕赤酵母中重组蛋白的表达。通过优化分批补料策略微调甲醇和山梨醇的含量,可以将人生长激素[105]、马铃薯糖蛋白[106]、漆酶[107]等蛋白表达水平提升至1 g/L 左右。除了关注补料策略,pH 值对所需外源蛋白表达水平以及酵母菌株的影响是独特的,缺乏pH 控制会导致pH 值改变,从而抑制微生物生长和降低溶液中的蛋白浓度,温度也是一个关键参数。毕赤酵母能够在广泛的pH 范围(3.0-7.0)及温度(20-30℃)条件下生长[100]。
6.4 高密度发酵水平的分析监测
毕赤酵母在工业化生产中主要以分批补料的模式培养。培养过程中细胞环境不断变化,因此需要监测工艺参数和补料策略对酵母及目的蛋白的影响并进行微调。为降低试错成本,入罐发酵前可以通过动态通量平衡分析(dynamic flux balance analysis,DFBA)与转录组学数据相结合来模拟外源蛋白在补料分批策略的诱导阶段的生长[105]。DFBA 是经典通量平衡分析的扩展,可以预测和优化细胞外环境对微生物代谢的动态影响。Boojari 等[105]利用DFBA确定了发酵过程的关键操作参数,从而选择了合适的补料策略并进行了验证,最终利用该方法将重组人生长激素产量提高了85%。发酵过程中,可以应用过程分析技术(process analytical technology, PAT)进行实时监测,PAT 是一个对原料、物料及工艺参数进行实时监测的生产控制系统。PAT 系统可以利用多波长荧光和PLS 定量分析耦合生成定性定量的生物数据从而检测生物质、甲醇和产物等关键质量参数[108],从而控制发酵过程,提高发酵的效率和生产的稳定性。
发酵工艺上提高外源蛋白在毕赤酵母中表达量的应用及效果详见表6。

表6 外源蛋白在毕赤酵母中通过优化发酵水平提高表达策略Table 6 Fermentation level-optimizing strategies for enhancing heterologous proteins expression in P.pastoris
7 总结与展望
毕赤酵母是目前生产外源蛋白最常用和最受欢迎的宿主之一,它在蛋白表达产物的加工、外分泌、翻译后修饰等方面有明显的优势,现已广泛用于蛋白和酶制剂生产,然而其表达水平仍有待提升。本文概述了近年来研究人员在基因水平、转录水平、翻译水平、分泌折叠水平、抗逆水平、发酵工艺六个方面通过各类策略改善外源蛋白表达量并评价了其贡献。尽管通过上述策略在改善毕赤酵母中外源蛋白表达方面取得了重大进展,由于外源蛋白的复杂性和多样性以及毕赤酵母表达系统运行机制未被完全理解,一部分蛋白的表达水平仍然偏低或无法表达。因此,根据毕赤酵母的特性及已有研究,可以从分子水平和发酵水平着手,前者聚焦于解析毕赤酵母表达系统中外源蛋白的合成、修饰和分泌的原理,通过菌株改造和表达载体研发等方面开发新分子工具提高外源蛋白在毕赤酵母中的表达。后者需要从实时监测对发酵过程进行优化,利用生物信息学并采用自动化控制和生化检测技术为毕赤酵母高效表达外源蛋白提供更加有效可行的策略。主要分为以下几个方面:
(1)菌株改造是提高毕赤酵母表达效率的重要途径。通过更深入地了解毕赤酵母基因组和细胞代谢可以帮助指导筛选出一些关键基因,通过数学建模模拟细胞代谢及代谢通量分析并利用基因工程技术进行修饰改造,提高毕赤酵母的表达能力和生存能力。在细胞工厂设计中管理改善蛋白分泌所需的信息,敲除抑制外源蛋白表达的基因、增强蛋白折叠和分泌。例如,使用毕赤酵母蛋白酶缺陷性菌株可以显著降低蛋白质降解率。
(2)毕赤酵母的糖基化修饰作用会影响蛋白的活性和稳定性,这种影响对于不同的蛋白各有利弊。可以通过酵母糖工程,将特定蛋白改为最佳糖基化模式。例如消除酵母特有的糖基化,掺入与人类相似的糖基化途径将原有酵母糖基化模式改造为人类糖基化模式,从而将酵母表达的糖蛋白人源化,最终应用于药物蛋白生产。
(3)表达载体研发是提高毕赤酵母表达效率的可行方法。表达载体可影响表达外源蛋白生产的转录-翻译-分泌途径的不同步骤,通过处理编码重组蛋白mRNA 的转录和翻译,可以明显提高产量。当前商业化的毕赤酵母表达系统中,使用的表达载体种类有限,限制了毕赤酵母表达系统的工具多样性。因此,可以通过研发新型的质粒表达载体,提高目的蛋白的表达效率和稳定性。例如,除了上文提到的优化启动子、调节转录因子等方式,可以通过将转录和翻译增强元件引入用于毕赤酵母表达载体中,提高外源基因的产量。
(4)实时监测毕赤酵母代谢情况及外源蛋白的含量是优化发酵过程的必要手段。在发酵过程中,毕赤酵母通常被描述为一个黑盒,其输出与营养物质、代谢产物及副产物的消耗相关。因此,准确预测重组蛋白的生产仍然是一个需解决的挑战。选择合适的检测方法,并结合实时监测技术,可以实现对外源蛋白含量的准确监测和控制。例如,采用近红外光谱等在线监测技术实现实时代谢通量分析描述毕赤酵母生长过程。
总之,从分子水平着手,通过菌株改造和表达载体研发等方面来提高毕赤酵母中外源蛋白的表达效率,是毕赤酵母大规模工业化生产蛋白的前提基础。从发酵水平,选择合适的检测方法和监测技术为提高毕赤酵母中外源蛋白的表达提供有效手段。尽管本综述讨论的提高外源蛋白表达策略可以以组合的方式应用,对于目前工业应用的要求,大多数蛋白的表达水平仍有待提高。随着科技的不断进步和工业化生产的不断推进,相信毕赤酵母表达系统仍将有更多的突破和发展。

