微藻盐胁迫响应分子机制研究进展
沈天虹 齐孝博 赵瑞丰 马欣荣
(1.天津科技大学省部共建食品营养与安全国家重点实验室,天津300457; 2.天津科技大学生物工程学院,天津300457)
微藻是一类在显微镜下才能被识别的单细胞类群体,由真核微藻和原核蓝藻组成。真核微藻起源多系,并且具有漫长的进化历史。原核蓝藻,又称蓝细菌,是地球上出现的最早可以进行光合作用的原核宿主。微藻作为初级生产者之一,广泛存在于各种自然环境中,甚至在盐碱地和盐湖等极端环境中也能发现其踪迹[1]。作为光合生物,微藻能捕获环境中的CO2来合成主要代谢物,即碳水化合物、脂类、蛋白质以及一系列重要的商业化产品,如藻胆素、类胡萝卜素、甾醇、维生素等[2]。其中,中性脂类和碳水化合物被认为是适合生物燃料(生物柴油和乙醇)生产的初级生物分子[3]。因此,微藻被认为是一种极具应用前景的第三代生物柴油原料[4]。特别是富油新绿藻(Neochloris oleoabundan)、斜生栅藻(Scenedesmus obliquus)和三角褐指藻(Phaeodactylum tricornutum)等被认为是最具产油潜力的能源微藻[5-7]。此外,微藻能够从工业、农业和生活废水中固定氮和磷,吸附重金属,从而减少水质污染[8]。据研究报道,利用小球藻属例如普通小球藻(Chlorella vulgaris)、微小小球藻(Chlorella minutissima)、蛋白核小球藻(Chlorella pyrenoidosa)进行废水处理的应用实例较多,吸收效果显著,效率高达90%以上[9-11]。因此,微藻有着广阔的商业应用前景。图1 简要介绍了微藻在不同领域的应用。
图1 微藻在不同领域的应用Fig.1 Applications of microalgae in different fields
然而,育种工作者在对微藻的扩大培养过程中,发现盐度是限制其生物质生产力的最重要的环境因素之一。过量的盐分浓度会对微藻的生理、生化和代谢产生不利影响[12]。图2 显示了微藻中作为模式生物的淡水绿藻,莱茵衣藻(C.reinhardtii)在盐胁迫下的细胞形态、生理、生化和分子水平的变化。
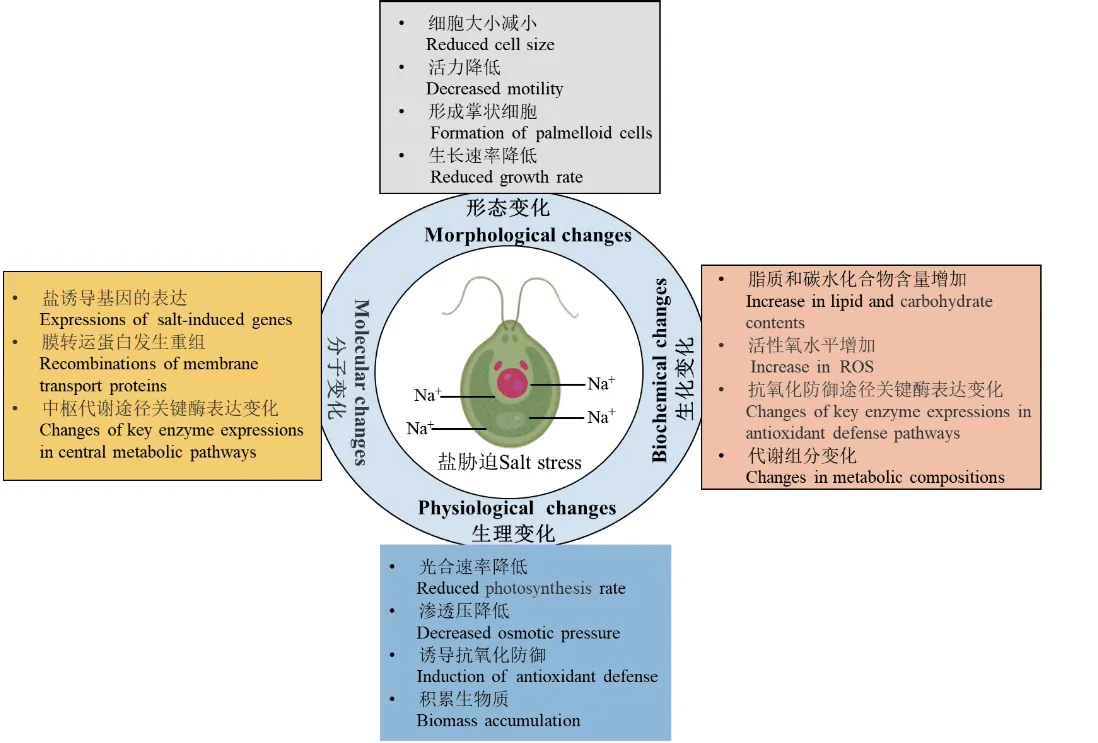
图2 莱茵衣藻(C.reinhardtii)在受到盐分胁迫时形态、生理、生化和分子水平上的变化Fig.2 Changes in morphology, physiology, biochemistry and molecular level of C.reinhardtii under salt stress
微藻广泛地分布于陆地、海洋、淡水湖泊等领域,但绝大多数微藻属淡水藻,淡水除了需要支持人类活动、粮食作物生产等之外,在微藻的大规模培养中也至关重要[13]。据估计,每产生1 kg 微藻生物量大约需要1 t 淡水。目前,地球上淡水资源占总水量的2.8%,而海洋约占地球总量的96.53%[14]。因此,利用海水养殖将减少大规模养殖微藻的淡水需求。如何让微藻适应海水中的高盐胁迫并大量繁殖也成为一个悬而未决的问题。为了对微藻的耐盐机制进行系统的研究,有必要采用多组学技术,包括转录组学、分泌组学、蛋白质组学和代谢组学等,以深入了解并建立一个完整的微藻耐盐、抗盐机制图谱[12,15-18]。附表1 简要总结了近10 年来研究者针对微藻在盐胁迫下的“组学”分析结果。近些年,研究者们在盐湖、盐碱地或者池塘已经分离纯化到一些新型耐盐藻,相关耐盐藻的基因组测序和挖掘其耐盐基因也在有条不紊地进行。本文阐述了目前已被研究发现的两种不同类型的微藻响应盐胁迫机制,同时着重总结了杜氏盐藻、盐生隐杆藻、皮克绿球藻等相关耐盐藻的应用实例。本文旨在为微藻以及高等植物的耐盐性能的提高提供重要的理论和分子依据,并提供可行性策略。最后,讨论了一些典型的盐响应基因在优良藻种选育中的价值与应用前景,并以莱茵衣藻(C.reinhardtii)为出发藻,对构建高耐盐性藻株所面临的挑战进行了讨论。
1 微藻响应盐胁迫的机制
盐胁迫是影响植物生长发育的主要环境胁迫之一,它会增加植物渗透压,导致细胞内钠积累至毒性水平。因此,植物通过多种机制来适应盐胁迫信号,例如调节离子稳态、激活渗透胁迫途径、介导植物激素信号转导、调节细胞骨架动态和细胞壁组成等[19]。多年来,研究者们已经发表了多篇关于各种微生物和高等植物在盐胁迫下生理反应和其具体分子调控机制的相关综述[19-21]。然而,关于微藻在盐胁迫响应的相关综述却罕有报道。鉴于此,本文系统阐述了真核微藻和原核蓝藻响应盐胁迫的具体机制与各种策略。
1.1 真核微藻响应盐胁迫的机制
1.1.1 跨膜转运蛋白的重组 通过细胞膜吸收和输出离子来维持细胞内离子平衡是微藻应对高盐胁迫的重要策略之一。高浓度Na+会干扰其他阳离子的吸收,尤其是K+。由于K+在植物中参与许多生理功能,所以在高盐条件下维持胞质K+/Na+比率是至关重要的[22]。
膜转运蛋白的上调可以促使微藻主动转运K+,从而赋予藻类对高盐度的耐受性。Foflonker 等[23]通过对皮克绿球藻(Picochlorum SENEW3)基因组测序发现,其中一些转运蛋白是Picochlorum SE3 具有广泛耐盐性所必不可少的。例如,与青绿藻(Ostreococcus tauri) 相 比,Picochlorum SE3 的contig_33.g34.t2 所编码的6 个基因拷贝与拟南芥(Arabidopsis thaliana)盐过度敏感基因AtNHX8 的同源性很高。AtNHX8 编码一种质膜Na+/H+逆向转运体,参与细胞内Na+的外排。此外,Picochlorum SE3 基因组中编码一个已被注释为Na+/K+‑ATP 酶亚基的基因,它参与到钠从细胞内的主动外排且此过程依赖ATP。在高pH 条件下,Na+/K+‑ATP 酶亚基相比于Na+/H+逆向转运蛋白有更好的Na+转运效果[24]。Na+/K+ATP 酶最初被认为是动物独有的,但近来在一些藻类中也发现了Na+/K+ATP 酶的同源基因,这些藻类包括杜氏盐藻(D.salina)[25],赤潮异湾藻(Heterosigma akashiwo)[26]和 条 斑 紫 菜(Porphyra yezoensis)[27]。此外,经研究发现杜氏盐藻(D.salina)能保持细胞内Na+浓度低于外部培养基的浓度[28],D.salina 的Na+/H+逆向转运蛋白能催化Na+的向内流入,然后通过Na+‑ATP 酶和质膜电子转运系统向细胞外输出Na+。因此,杜氏藻的这种Na+输出是一种进化的、适应高盐环境的机制。有趣的是,似乎与海洋或高耐盐藻类不同,淡水或盐敏感性微藻不能通过阻止Na+的摄取,而能通过积累K+或泵出Na+离子来维持细胞内离子浓度,从而将细胞恢复到其正常或接近正常的稳态。
1.1.2 渗透调节物质的积累 真核藻类大多具有刚性细胞壁,其改变细胞体积的能力有限,因此很大程度上依赖有机溶剂进行渗透调节[29]。这些有机溶剂,通常是指在高浓度下具有中性电荷和低毒性的有机小分子[30]。甘油是常见的有效相容性溶质之一,由大多数盐敏感性藻类物种在高盐胁迫下产生。它是一种终产物代谢物,因此生产和蓄积不会干扰其他代谢途径。同时,甘油是分子量最小的有机渗透溶质,因其渗透性太高使得其在原核生物中几乎无法存留,只能部分存在于真核生物中[31]。有研究表明,莱茵衣藻(C.reinhardtii)在受到200 mmol/L NaCl 胁迫时,会在早期(2-4 h)快速积累甘油以应对渗透胁迫[15]。同样的,在高盐胁迫下,杜氏盐藻(D.salina)也积累大量甘油,并且它细胞内积累的甘油含量能与外部盐浓度成比例[32]。因此,杜氏盐藻也常常被用作研究植物渗透调节模式的光合生物之一[33]。脯氨酸是另一种渗透主要调节物质,特别在高等植物和藻类中,随着盐度的增加,其浓度也呈线性增加。和甘油一样,它的分子量很低,带中性电荷,而且具有较高可溶性。盐胁迫下,微藻中脯氨酸的生物积累可能与△1‑吡咯啉‑5‑羧酸合成酶(P5CS)有关[12]。除脯氨酸外,其他氨基酸如赖氨酸和亮氨酸也参与促进真核绿藻如莱茵衣藻(C.reinhardtii)在高盐条件下的生长[34]。然而,关于这些氨基酸在渗透调节中的具体作用的研究并不多。而蓝藻在高盐条件下积累的渗透调节物质与真核微藻有一定的不同,下文会做具体阐述。
1.1.3 抗氧化防御通路的诱导 高盐会诱发微生物体内离子渗透和氧化应激[35]。微藻在盐胁迫下会产生各种活性氧(ROS),包括单线态氧(1O2)、超氧化物(O2-)、过氧化氢(H2O2)[36]。ROS 在细胞内信号级联中充当二级信使,激发各种非生物和生物胁迫的适应性反应。然而,高ROS 的积累同时也会破坏蛋白质、脂质和核酸等生物大分子,影响细胞代谢和正常生理功能[37]。
为了清除过量的有毒ROS,微藻尤其是真核绿藻,能自身进化形成多种ROS 防御途径。各种抗氧化酶如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和过氧化物酶(POD)等以及非酶分子起到重要作用。其中,SOD 是抵抗ROS 的第一道防线,将超氧自由基置换为分子氧和过氧化氢来保护细胞免受氧化应激[38]。同时,H2O2后续可以被CAT、POD 或APX 分解为H2O 和O2[39]。除了酶促抗氧化系统中的相关酶具有ROS的解毒作用,一些非酶分子如抗坏血酸、谷胱甘肽、类胡萝卜素等,也可以作为抗氧化系统中的组分来缓解微藻细胞内的氧化应激损伤[37]。此外,抗坏血酸-谷胱甘肽循环(AGC)被认为是连接抗氧化剂和抗氧化酶循环来分解H2O2的基本代谢途径[40]。单脱氢抗坏血酸还原酶(MDAR)是植物中催化氧化型抗坏血酸(AsA)转化为还原型AsA 的关键酶之一。MDAR 通过维持细胞内抗坏血酸的还原状态,在植物抗氧化胁迫反应中起重要作用[41]。值得一提的是,Lin 等[42]研究发现通过增强脱氢抗坏血酸还原酶(DHAR)活性能促进AsA 的再生,进而调节莱茵衣藻抗氧化胁迫的AGC 循环活性。近期,Choi等[43]发现在氧化胁迫条件下诱导的碱性亮氨酸拉链(bZIP)转录因子BLZ8 可以通过碳浓缩机制(CCM)来保护莱茵衣藻(C.reinhardtii)免受ROS的伤害。该研究结果为陆生植物如何通过CCM 途径应对环境胁迫提供了理论依据。
1.1.4 中枢代谢途径的适应 大多数真核微藻都属淡水绿藻,在高盐度环境中呈现出发育迟缓,超过一定的盐度阈值,一般无法生存。这些淡水藻株通常利用各种中枢代谢途径,包括糖酵解、肯尼迪途径和卡尔文循环来应对盐胁迫[29]。
蛋白质组学表明,莱茵衣藻(C.reinhardtii)和极地雪藻(C.nivalis)在应对0.2 mol/L NaCl 胁迫时,卡尔文循环中的核酮糖‑1, 5‑二磷酸羧化酶小亚基(RuBisCO)在莱茵衣藻(C.reinhardtii)中的表达丰度降低。同时,RuBisCO 激活酶在这两种微藻中的表达丰度也随着盐浓度增加而下降。RuBisCO 活性在C.reinhardtii 受到盐胁迫时的降低说明了其光合活性也在下降[18]。此外,在0.2 mol/L NaCl 环境中,C.nivalis 在3 d 后积累的碳水化合物总量达到细胞干重的10.4%,12 d 后积累的脂肪酸达到52.0%,这也表明了高盐可以成为C.nivalis 脂质积累的诱发剂。C.nivalis 也因其对环境变化的鲁棒性和生物加工的低温要求等优点而被认为是一种有潜力的生产生物燃料的藻类生物资源之一[44]。转录组学表明,C.reinhardtii 中参与碳水化合物(葡萄糖、淀粉和可溶性糖等)的相关基因表达呈现上调[15],例如参与葡萄糖代谢的UDP‑葡萄糖焦磷酸化酶UGP1/2、UDP葡萄糖基转移酶UGT‑80 在早期盐胁迫下的表达显著增强。
1.1.5 信号转导蛋白的感知 信号转导系统在微生物中很常见,可以帮助生物体感知和响应环境胁迫[45]。该系统中,钙离子(Ca2+)在许多生理过程中发挥重要作用,如植物的生长、发育、非生物和生物胁迫等[46]。其中,钙依赖蛋白激酶(CDPKs)被认为是信号转导中重要的钙(Ca2+)传感器。Li等[47]从C.reinhardtii 基因组中鉴定出15 个CrCD‑PK 基因,发现大多数CrCDPKs 在氮缺乏和盐胁迫下被显著诱导。此外,丝裂原激活蛋白激酶(MAPKs)通过磷酸化反应形成信号级联的一部分,在所有真核生物中都保守存在。MAPK 级联主要由3 种蛋白 组 成:MAPKKKs、MAPKKs 和MAPKs[48]。 有研究发现,杜氏盐藻(D.salina)中的MAPKK1(MEK1)有两种剪接方式,分别是DsMEK1‑X1、DsMEK1‑X2,其中DsMEK1‑X1 通过减少氧化损伤来响应盐胁迫,而DsMEK1‑X2 通过调节甘油合成来维持渗透压平衡进而抵御盐胁迫[49]。整体说来,真核微藻中关于盐胁迫下信号转导蛋白的研究较少,仍处于探索阶段。
1.2 原核蓝藻响应盐胁迫的机制
1.2.1 活性膜转运蛋白的调节 和真核微藻一样,通过表达相关转运蛋白来维持蓝藻细胞内离子平衡是微藻抗盐胁迫的重要策略之一,已在蓝藻中鉴定并表征了一系列与耐盐相关的转运蛋白。到目前为止,在耐盐蓝藻盐生隐杆藻(A.halophytica)中发现并证明了几种具有耐盐功能的转运蛋白,例如nhap基因编码的Na+/H+逆向转运蛋白[50]、假定F0F1 型Na+‑ATP 合酶操纵子(ApNa+‑ATP)[51]和类Mrp 簇Na+/H+逆向转运蛋白[52],这些转运蛋白能相应的提高转基因植物的耐盐性。此外,维持细胞内高钾水平是降低Na+对细胞毒性作用的另一种策略。有研究者发现集胞藻(Synechocystis sp.PCC 6803)中与盐相关的K+转运蛋白主要由Ktr 和Kdp 系统驱动[53]。正是基于这些转运蛋白的调节,一些蓝藻才能够在应对盐胁迫时维持良好的细胞活性。
1.2.2 相容性溶质的积累 与真核微藻在盐胁迫下积累甘油不同,蓝藻通常通过积累蔗糖、甘油葡萄糖苷和甘氨酸甜菜碱等相容性溶质来应对高盐胁迫[54],而细长聚球藻(S.elongatus UTEX 2973)则在盐胁迫下能够产生蔗糖(0.17 g/L)作为唯一的相容性溶质[55]。此外,甘氨酸甜菜碱能够在高盐度和干旱等胁迫条件下通过生物合成[56]。生物体内甜菜碱的生物合成途径主要以胆碱为底物进行的两步氧化反应。研究者也尝试着将胆碱两步氧化反应所涉及的关键酶胆碱脱氢酶(BetA)和甜菜碱乙醛脱氢酶(BetB)外源引入到相关淡水微藻中,然而效果并不明显[57-58]。幸运的是,有研究报道从盐生隐杆藻(A.halophytica)细胞中分离得到两个N‑甲基转移酶,这两个N‑甲基转移酶能够催化以甘氨酸为底物,通过三步甲基化最终合成甘氨酸甜菜碱[59]。近年来,也有研究者将盐生隐杆藻(A.halophytica)的甘氨酸甜菜碱合成途径引入到鱼腥藻(Anabaena sp.PCC 7120)和烟草(tobacco)中,都取得了不错的抗盐效果[60]。总之,相容性溶质在高浓度盐分下能使不同的酶有效运作,在平衡外界介质和细胞质之间的渗透压中起着重要的作用[29]。
1.2.3 脂质和烷烃的积累 一些蓝藻能在盐胁迫下积累脂质和烷烃。例如,在盐胁迫下聚球藻(Synechococcus sp.PCC 7942)脂质积累增加并且其脂肪酸组成发生变化;在10、50、100、250 和500 mmol/L NaCl 条 件 下,Synechococcus sp.PCC 7942 的饱和脂肪酸(SFA)相比于对照组,分别降低了82.79%、12.67%、5.77%、74.18% 和4.58%;而 不饱和脂肪酸分别增加了102.72%、16.05%、7.67%、49.14%和6.17%[61]。由于不饱和脂肪酸比饱和脂肪酸具有更低的熔点以维持细胞膜的流动性,因此不饱和脂肪酸的增加可能是蓝藻抵抗盐胁迫的一种适应性反应。在盐胁迫下,聚球藻(Synechococcus sp.PCC 6311)体内不饱和脂肪酸和磷脂酰甘油比例增加[62]。Ritter 和Yopp[63]又观察到,当耐盐蓝藻(A.halophytica)暴露于盐胁迫时,单/双半乳糖二酰基甘油的比例发生变化,这种盐胁迫下极性脂质的变化可能会减少钠的流入并减少盐胁迫下蓝藻光合作用的损害[64]。此外,Yamamori 等[65]构建了淡水蓝藻聚球藻(Synechococcus sp.PCC 7942)中烷烃合成基因的缺失突变体。该突变体不能产生烷烃,并在低盐度下表现出正常的生长表型。但是,突变体变得对盐敏感。然而,来自盐生隐杆藻(A.halophytica)的烷烃合成基因在Synechococcus sp.PCC 7942 中过量表达时,该缺失突变体恢复了生长缺陷并且其能在高盐胁迫下产生大量的烷烃。
1.2.4 胞内第二信使的调节 第二信使是由特定外部刺激调节而产生的细胞内物质,细胞能通过依靠第二信使对环境变化做出快速反应。已经在蓝藻中确定了一系列第二信使,它们在介导细胞对氧化应激、营养失衡和环境温度变化的反应途径中发挥作 用[66], 如cyclic‑di‑AMP(c‑di‑AMP) 和cyclic‑di‑GMP(c‑di‑GMP)[67-68]。有研究表明,在盐胁迫下,c‑di‑AMP 水平在集胞藻(Synechocystis sp)和聚球藻(Synechococcus sp.PCC 7942)中没有变化,而在Fremyella diplosiphon 中较低,在鱼腥藻(Anabae‑na sp)中较高。同时,在山梨糖醇诱导的渗透胁迫下,c‑di‑AMP 水 平 在Synechocystis sp.PCC 6803 和F.diplosiphon 中都有一定增长,在Anabaena sp.和Synechococcus sp.PCC 7942 中 却 不 受 影 响[69]。与c‑di‑AMP 相比,c‑di‑GMP 于近年来才渐渐出现在一些微生物的报道中:在蓝藻中,c‑di‑GMP 在趋光性和细胞聚集方面发挥作用[70];而关于第二信使在蓝藻中的研究仍处于初级阶段,需要进一步探索。
通过对这两类微藻盐响应机制的总结发现,真核藻和蓝藻都能通过调节转运蛋白活性和积累渗透调节物质来响应盐胁迫。其中值得注意的是,真核微藻通常积累甘油、脯氨酸等物质来应对高盐损伤,而蓝藻往往通过甘氨酸甜菜碱和蔗糖等渗透调节剂来维持细胞内离子平衡。在面对高盐胁迫时,都能触发这两种微藻的氧化应激,而一些真核微藻特别是淡水绿藻中的一些抗氧化酶能有效清除氧化应激过程中所产生的活性氧(ROS)。此外,一些真核微藻能够利用糖酵解、肯尼迪途径和卡尔文循环等中枢代谢途径来应对高盐胁迫, 而一些蓝藻如聚球藻等则通过积累脂质和烷烃等生物大分子来抵抗盐胁迫。一些信号蛋白在植物的生长发育、生物和非生物胁迫中起着至关重要的作用,真核微藻中的Ca2+传感器和信号级联蛋白激酶能在盐胁迫下被显著诱导,而对于蓝藻而言,胞内第二信使例如c‑di‑AMP和c‑di‑GMP 等水平会在盐胁迫下有显著变化。由此可见,不同微藻可以通过多种机制来适应高盐的极端环境,了解这些机制有助于微藻应答盐胁迫的系统化网络的建立。除了上述提到的多种机制外,还有其他与盐胁迫相关的基因或蛋白在这里未做具体阐述。因此,继续探索微藻适应盐胁迫的策略意义重大。未来应该继续挖掘耐盐基因/机制,进而更高效地提高微藻的耐盐性能。
2 天然耐盐藻的开发利用研究进展
高盐离子渗透和氧化胁迫会使微藻生长迟缓[29]。因此,研究者们通过各种手段来增加微藻的耐盐性。已有研究表明,适应性实验室进化(adaptive laboratory evolution,ALE)是一种提高微生物极端环境耐受性的有效方法之一[71]。在一项研究中,莱茵衣藻(C.reinhardtii CC‑503)通过在含有200 mmol/L NaCl 的液体TAP 培养基中连续传代驯化培养。经过1 255 代后,进化盐(evolved salt,ES)细胞在高盐培养基中的生长速度与起始细胞(progenitor cells)相当[72]。Kato 等[73]采用实验室适应性进化和诱变相结合的方法来试图提高衣藻(Chlamydomonas sp.JSC4)在高盐条件下的生物量。经过在5%和7%海盐下的长期连续培养,获得了在7%海盐下也生长良好的耐盐藻株(KNA‑001 和 KHI10‑50/40‑100)。虽然ALE 被证明是可行的,但是在实验室条件下对微藻进行长期高盐驯化不仅耗时长,而且还存在效率低和ALE 机制分析不清晰等问题。
植物转基因手段也是提高淡水藻株耐盐能力的另一条可行途径。来源于微藻的且经实验证明与耐盐相关的基因已总结于附表2 中。近期,科学家们也在不断开发天然耐盐藻,挖掘它们潜在的耐盐基因,为植物耐盐工程的发展奠定基础。例如杜氏盐藻(D.salina)就是一种极好的天然耐盐藻,它能够在0.05-5.5 mol/L 左右的饱和NaCl 浓度范围内生长良好[74],D.salina 又能通过调节细胞内甘油浓度维持细胞内外的渗透压[75]。Gong 等[76]为了鉴定杜氏盐藻中具有潜在耐盐作用的新基因,建立了D.salina cDNA 文库,并通过电穿孔将D.salina cDNA文库转化进雨生红球藻(Haematococcus pluvialis)感受态细胞中,将转化后的雨生红球藻在不同盐浓度的平板中进行培养,观察转化子的表型变化。其中Ds‑26‑16 过表达雨生红球藻藻株生长良好,且该基因被认为是潜在的盐胁迫响应候选基因。过表达Ds‑26‑16 的转基因烟草(tobacco)叶表面积、茎高、根长、总叶绿素和葡萄糖含量都显著增加。杜氏盐藻已被广泛应用于各个领域,如耐盐机理研究、废水处理、重组蛋白表达、生物燃料生产和天然材料制备等,在生物工程领域具有广阔的应用前景。除了杜氏盐藻外,从美国太阳湖分离出来的耐盐蓝藻盐生隐杆藻(A.halophytica)可以在0.25-3.0 mol/L NaCl 的盐度范围和外界高达pH 11.0 的极端碱性条件下生长[77]。在过去的近20 年间,科学家们也鉴定并克隆得到A.halophytica 的一些耐盐基因[50-51,59](附表2),例如表达ApNhap 编码的Na+/H+逆向转运蛋白能够使淡水蓝藻聚球藻细胞(Synechococcus sp.PCC 7942)在0.65 mol/L NaCl 盐激下持续生长10 h,并且可以在含有0.5 mol/L NaCl 的条件下正常存活和生长。遗憾的是,已被认可的相当一部分天然耐盐藻的遗传转化手段还未被建立,基因组测序也并未完成,有些微藻的耐盐机制的解析也并不明朗,这也为后续的遗传育种工作增加了难度。
3 总结与展望
作为最严重的非生物胁迫之一,高盐极大地削弱了全球农业生产力。从长远来看,高盐严重影响了植物的正常生理/生化机制。植物生理/生化调控、转录/翻译机制和表观遗传变化能够随着时间的推移显著影响物种的表型和分布[78]。在盐胁迫下,微藻的各种盐应答机制的正常运作对其在胁迫条件下的健康生长显得尤为重要。
几种负责 Na+/K+转运、激素信号转导、离子稳态、ROS 清除系统等基因/蛋白质已被报道用于提高微藻乃至高等植物的耐盐性。值得注意的是,从耐盐藻的开发总结中发现在淡水固氮蓝藻鱼腥藻(Anabaena sp.PCC 7120)通过三亲转化法表达来自盐生隐杆藻(A.halophytica)甘氨酸甜菜碱合成途径中的关键酶ApGSMT‑DMT,转化子细胞获得了一定耐盐性[54]。Anabaena sp.作为光合固氮藻株在热带稻田的碳氮循环中起着重要作用,然而,鱼腥藻对盐极度敏感。因此,通过基因改造提高鱼腥藻细胞的耐盐性具有重要意义。获得盐耐受性的工程鱼腥藻不仅能在不添加任何外来物质的情况下从头合成甜菜碱,且甜菜碱含量能随着盐浓度的增加而提高,这也为鱼腥藻在固氮减排和清洁生产提供了强大助力。微藻中一些典型的盐响应基因资源不仅在微藻育种中发挥着重要作用,也可以用于提高一些例如烟草(tobacco)、拟南芥(Arabidopsis thaliana)等高等植物的抗逆性。来自A.halophytica 的DnaK1基因在烟草中过量表达时,经0.6 mol/L NaCl 处理3 d 后,转基因烟草的固碳能力比对照细胞高约50%;在40℃的培养温度下,有82% 的转基因种子发芽,而只有27% 的对照种子发芽[79]。通过这些实例不难看出微藻的盐响应基因对植物在胁迫条件下的生长发育有着重要的应用价值。近年来随着气候变化如长时间的热浪、高强度的降雨和高二氧化碳浓度等对植物的生长都产生了一定的负面影响,一些渗透调节物质、热休克蛋白和抗氧化酶不仅在植物耐盐性中起作用,在其他的非生物胁迫中也发挥着重要作用。因此,微藻中盐响应基因资源的挖掘对改善植物抗逆性能、增强微藻生产力和维持生态平衡至关重要。同时,前文提到在一定盐胁迫下,微藻能将细胞资源转向脂质积累,如油脂、二十碳五烯酸、二十二碳六烯酸、虾青素等,说明一些抗盐性能良好的藻株又是丰富的脂质资源。
随着这些盐胁迫响应基因的陆续发掘,目前也已经选育出许多优秀的转基因藻株,然而迄今为止,只有少数几种耐盐微藻能够被生物利用,因为细胞表型通常是受多基因调控,单基因或单代谢通路的简单操作可能不会对植物实现精确有效的实时调控,也就无法通过单一操作来大幅度提升微藻的耐盐性。此外,上文总结发现许多天然耐盐藻的基因组测序和转化手段并不完整,某些在耐盐藻中被挖掘的耐盐基因的调控机制也并不明朗。试图进一步深入探讨这些耐盐微藻特殊抗逆基因的功能需要构建合适的分子生物学平台,莱茵衣藻便是一个不错的选择。莱茵衣藻作为基础科学和应用生理学和生物化学的模型已经被研究了超过40 年[80]。同时,莱茵衣藻具有细胞核基因组、叶绿体基因组和线粒体基因组3 套遗传系统,基因组测序也已完成。它的核基因组中编码C.reinhardtii 还含有一系列与胁迫相关的基因,因此可以被广泛用于研究胁迫诱导的反应机制。它能够在光能自养或异养条件下快速生长,适合经典的遗传分析。在莱茵衣藻细胞内可以通过过表达基因、RNA 干扰和CRISPR/Cas 基因编辑技术来揭示耐盐基因的功能[81-82]。莱茵衣藻在不同胁迫下的响应使其也能成为表征高等植物复杂胁迫转录组的理想系统。因此,C.reinhardtii 是可以作为研究光合生物中细胞盐胁迫反应分子机制的良好模式生物。
目前在微藻中仅鉴定并克隆得到了有限的一些耐盐基因。因此,为了推进微藻耐盐工程的发展,除了利用多组学方法(即基因组学、转录组学、蛋白质组学和代谢组学等)来探究盐胁迫条件下与微藻表型相关的胁迫应答基因、蛋白质、代谢物和代谢途径外;不同基因组编辑工具,如成簇的规则间隔短回文重复序列/CRISPR 相关蛋白(CRISPR/Cas)和CRISPR/Cpf1 等工具也需要同时被充分发挥作用,共同推进微藻以及高等植物的抗盐工程的发展。随着合成生物学和人工智能技术的不断发展,对关键抗逆元件进行靶向改造和理性设计将对微藻盐胁迫研究的可持续发展和应用具有极大的意义。
文章所有附图附表数据请到本刊官网下载(http://biotech.aiijournal.com/CN/1002‑5464/home.shtml)。

