玉米野生种基因组研究进展及应用
胡伊娃 陈露
(浙江大学农业与生物技术学院作物科学研究所,杭州 310058)
玉米(Zea mays ssp.mays)的野生近缘种,被统称为大刍草(teosinte)。大刍草主要包括5 个种,7 个亚分类群,具体可以分为小颖大刍草(Zea mays ssp.parviglumis, 下述parviglumis; Zea mays ssp.hue‑huetenangensis,下述huehuetenangensis),墨西哥大刍草(Zea mays ssp.mexicana,下述mexicana),多年生大刍草(Zea diploperennis,下述diploperennis),四倍体多年生大刍草(Zea perennis,下述perennis),繁茂大刍草(Zea luxurians,下述luxurians),尼加拉 瓜 大 刍 草(Zea nicaraguensis,下 述nicaraguen‑sis)[1-4]。这7 种大刍草和栽培玉米一起,构成了玉蜀黍属(Zea genus)。据报道,目前仅有多年生大刍草perennis 是四倍体,其他的大刍草和栽培玉米都是二倍体,拥有10 对染色体[5-6]。虽然仅分布在墨西哥和中美洲这一狭小的地域,但大刍草拥有对多种环境的适应能力,在炎热潮湿的低地、温暖干旱的山谷等地域都可以生存[7-8]。如nicaraguensis 和luxurains 可以适应频繁的降雨天气,并进化出了独特的抗涝性状如根系通气组织[9]。mexicana 可以生活在海拔2 500 米以上的高原地区,极端地耐寒冷和干旱。huehuetenangensis 高达5 米以上,生物量巨大。而多年生大刍草perennis 和diploperennis 则拥有玉蜀黍属其他物种不具备的抗性,如对独角金属植物(Striga ssp.)的抗性[10]。
自~9 000 年前,从来自墨西哥西南部巴尔萨斯河流域的parviglumis 中驯化之后,玉米一直被认为是驯化得最为完全的作物[11-13]。在快速的驯化过程中,玉米不仅在形态和生殖器官上与大刍草发生了巨大的分化,在分子水平上也发生了明显的变化[14-16]。由于驯化瓶颈的作用,现代玉米已经丢失了大量的遗传多样性,包括大量对生物和非生物胁迫的抗性基因,缺乏应对气候变化的有利突变[8,17-18]。对大刍草的深入认知,挖掘大刍草中的有益位点,是未来气候变化下保证玉米稳定生产的关键途径之一。本文主要综述了大刍草的基因组进化、数量遗传学、群体遗传学等方面的研究进展,同时对大刍草在未来玉米遗传育种中的应用进行了展望。
1 玉蜀黍属的演化历史
1.1 栽培玉米的起源
作为重要的经济作物和遗传学研究的模式物种之一,栽培玉米的起源一直是人们所关注的内容[19-20]。由于独特的形态特征,林奈最早在1753年将栽培玉米单独分成一个属。随着对大刍草的形态学、细胞学观察,以及与不同物种的杂交实验等,科学家们在上个世纪的百年间对玉米起源于哪个地方、在何时、由哪种物种进化等问题提出了诸多的猜想。最具代表性的观点是以Mangelsdorf 为代表的杂交起源和以Beadle 为代表的单组起源[11,21-28]。具体包括:大刍草来自玉米和摩擦禾的自然杂交事件;新类型的玉米直接或间接来自于玉米和大刍草的杂交后代;栽培玉米起源于一种野生的爆裂玉米;玉米来自对野生大刍草mexicana 的逐渐选择;玉米来源于大刍草的瞬间革命性的变化。
随后,基于考古学、染色质结的组成、5S/45S rDNA 等比较结果,科学家们确认了玉米起源于一年 生 大 刍 草parviglumis 或mexicana[29-31]。在 这 个时期,由于玉米和不同大刍草之间可以自由的杂交,且杂交后代在很多种情况下都是可育的,在玉米起源的具体大刍草类型上仍然存在一定的争论[25,28,32-34]。此外,墨西哥本地玉米主要与mexicana 生活在相同的地域,在很长的一段时间里,科学家们更倾向mexicana 是玉米的直系祖先,许多的比较分析实验也是以mexicana 作为对照。直到2002 年,Matsuoka 等[12]利用99 个微卫星标记,对193 份广泛分布的玉米、33 份mexicana、34 份parviglumis 和4 份huehuetenangensis(作为外群)的系统发育关系进行了详细分析,证实了现代玉米单一起源于parviglumis。随着玉米考古学的进展、分子标记的增多,研究者发现玉米在没有被完全驯化之前,半驯化的本地种就已经引入了北美洲各地,再经亚马逊西南部的二次改良之后,逐渐扩散到南美洲[35]。在这个扩散的过程中,栽培玉米与mexicana 发生着持续的基因渗透[36-39],二者可能在距今6 000 年前发生了一次杂交事件,进一步丰富了玉米的遗传多样性,促进了玉米向其他地域的传播[40],最终使得玉米遍布全球。
1.2 大刍草的系统发育关系
大刍草的正式分类始于1980 年,Iltis 和Doebely 根据大刍草的地理分布、形态特征、细胞学观察等,将大刍草划分成了两组:繁茂组(Sect.Luxuriantes)和玉蜀黍组(Sect.Zea)。繁茂组中包括luxurians、perennis 和diploperennis,玉蜀黍组中包 括huehuetenangensis、mexicana、parviglumis 和 栽培玉米[1]。随着分子生物学的发展及其他大刍草(如nicaraguensis)的发现,研究者又利用同工酶、叶绿体DNA、微卫星标记、少量的SNPs 等,对大刍草的系统发育关系进行了详细的推测[8,41-43]。例如,在基于93 个微卫星标记,237 份大刍草的研究中,Doebley 等[4]发现nicaraguensis 与luxurians 的距离最近,且luxurians 与多年生大刍草(diploperennis、perennis)是作为姐妹种存在的。而在利用1 000 个SNPs 标记,对大刍草的系统发育关系进行分析时,则将多年生大刍草(perennis、diploperennis)与抗涝大刍草(nicaraguensis、luxurians)放置在了不同分枝上,并认为抗涝大刍草最先与摩擦禾分化[2]。随着测序技术的进展,通过对237 份大刍草(包括所有的已知亚群)的全基因组深度重测序(~20x),研究者确定了抗涝大刍草luxurians 最早分化出来,随后才是多年生大刍草的分化。此外,对不同大刍草分化时间的推断显示,luxurians 和perennis 的分化时间非常近,这也解释了为什么基于低密度标记进行大刍草系统发育的推断时,不同的研究结果存在一定的差异[44]。
2 大刍草与玉米的差异
2.1 大刍草与玉米的性状差异
成熟大刍草和玉米之间的形态差异巨大,在侧枝数、分蘖数、每株穗数、每穗粒数和籽粒大小等性状方面都显示出强烈的人工选择效应[45-47]。在地上部分,大刍草具有多个分枝且叶片较窄,而玉米则只有一个主枝。在雌性花序上,玉米拥有都会发育成功的成对小穗,而大刍草中的第二个小穗则不会发育。此外,大刍草的雌穗只有两行,玉米则拥有多行排列的雌穗。在籽粒上,玉米的籽粒附着在粗壮的轴上,但是大刍草的籽粒则附着在脆弱的小梗上。而且,大刍草的每一个籽粒都由坚硬的外层颖片所包裹,但是玉米的籽粒则裸露在苞叶之下[45]。这些性状的变化也使得大刍草从野生的自我繁殖状态变成了需要人类维护的作物。除了对籽粒大小的改良,驯化也对籽粒的组成成分进行了选择。虽然大刍草的籽粒较小,但是其蛋白、油分含量都比玉米更高[17]。除了上述地上性状之外,在对玉米和大刍草地下根系性状(在水分、营养元素的吸收上起着重要作用)进行观察时发现,大刍草侧根的分枝、种子根更少,中柱和维管束的面积更小[48-49],根系微生物成分也与玉米不同[50]。
作物的驯化过程不但改变了植物自身,也改变了作物与昆虫、病原菌等之间的互作关系。例如,对大刍草(parviglumis, mexicana)、墨西哥玉米、美洲玉米材料上的1 088 份Ustilago maydis(玉米黑穗病菌,一种玉米的专性真菌病原体)菌株个体进行群体结构分析时发现,大刍草与玉米拥有不同的U.maydis 类群[51]。对大刍草和玉米籽粒中的内生菌(生活在植物体内的非病原微生物)进行分离也发现,两者籽粒中内生菌的类型也不同[52]。此外,驯化过程也改变了玉米受到节肢食草动物攻击时候的响应。研究显示,欧洲玉米在受到Diabrotica virgifera 害虫(入侵欧洲的玉米害虫)幼虫捕食的时候,其地下部分会释放一种植物信号E-β 石竹烯,该信号会吸引一种昆虫病原线虫,以此来抵御D.virgifera 的攻击。这种信号在大刍草和欧洲玉米中都会释放,但在美洲玉米中则不会被释放[53]。
2.2 大刍草与玉米的基因组差异
理解物种间的差异对于作物改良具有重要意义。在植物中,存在多种导致遗传多样性的变异机制。如点突变、结构变异、拷贝数变异、插入和缺失变异等[54]。此外,DNA 甲基化也会独立于基因组突变,影响植物的性状[55-56]。了解玉米与大刍草在基因组、转录组、表观组等多个方面的差异,对于形态学性状、抗性、适应性等位点的挖掘具有重要作用。转座子是导致结构变异的重要因子,其可以插入到基因组的各个地方,影响基因表达和性状的改变[57-58]。在玉米基因组上,85%以上的序列都是转座子[59-60],这些转座子不但影响着玉米和大刍草的基因组大小[61-62],也贡献于玉米的性状变化[63-64]。早在20 世纪90 年代,研究者们就探索特定基因附近功能性转座子在玉米和大刍草中的差异发现,LINE 转 座 子[65]、Bg 转 座 子[66]、Hbr‑hm1 转 座 子在玉米和大刍草上的拷贝数差不多,但是Mu 转座子、LTR 转座子在大刍草和玉米上的差别则十分大[67-68]。近期基于重测序的研究结果也发现,大刍草和现代玉米在不同转座子的构成上具有显著差异。例如,Zea mays 中的T3 反转录转座子含量较其他玉蜀黍属物种显著降低,多年生大刍草diploperennis 和perennis 中则DNA 转座子升高[44]。除了转座子序列本身的差异之外,玉米和大刍草转座子的甲基化模式也存在明显的差异[69]。
除了转座子之外,其他类型的变异也在大刍草的环境适应性中起着重要作用。在结构变异上,对大刍草(mexicana)和玉米F1杂交后代的重组比例进行分析时发现,有些染色体上的重组比例非常低[32],如9 号染色体的末端,Beadle 猜测这个区域可能是倒位[26]。后续的细胞学观察[70-72]、群体标记的分析研究也表明,mexicana 和现代玉米相比确实在9 号染色体上存在超过20 Mb 的倒位。且这个倒位在mexicana 的开花、高原土壤等的适应上都起着重要作用[44,72-74]。在基因上,虽然大刍草和玉米95%左右的基因都是保守存在的[75],但是驯化过程影响了基因之间表达及互作关系[14]、改变了其长链非编码RNA[76]和miRNA 的演化模式[77],减少了玉米基因组中的调控元件[78]、使得玉米在面对环境胁迫时的可塑性更低[79]。
3 大刍草在玉米遗传学上的应用
3.1 玉米表型变异数量性状位点的鉴定
玉米从其野生祖先的驯化是进行作物驯化、基因组进化、对选择响应研究的模式系统。Beadle 和Doebley 等也基于杂交实验发现,玉米在驯化过程中主要有5(6)个基因作用[80-82]。具体包括1 号染色体长臂上与植株形态相关的数量性状控制位点(quantitative trait loci, QTL; tb1),2 号染色体短臂上与雌穗的行数相关的QTL(zfl2),4 号染色体上与颖壳相关的QTL(tga1),1 号染色体短臂、3 号长臂、5 号长臂上与多种性状相关的QTLs[46]。为了探索玉米驯化及表型变异的遗传调控机制,Doebley 和Stec 在1991 年将玉米农家种与mexicana 进行杂交,通过调查F2群体的12 种形态学相关性状(如落粒性、分枝数、颖壳硬度等),获得了64 个控制这些性状的数量性状位点[83]。随后的30 年间,研究者也通过杂交不同的玉米自交系与大刍草(主要是parviglumis),构建F2群体或回交(back cross, BC)群体,对植株形态、雌穗形态、雄穗形态、籽粒组成成分、籽粒形态、开花期、根系数目与解剖结构、抗涝、多年生、病害等相关性状等进行了QTL 定位(表1),获得了超过1 600 个QTL 位点,为玉米性状变异分子基础的解析打下了良好的基础。
除了使用传统的QTL 定位方法,即自上而下方法(top‑down approach),从表型出发,通过构建分离群体鉴定调控表型变异的关键基因之外。近年来也有很多研究,采用了自下而上的策略(bottom‑up approach),利用大刍草野生群体的多样性,通过群体基因组扫描鉴定具有选择信号的区域,并结合转基因与功能注释的方法,挖掘大刍草中与驯化、适应性等表型相关的关键位点[36-38,44,111-113]。
3.2 玉米表型变异关键基因鉴定
为了利用玉米-大刍草群体挖掘调控玉米表型变异的关键基因,研究者还对具体性状所在的QTL进行了进一步的精细定位(表2)。基于这种策略,Doebley 等[114]在1995 年成功定位到了可以抑制侧枝生长的tb1(teosinte branched1)基因,并在之后发现tb1 的功能位点是位于该基因上游58.7-69.5 kb范围内的 Hopscotch 转座子[63]。由于Hopscotch 的插入,玉米得以从大刍草的多分枝变成只有一个主枝。针对玉米和大刍草的形态学差异,后续Doebley团队又克隆到了控制籽粒裸露的tga1(teosinte glume architecture)[115],控制繁殖率的gt1(grassy tillers1)[116]以及控制开花的zgal1(Zea Agamous‑like)[117]、ZmCCT10[118]。同时,田丰团队克隆到了控制营养生长转换的gl15(glossy15)[119]以及控制叶夹角的UPA1(Upright Plant Architecture1)和UPA2[120],杨小红团队克隆到了控制穗行数的KRN2(kernel row number2)[121]。针对开花期相关性状,田丰团队也克隆了控制开花期的ZCN8(Zea mays CENTRORADIALIS8)[122]、ZmMADS69(MADS‑box transcription factor69)[123]和ZmCCT9[64]。另外,越来越多的研究也发现了可用于现代玉米遗传改良的、大刍草中的优异等位基因,如控制籽粒中蛋白质含量的TPH9[124]、醇溶蛋白的pbf1(prolamin‑box binding factor1)[125]、控制类胡萝卜素的DXS2[126],控制K+稳态的ZmHKT2[127],具有广谱抗病性的ZmMM1[128]。
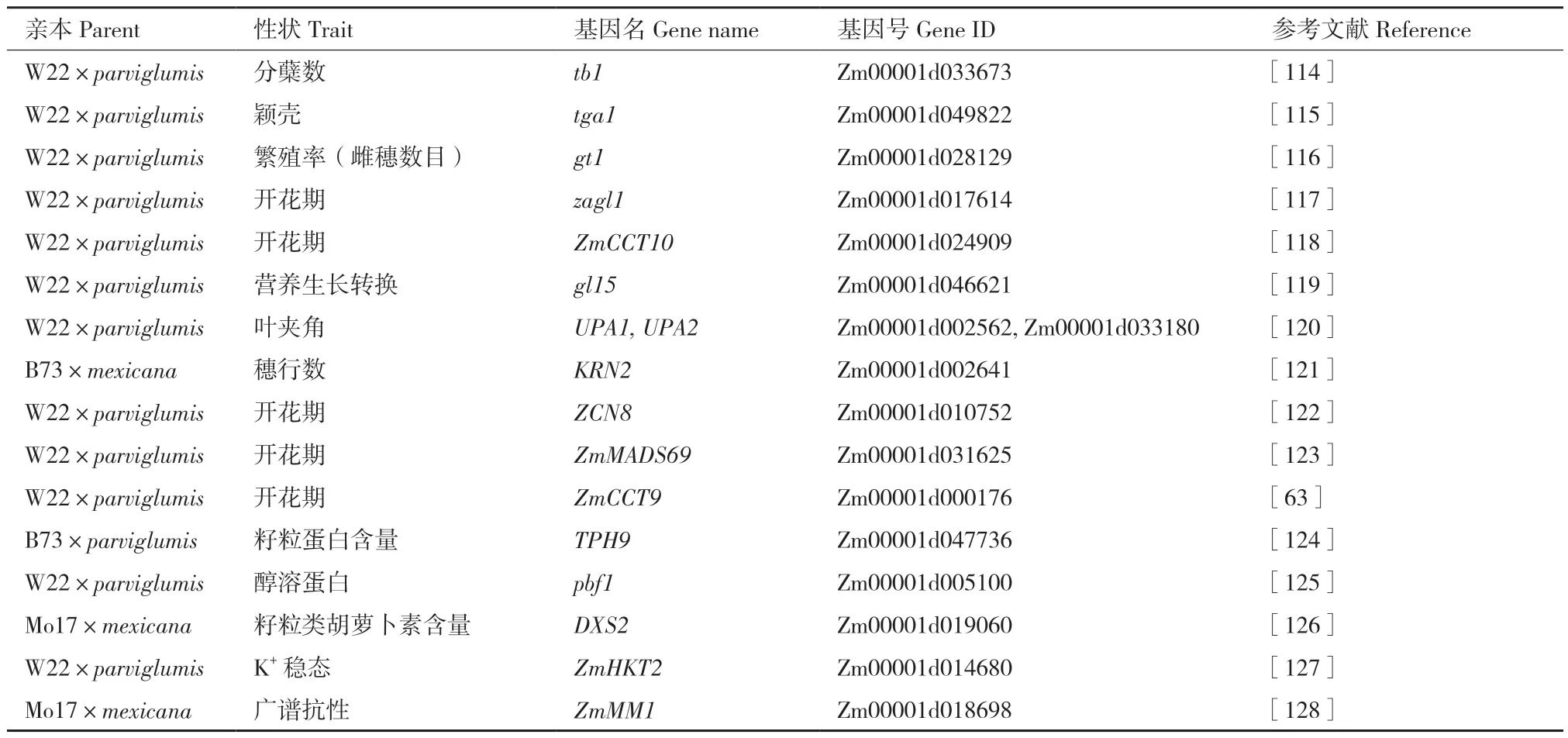
表2 玉米-大刍草群体精细定位到的关键基因Table 2 Fine-mapped key genes in maize-teosinte population
4 展望
栽培玉米狭窄的遗传基础是制约高产、抗性玉米新品种选育的重要因素[129]。大刍草可以作为重要的遗传资源,使得育种家能通过引入近缘物种的等位基因来改良现代玉米[130]。然而,当前对大刍草遗传多样性的挖掘,主要集中在玉米直系祖先parviglumis 及其姐妹种mexicana 上的几个有限单株上,对大刍草全部遗传多样性的利用还非常滞后。随着一些大刍草亲本定位群体的开发,这个问题可能会有一定的改善[88]。此外,目前对其他大刍草特性的认知仍然非常少,极大地忽略了其他大刍草在玉米遗传学、农业生产实践上的潜在应用价值。例如,diploperennis 具有超强的体细胞再生能力[131],luxurians 可以作为良好的青贮饲料[132]。更重要的是,进一步的野外考察又报道了一些新的、形态和分布上与上述7 个大刍草具有显著差异的物种。例如2011 年于墨西哥的Nayarit、Michoacan、Oaxaca发现的3 种大刍草[133],2013 年于哥斯达黎加的Murcielago 群岛上发现的Zea vespertilio[134]。值得注意的是,这些物种的群体非常小,并且栖息地还受到人类活动的威胁。未来作物的遗传资源的保护应该不局限于作物本身,还应加强对已有野生资源的保护及未知野生种质资源的考察与鉴定。随着高通量组学测序技术的发展,在多个水平解析植物基因组的特征也变得越来越容易。伴随着越来越多大刍草基因组的发表[124,135],基因功能验证方法飞速发展[136],大刍草转基因平台的建立[137],大刍草中有利位点的快速发掘将更为简单。野生种质资源的解析,驯化前优异等位基因的发掘与利用,将加速适应性玉米新品种的培育进程。

