不同烟熏时间鸡腿肉香气化合物与危害物及相关前体物研究
高荣美 张德权 时浩楠 王振宇 张春江
(中国农业科学院农产品加工研究所/农业农村部农产品质量安全收贮运管控重点实验室,北京 100193)
熏鸡的烟熏味是其感官特征的关键因素,可影响消费者接受度和购买意向。熏材加热分解产生的香气化合物使肉制品具有独特的烟熏风味[1]。但在传统烟熏过程中,脂类、蛋白质和碳水化合物间的复杂化学反应不仅可产生香气化合物,还会产生危害物,如多环芳烃(polycyclic aromatic hydrocarbons,PAHs)、杂环胺(heterocyclic amines,HAs)和晚期糖基化终末产物(advanced glycation end products,AGEs)等。以上化合物均是诱发癌症的重要成分,会影响消费者健康[2-4]。现有研究集中在熏鸡风味生成与保持、危害物调控等方面,但关于熏鸡风味成分与危害物伴生关系的研究鲜有报道。
烟熏肉制品香气化合物组成以酚类为主,呋喃、吡嗪类等物质为辅[5]。熏鸡加工方式各异,Yang等[6]发现聊城熏鸡含酚类物质较多,沟帮子熏鸡与金山熏鸡含呋喃类物质较多,这表明熏制方式影响特征香气化合物的形成。但与其他加工方式相比,烟熏可导致PAHs的生成。Li等[7]发现,因表皮暴露在烟熏环境中会吸附更多危害物,熏鸡皮中PAH4显著高于肉中(P<0.05)。另外,脂肪的中间底物游离脂肪酸对香气化合物有积极贡献,但脂肪含量与PAHs的产生呈正相关,且熏制过程中游离氨基酸与还原糖反应形成Amadori化合物,该类物质进一步热解形成PAHs[8]。Zhang等[9]研究发现,香气化合物种类与HAs相关,烟雾中的酸沉积于肉中影响肉的pH值,而pH值可影响2-氨基-3,4-二甲基咪唑[4,5-f]-喹啉(2-amino-3,4-dimethylimidazo[4,5-f]quinoline,MeIQ)和2-氨基-3-甲基咪唑[4,5-f]-喹啉(2-amino-3-methylimidazo[4,5-f]quinoline,IQ)的形成。许多研究表明,肌肉中的游离氨基酸、还原糖也是HAs、AGEs的主要前体[10-11]。虽然已有研究揭示了不同烟熏次数对熏制鸡腿香气化合物和HAs含量的影响[12],但在一定温度下,熏制时间对熏鸡香气化合物和HAs、AGEs、PAHs形成及其前体物特征的影响尚不清楚。
因此,本试验以聊城熏鸡为研究对象,选取熏制时间点0(未熏制)、2、4、6、8、10和12 h的鸡腿肉为试验材料,采用顶空固相微萃取-气相色谱-嗅闻-质谱联用仪(headspace solid-phase microextraction-gas chromatography-olfactometry-mass spectrometry,HSSPME-GC-O-MS)、超高液相色谱-串联质谱联用(ultra-pressure liquid chromatography-mass spectrometry/mass spectrometry,UPLC-MS/MS)、液相色谱(highperformance liquid chromatography,HPLC)和离子色谱等技术探究熏制时间对熏鸡腿关键香气化合物、HAs、AGEs、PAH4及相关前体物的影响,旨在优化熏鸡熏制时间参数,明确香气化合物与危害物的伴生关系。
1 材料与方法
1.1 材料与试剂
聊城熏鸡,购于山东省聊城市龙胜斋魏老六魏氏熏鸡有限公司。另外,选择月龄2—3个月、大小基本一致的聊城肉鸡,经前处理及卤煮后,采用温熏法于60 ℃左右熏制,熏材为松柏。取熏制时间0、2、4、6、8、10和12 h(共7个时间点)的熏鸡各6只,经密封真空包装、冷链运输至实验室,取鸡腿肉进行搅碎,置于-80 ℃保存。
HAs标准品IQ、MeIQ、2-氨基-1-甲基-6-苯基-咪唑[4,5-b]吡啶(2-amino-1-methyl-6-phenyli-midazo[4,5-b]pyridine,PhIp)、2-氨基-3,8-二甲基咪唑[4,5-f]-喹喔啉(2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline,MeIQx)、2-氨基-3,7,8-三甲基咪唑[4,5-f]-喹喔啉(2-amino-3,7,8-trimethylimidazo[4,5-f]quinoxaline,7,8-DiMeIQx)、2-氨基-3,4,8-三甲基咪唑[4,5-f]-喹喔啉(2-amino-3,4,8-trimethylimidazo[4,5-f]quinoxaline,4,8-DiMeIQx)、2-氨基-3,4,7,8-四甲基-3H-咪唑[4,5-f]喹喔啉(2-amino-3,4,7,8-tetramethyl-3H-imidazo[4,5-f]quinoxaline,4,7,8-TriMeIQx)、2-氨基-9H-吡啶并[2,3-b]吲哚(2-amino-9H-pyrido[2,3-b]indole,AαC)、2-氨基-3-甲基-9H-吡啶并[2,3-b]吲哚(2-amino-3-methyl-9H-pyrido[2,3-b]indole,MeAαC)、2-氨基-6-甲基二吡啶并[1,2-a:3’,2’-d]咪唑(2-amino-6-methyldipyrido[1,2-a:3’,2’-d]imidazole,Glu-P-1)、2-氨基-二吡啶并[1,2-a:3’,2’-d]咪唑(2-amino-dipyrido[1,2-a:3’,2’-d]imidazole,Glu-P-2)、3-氨基-1,4-二甲基-5H吡啶并[4,3-b]吲哚(3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indole,Trp-P-1)、3-氨基-1-甲基-5H-吡啶[4,3-b]吲哚(3-amino-1-methyl-5H-pyrido[4,3-b]indole,Trp-P-2)、1-甲基-9H-吡啶并[3,4-b]吲哚(1-methyl-9H-pyrido[3,4-b]indole,Harman)和9H-吡啶并[3,4-b]吲哚(9H-pyrido[3,4-b]indole,Norharman),加拿大TRC公司,纯度>99%;AGEs标准品羧甲基赖氨酸(Nε-carboxymethyl lysine,CML)、羧乙基赖氨酸(Nε-carboxyethyl lysine,CEL)、甲基乙二醛氢咪唑酮(methylglyoxal-derived hydroimidazolinone,MG-H1)和PAH4标品苯并[a]蒽(benzo[a]anthracene,B[a]A)、苯并[b]荧蒽(benzo[b]fluoranthene,B[b]F)、苯并[a]芘(benzo[a]pyrene,B[a]P)和䓛(chrysene,Chr),北京瀚诚生物科技有限公司,纯度>99%;甲醇、乙腈、正己烷、乙酸铵(色谱级),美国赛默飞世尔公司;BondElutC18固相萃取柱(167 mg·mL-1)、Bond Elut苯基磺酸固相萃取柱(167 mg·mL-1)、Bond Elut-SI、Bond Elut-ENV固相萃取柱、Bond Elut QuECHERS萃取包、Bond Elut QuECHERS dSPE试剂盒,安捷伦科技(中国北京)有限公司。
1.2 仪器与设备
75 μm CAR/PDMS萃取针与SPME进样器,美国Supelco公司;6470LC/TQ液相色谱-质谱/质谱仪、7890B/5977A气相色谱-质谱联用仪、高效液相色谱、ICS-3000离子色谱仪,美国Agilent公司;LGJ-25C冷冻干燥机,北京四环科学仪器厂有限公司;CR22GII高速冷冻离心机,日本日立公司;TTL-DCII氮吹仪,北京同泰科技有限公司。
1.3 试验方法
1.3.1 挥发性香气化合物HS-SPME-GC-O-MS分析 参考Liu等[13]的方法并稍作修改。称取3.0 g绞碎肉样于20 mL顶空进样瓶中,加入1.0 μL(1.70 mg·mL-1)2-甲基-3-庚酮内标。样品预热10 min后通过75 μm CAR/PDMS萃取针吸附45 min,解析3 min。样品预热温度55 ℃,萃取温度55 ℃,解吸温度250 ℃。根据内标物对香气化合物半定量分析,采用质谱库检索(mass spectral library search,MS)和嗅闻(olfactory,O)对香气化合物半定性分析。MS:样品经气相色谱分离后进入质谱检测器,通过NIST2.0数据库对香气化合物检索定性。O:物质的质谱峰与气味同时出现在质谱仪上,记录每个样品的保留时间、气味描述和每种物质的味道强度(弱、中、强)。另外,OAVs为某挥发性化合物的含量与其在水中的气味阈值之比。水中物质的气味阈值通过参考资料获得[5,14-15]。OAVs>1的香气化合物为强效气味物质,对食品风味有重要贡献,也称为关键香气化合物[16]。
使用GC-MS测定香气化合物含量,毛细管柱为DB-Wax(60 m×320 μm×0.25 μm),前进样口温度250 ℃,载气(He)流速1.0 mL·min-1,不分流模式进样,升温程序:初始柱温40 ℃,保持3 min,以2 ℃·min-1升至70 ℃,以3 ℃·min-1升至130 ℃,再以10 ℃·min-1升至230 ℃,保持10 min。
1.3.2 HAs含量测定 HAs含量测定参考Ding等[17]的方法并稍作修改。采用QuECHERS(Quick、Easy、Cheap、Effective、Rugged、Safe)法提取肉中HAs。称取2 g肉样于50 mL离心管中、加入1块陶瓷均质石和10 mL去离子水,振荡20 min。加入10 mL含有1%醋酸的乙腈溶液,振荡15 min,再加入4 g无水硫酸镁和1 g无水醋酸钠的萃取包并振荡1 min,4 ℃、4 500 r·min-1离心10 min;取6 mL上清液加入含有900 mg的无水硫酸镁、300 mg的丙基乙二胺和300 mg封端的离心管中,离心5 min。取1 mL上清液氮吹至近干,再用200 μL甲醇溶解后0.22 μm尼龙滤膜过滤。用UPLC-MS/MS测定HAs含量,使用Zorbax SB-C18(2.1 mm×50 mm,1.8 μm)色谱柱。柱温25 ℃;流动相A为10 mmol·L-1醋酸铵溶液(pH值2.9),B为100%乙腈;洗脱梯度:0~8 min为85% A,15% B;8~13 min为45% A,55% B;13~30 min为91% A,9% B。
1.3.3 AGEs含量测定 AGEs含量测定参考Sun等[18]的方法并稍作修改。称取200 mg冻干肉样于10 mL离心管中、加入2 mL 0.2 mol·L-1硼酸盐缓冲液(pH值9.2)和400 μL 2 mol·L-1硼氢化钠溶液,4 ℃反应8 h,加入4 mL 6 mol·L-1HCl溶液后于105 ℃酸解24 h。取1 mL于60~80 ℃烘箱中浓缩至近干,加入2 mL超纯水复溶,取1 mL复溶液过0.22 μm尼龙滤膜。MCX固相萃取柱分别用3 mL甲醇、2%甲酸水溶液活化和平衡,加入样品后再分别用其除杂,用2 mL 5%氨水甲醇溶液洗脱并收集洗脱液,氮吹至近干后用1 mL乙腈复溶,过0.22 μm尼龙滤膜。用UPLC-MS/MS测定AGEs含量,使用BEH Amide(100 mm×2.1 mm,1.7 μm)色谱柱。柱温35 ℃,流动相A为5 mmol·L-1的乙酸铵和0.1%甲酸的水溶液,B为乙腈;流速0.3 mL·min-1;进样体积3 μL。
1.3.4 PAH4含量测定 PAH4含量测定参考屈岩峰等[19]的方法并稍作修改。称取4 g熏肉样于50 mL离心管A中,加入10 mL正己烷后匀浆,涡旋3 min,超声15 min,4 500 r·min-1、4 ℃离心5 min。取上清液倒入离心管B中,加入10 mL正己烷于A管中重复一次,将提取液合并于B管中。串联固相萃取小柱Bond Elut ENV和Bond Elut SI,用10 mL正己烷活化萃取柱后加入样品,再用2 mL正己烷清洗B管中残留液,最后用5 mL洗脱液(正己烷与二氯甲烷1∶1混合)洗脱并收集洗脱液,用1 mL乙腈复溶氮吹后过0.22 μm尼龙滤膜。用HPLC测定PAH4含量,使用PAH C18反相键合固定相色谱柱。柱温25 ℃,流动相A为超纯水,B为乙腈。洗脱梯度:0~7 min为20% A,80% B;7~16 min为15% A,85% B;16~24 min为0% A,100% B;24~30 min为20% A,80% B。
1.3.5 水分、脂肪含量测定 水分和脂肪含量测定分别参考GB 5009.3-2016《食品安全国家标准 食品中水分的测定》[20](直接干燥法)和GB 5009.6-2016《食品安全国家标准 食品中脂肪的测定》[21](索氏抽提法)。
1.3.6 肌酐/肌酸含量测定 肌酸和肌酐含量测定参考文娜等[22]的方法并稍作修改。将2 g样品与10 mL预冷的0.4 mol·L-1高氯酸混合后匀浆,于4 ℃、12 000 r·min-1离心15 min,收集上清。按体积1∶1加入0.67 mol·L-1磷酸氢二钠溶液中和(pH值6.5)。取1 mL上清液过0.22 μm尼龙膜,用HPLC测定肌酸和肌酐含量。使用ZOBAX NH2色谱柱(250 mm×4.6 mm,5 μm),流动相为0.05 mol·L-1NaH2PO4(pH值5.0),进样量10 μL。柱温25 ℃,检测波长210 nm,流速1.0 mL·min-1。
1.3.7 还原糖含量测定 还原糖含量测定参考刘欢[14]的方法并稍作修改。称取4 g样品于50 mL离心管中,加入10 mL超纯水后匀浆,超声30 min,于4 ℃、10 000 r·min-1条件下离心15 min,取上清液加超纯水定容至10 mL,取1 mL样液加入1 mL水杨酸,混匀,4 ℃、10 000 r·min-1离心15 min,取1 mL混合液氮吹至近干,超纯水定容至10 mL后过0.22 μm尼龙滤膜,用离子色谱仪测定还原糖含量。
1.3.8 游离氨基酸含量测定 游离氨基酸提取参考刘登勇等[23]的方法并稍作修改。称取4 g样品于50 mL离心管中,加入20 mL 0.2%甲酸水溶液,超声1 h,每10~15 min涡旋一次。混合液于4 ℃、10 000 r·min-1离心15 min。取上清液,加入2 mL正己烷,混合振荡后去除有机层,取1 mL混合液过0.22 μm尼龙滤膜,使用UPLC-MS/MS测定。氨基酸含量以湿基计。
1.3.9 游离脂肪酸含量测定 游离脂肪酸提取根据刘欢等[14]的方法。称取3 g肉样,加入30 mL氯仿-甲醇混合溶液(2∶1)后匀浆,静置1 h、过滤,加入6 mL饱和NaCl后静置分层,取下层清液,加4 g无水硫酸钠除水分,过滤,于45 ℃水浴下用真空旋转蒸发器浓缩得到脂质样品。用3 mL二氯甲烷活化氨丙基硅胶小柱,将经4 mL 0.02%二丁基羟基甲苯/正己烷处理的脂肪溶液注入小柱,用5 mL 2%乙醚/乙酸溶液洗脱并收集洗脱液,氮气吹干后加入10 μL十一酸甲酯和1 mL(13%)三氟化硼甲醇溶液,于50 ℃水浴甲酯化20 min,加入4 mL正己烷溶液提取(匀20 s,静置1 h),取样液1 μL进样分析。
1.4 数据处理
采用SPSS 27.0软件进行数据分析、邓肯式多重差异分析(P<0.05表示差异显著),每个试验至少重复3次,结果以“平均值±标准差”表示,采用Origin 2023b软件进行绘图和相关性分析。
2 结果与分析
2.1 熏鸡挥发性香气化合物
对不同熏制时间条件下熏鸡腿肉进行风味定性分析,共鉴定出67种香气化合物,包括酚、醛、醇、酮、酸、酯、呋喃及吡嗪等类物质(图1-A)。在未熏制鸡腿肉中仅鉴定出28种,而熏制6 h时达54种。酚类为烟熏肉主要的香气化合物,如图1-B所示,未熏制条件下仅可检出7种酚类物质且含量较低,在熏制过程中检测到多达21种。熏鸡腿肉中OAVs>1的香气化合物共24种,对熏鸡香气有重大贡献(图1-B),酚类有愈创木酚、对甲酚、苯酚、2-甲基苯酚、3-甲基苯酚、4-乙基愈创木酚等9种关键化合物,其中愈创木酚(13≤OAV≤2 435)最丰富,贡献率最高。由嗅闻可知,熏制时间适当时,酚类物质主要表现为烟熏香味、焦糖味和木香味等令人愉悦且易接受的气味;但熏制时间过长时,由于含量过高出现烟臭味和苦味(如愈创木酚、4-乙基愈创木酚等),因此熏制时间选择6 h左右最为合适。
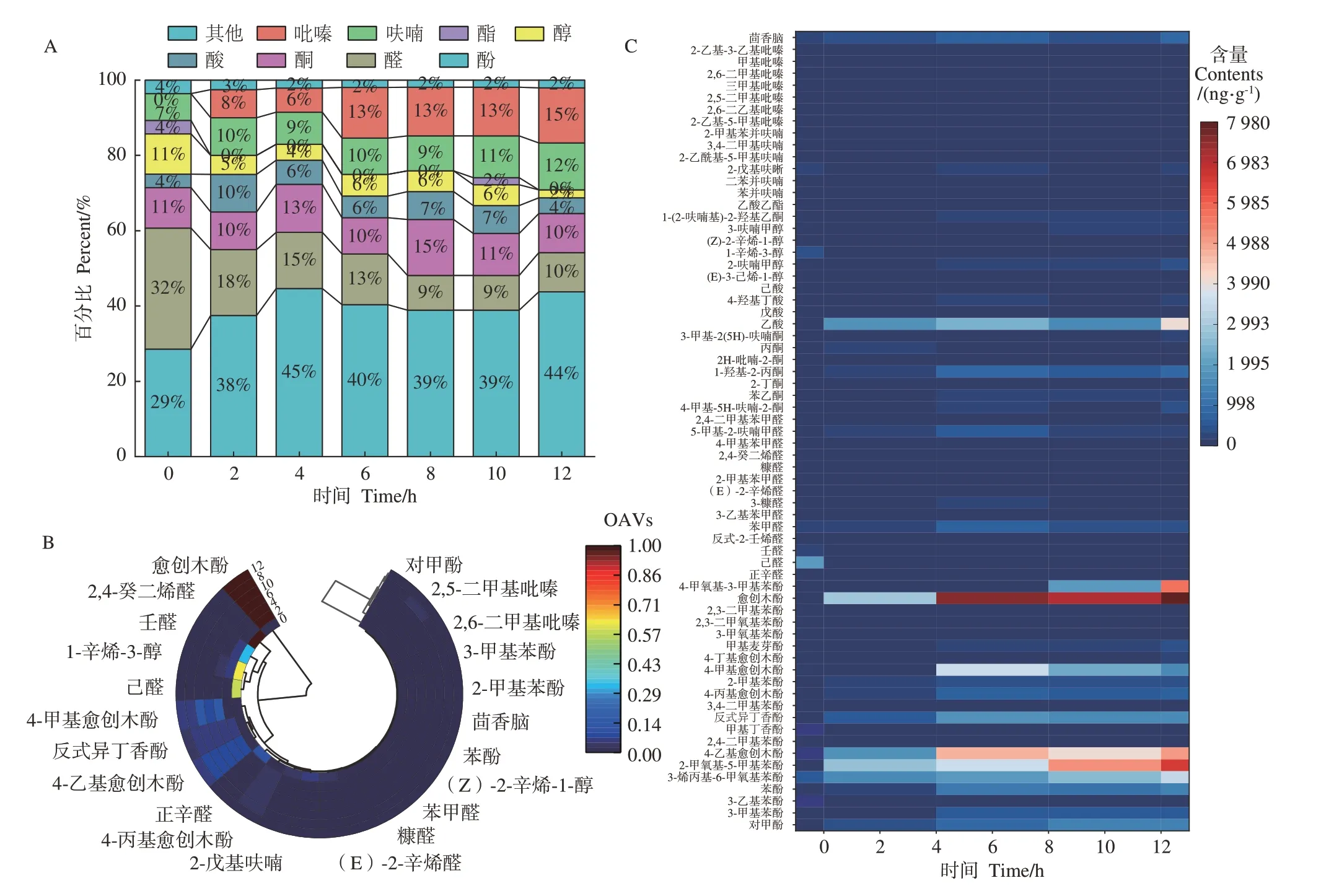
图1 熏制过程中鸡腿香气化合物半定性定量分析Fig.1 Semi-qualitative and quantitative analysis of aroma compounds in chicken thigh in the smoking processes
醛类被认为是脂肪的主要二次氧化产物,己醛和壬醛在未熏制鸡腿肉中最为丰富,但熏制过程中正辛醛、壬醛、己醛、反式-2-壬烯醛、(E)-2-辛烯醛、2,4-癸二烯醛等气味阈值低的物质含量减少甚至未检测出(图1-C)。在熏制过程中,呋喃和吡嗪类物质含量变化无差异,但种类增多,其中2-戊基呋喃、2,5-二甲基吡嗪的OAVs值较高,对熏肉风味贡献率大。
2.2 熏鸡危害物分析结果
2.2.1 HAs分析结果 由图2可知,鸡腿肉在熏制过程中共检测出6种HAs,包括MeIQx、Harman、IQx、Norharman、PhIP和MeIQ。在熏制0~12 h过程中,Norharman从3.42增至37.38 ng·g-1,高于其他HAs;其次为Harman。它们促进了非极性HAs含量的增加。Norharman和Harman为熏鸡腿肉中最主要的HAs,这与Zhang等[12]的结果一致。除MeIQ外,其他极性HAs与熏制时间呈正相关,但含量相对较低,PhIP和MeIQx以足够水平产生时,诱导癌症发生的可能性增加。
2.2.2 AGEs分析结果 由于肉制品中蛋白质和脂肪含量高,与水果和蔬菜等食物相比更易产生AGEs[18]。如图3所示,主要对CML、CEL、MG-H1进行定量分析,在熏制过程中,CEL(59.86~180.13 μg·g-1)与CML(8.17~123.94 μg·g-1)含量高于MG-H1(2.99~9.01 μg·g-1),这可能是因为CML与CEL除了由赖氨酸或精氨酸与二羰基化合物在美拉德反应中生成外,还通过蛋白质和脂肪氧化途径产生,且脂质氧化和美拉德反应可能对肉中CML的产生有协同效应,而MG-H1由精氨酸残基与乙二醛或甲基乙二醛反应形成[4]。摄入人体内的AGEs难以被排除体外而积累,从而易诱发系列慢性疾病,在熏制过程中其含量与熏制时间呈正相关,因此需要对熏制时间进行精准控制。
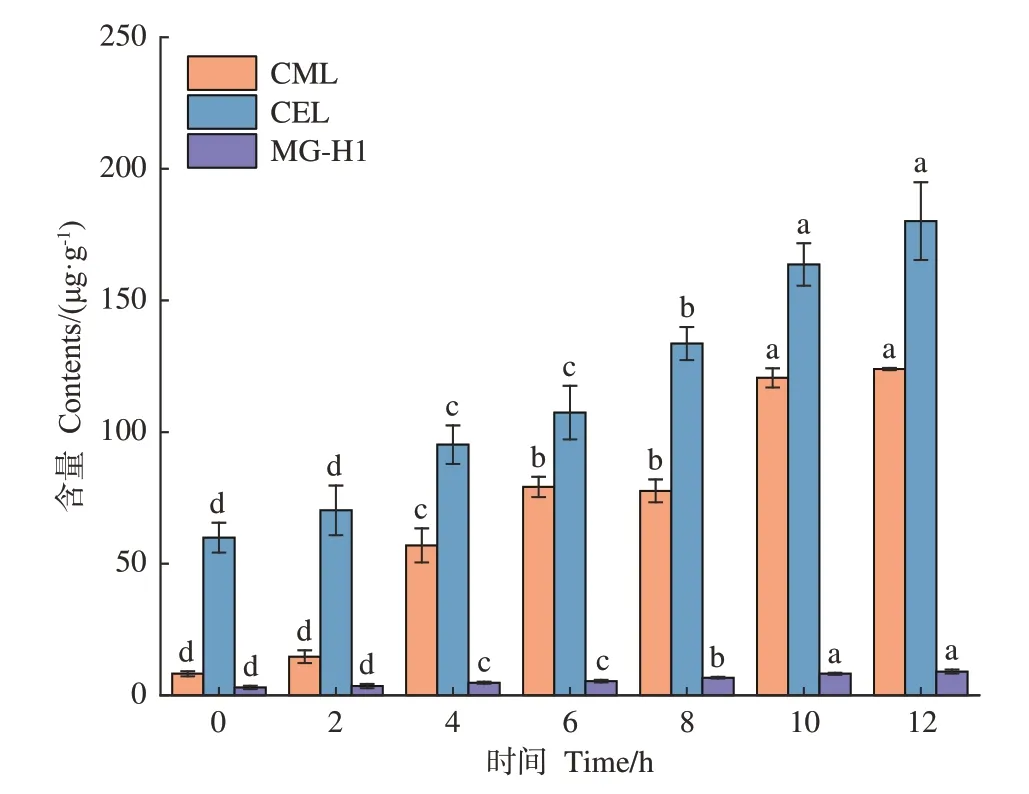
图3 熏制过程中鸡腿AGEs含量Fig.3 AGEs contents in chicken thigh during smoking processes
2.2.3 PAH4分析结果 PAHs由两个或两个以上的的稠合芳环组成,是致癌、致畸、致突变的有毒物质[2]。如图4所示,在相同温度熏制条件下,熏制时间0~12 h内PAH4含量随熏制时间的延长而增加,Chr、BaA、BbF和BaP含量分别为4.20~41.10、0.10~15.34、0.13~0.36和0.07~0.14 μg·kg-1,当熏制时间达到8 h,PAH4总含量为32.69 μg·kg-1,熏制12 h时高达67.80 μg·kg-1,超过了欧盟规定的PAH4含量不应高于30 μg·kg-1的标准,但熏鸡腿肉中BaP含量未超过欧盟规定的不得超过5 μg·kg-1[24]的标准。对熏鸡熏制过程中HAs、AGEs和PAH4定性定量分析发现,熏制时间与危害物生成量呈正相关。因此,熏鸡长时间熏制并非有利,根据欧盟要求PAH4≤30 μg·kg-1的标准,应将熏制时间控制在8 h以下。
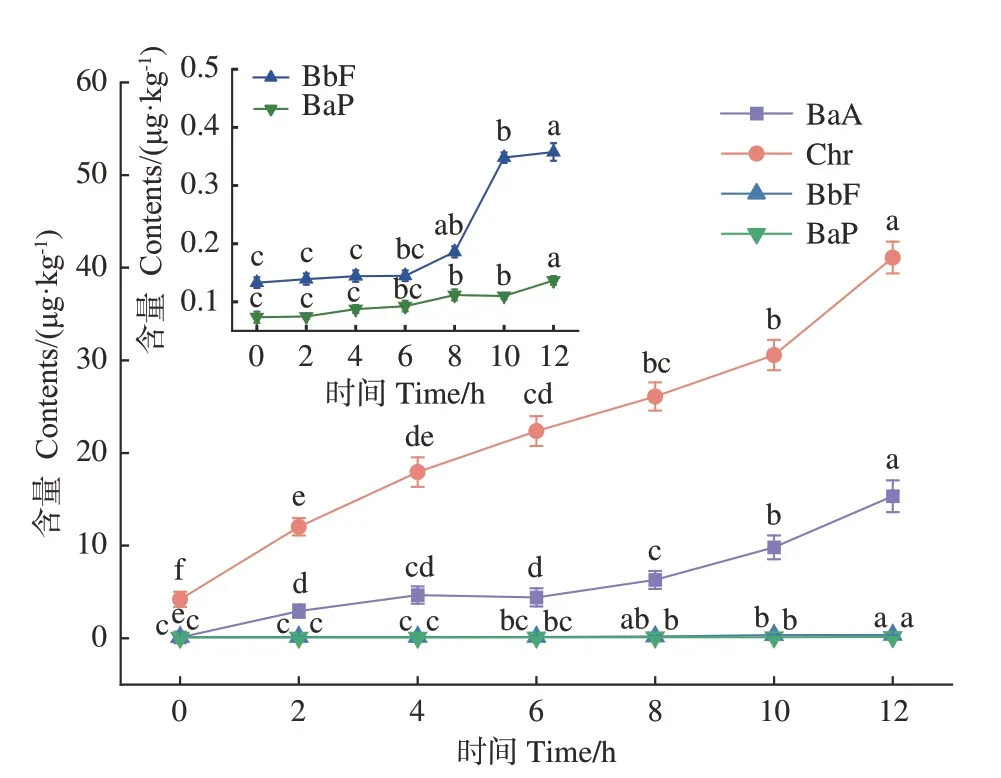
图4 熏制过程中鸡腿PAH4含量Fig.4 PAH4 contents in chicken thigh during smoking processes
2.3 熏鸡前体物质分析结果
2.3.1 脂肪含量、含水量分析结果 如表1所示,鸡腿肉中脂肪含量为5.10%~9.47%,其与熏制时间未呈现规律性变化,但与未熏制(0 h)鸡腿肉相比,熏制2~10 h的鸡腿肉脂肪含量显著减少(P<0.05)。水分含量与熏制时间呈负相关,水分含量越高,危害物含量越低。这可能是由于高水分含量可抑制美拉德反应速率,从而影响美拉德反应产物(HAs和AGEs)形成,导致更多危害物在熏制过程中产生。
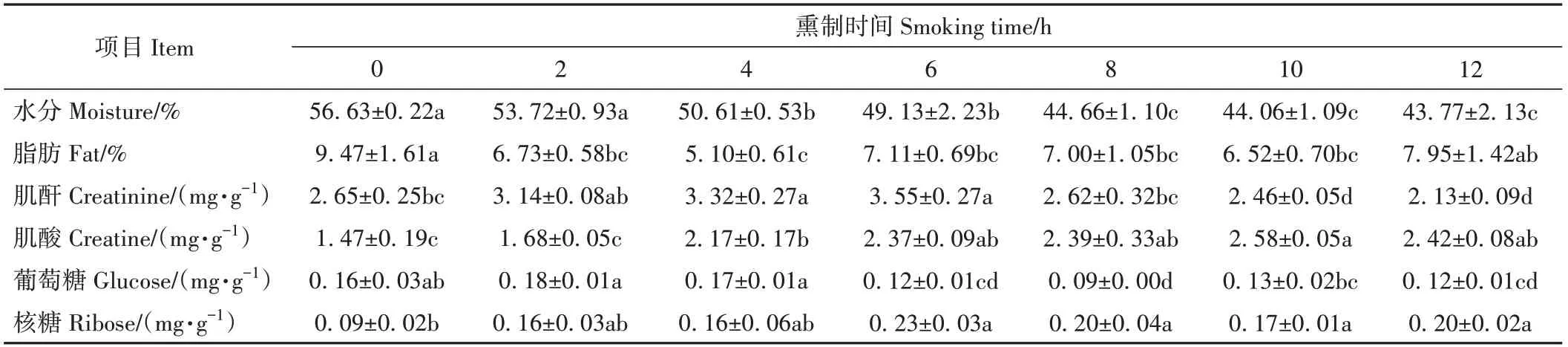
表1 熏制过程鸡腿中水分、脂肪、肌酐/酸和还原糖含量Table 1 Moisture,fat,creatinine,creatine and reducing sugar contents in chicken thigh during the smoking processes
2.3.2 肌酐、肌酸和还原糖含量分析结果 肌酐和肌酸是形成HAs的重要前体。如表1所示,肌酐含量整体高于肌酸,分别为2.13~3.55、1.47~2.58 mg·g-1。鸡腿肉中肌酐和肌酸含量随熏制时间延长先增加后减少。这可能是由于烟熏过程中特殊的温湿度和适宜熏制时间有利于肌酐和肌酸生成,但熏制时间过长会导致肌酐和肌酸被消耗生成更多HAs[25]。
肉制品中的主要还原糖为葡萄糖和核糖。两者都能与氨基酸和多肽反应生成香气化合物、HAs和AGEs。由表1可知,与0 h相比,熏制6 h后葡萄糖含量逐渐减少,在加热条件下,其参与美拉德反应生成危害物,为HAs和AGEs的主要前体物。而熏制条件下核糖含量增加,可能是核糖生成速率大于消耗速率而积累,这与Shi等[26]的研究结果一致。刘欢等[16]研究表明,核糖与含硫氨基酸反应可形成含硫挥发性化合物,如二甲基三硫,但仅少量含硫类化合物在熏鸡腿中被鉴定出。
2.3.3 氨基酸含量分析结果 由表2可知,鸡腿肉熏制过程中共检测出18种游离氨基酸,总含量为1 062.98~1 372.30 mg·kg-1,其中谷氨酸、天冬氨酸、丙氨酸、苏氨酸、丝氨酸等为鲜味、甜味氨基酸[27],其含量随熏制时间延长先增加后减少。谷氨酸含量高于天冬氨酸,其为熏鸡提供了强烈鲜味,为重要的鲜味氨基酸,而与对照相比,熏鸡腿肉中苯丙氨酸、亮氨酸等苦味氨基酸含量在6~12 h显著增加(P<0.05),这与刘登勇等[23]的结果一致。而色氨酸、脯氨酸、精氨酸、赖氨酸含量逐渐减少,这可能是因为在美拉德反应末期,色氨酸与乙醛在低温下(100~130 ℃)反应形成Harman和Norharman,赖氨酸/精氨酸与二羰基化合物反应生成CML与CEL被消耗[4,28]。
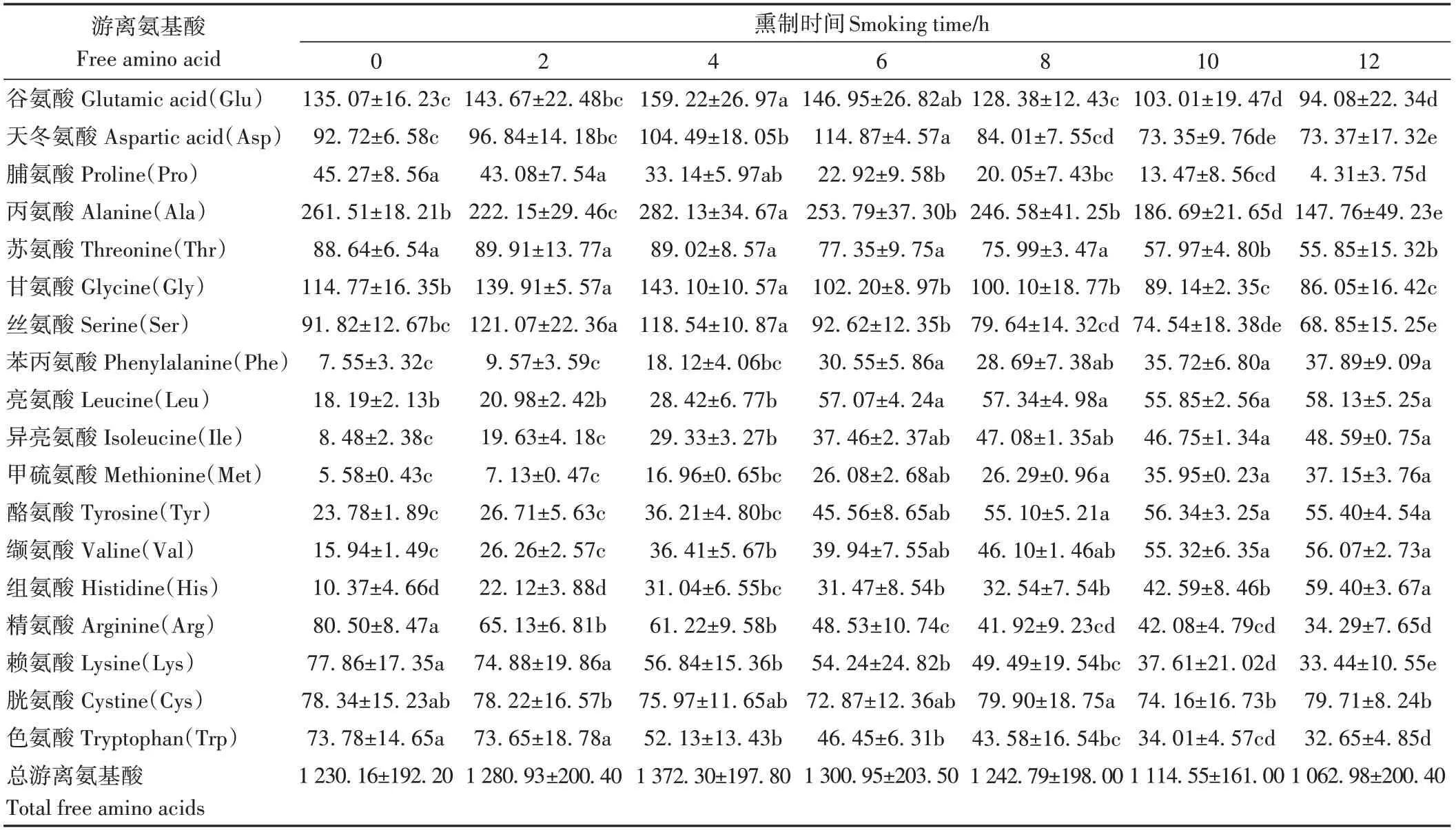
表2 熏制过程鸡腿中游离氨基酸含量Table 2 Free amino acid contents in chicken thigh during smoking processes/(mg·kg-1)
2.3.4 游离脂肪酸含量分析结果 游离脂肪酸为醛、醇类挥发性化合物的重要前体。如表3所示,对4个熏制时间点鸡腿肉中游离脂肪酸进行定性定量分析,共检测出15种游离脂肪酸,包括6种饱和脂肪酸和9种不饱和脂肪酸,其中单不饱和脂肪酸4种、多不饱和脂肪酸5种。熏鸡腿中油酸、亚油酸、花生四烯酸、二十二碳六烯酸含量较高,为主要的不饱和脂肪酸,与对照相比,其含量随熏制时间增加先降低后升高,但花生四烯酸、二十二碳六烯酸无显著差异(P>0.05),这可能是因为花生四烯酸可氧化形成己醛、庚醛、辛醛和壬醛等[29],但在熏制过程中醛类化合物生成较少,减少了对脂肪酸的消耗。
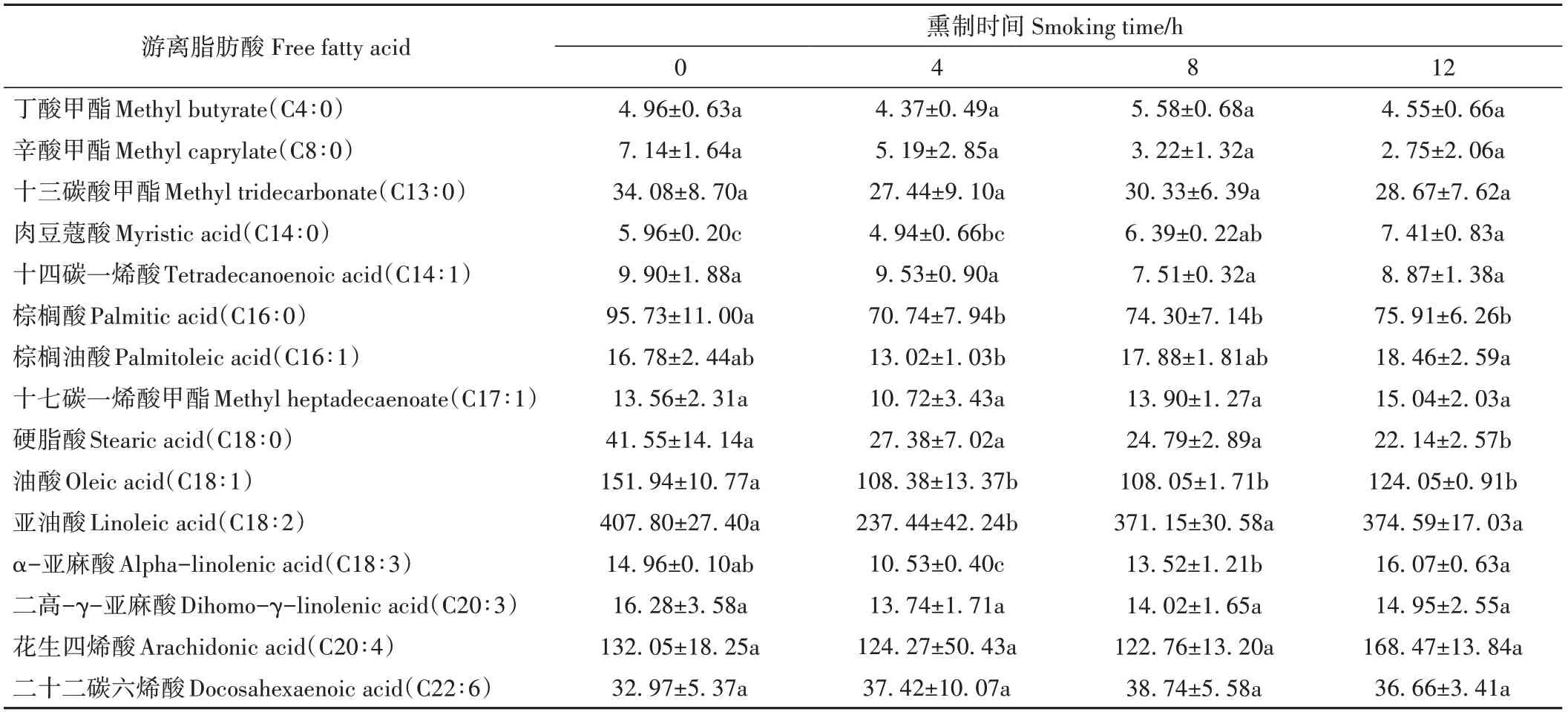
表3 熏制过程鸡腿中游离脂肪酸含量Table 3 Free fatty acid contents in chicken thigh during smoking processes/(mg·kg-1)
2.4 关键香气化合物、危害物与前体物含量的相关性
熏鸡腿中醛类、醇类和吡嗪类物质与肉中前体物有潜在相关性,因此对其OAVs>1的香气化合物与前体物相关性进行分析。如图5-A所示,醛类(辛醛、己醛、壬醛等)和醇类(1-辛烯-3-醇、(Z)-2-辛烯-1-醇)含量与核糖含量呈显著负相关,壬醛、1-辛烯-3-醇含量分别与异亮氨酸、酪氨酸、缬氨酸、组氨酸含量呈显著负相关(P<0.05)。苯甲醛和糠醛含量与油酸、亚油酸和α-亚麻酸等不饱和游离氨基酸含量呈显著或极显著负相关(P<0.05或P<0.01)。辛醛、壬醛主要由油酸氧化而来,己醛、2,4-癸二烯醛主要由亚油酸氧化而来,而本研究中上述指标间的相关性不显著(P>0.05)。吡嗪中的2,5-二甲基吡嗪和2,6-二甲基吡嗪含量与苯丙氨酸、甲硫氨酸、赖氨酸等氨基酸含量呈显著或极显著正相关,与甘氨酸、色氨酸和十四碳一烯酸含量呈显著或极显著负相关(P<0.05或P<0.01)。
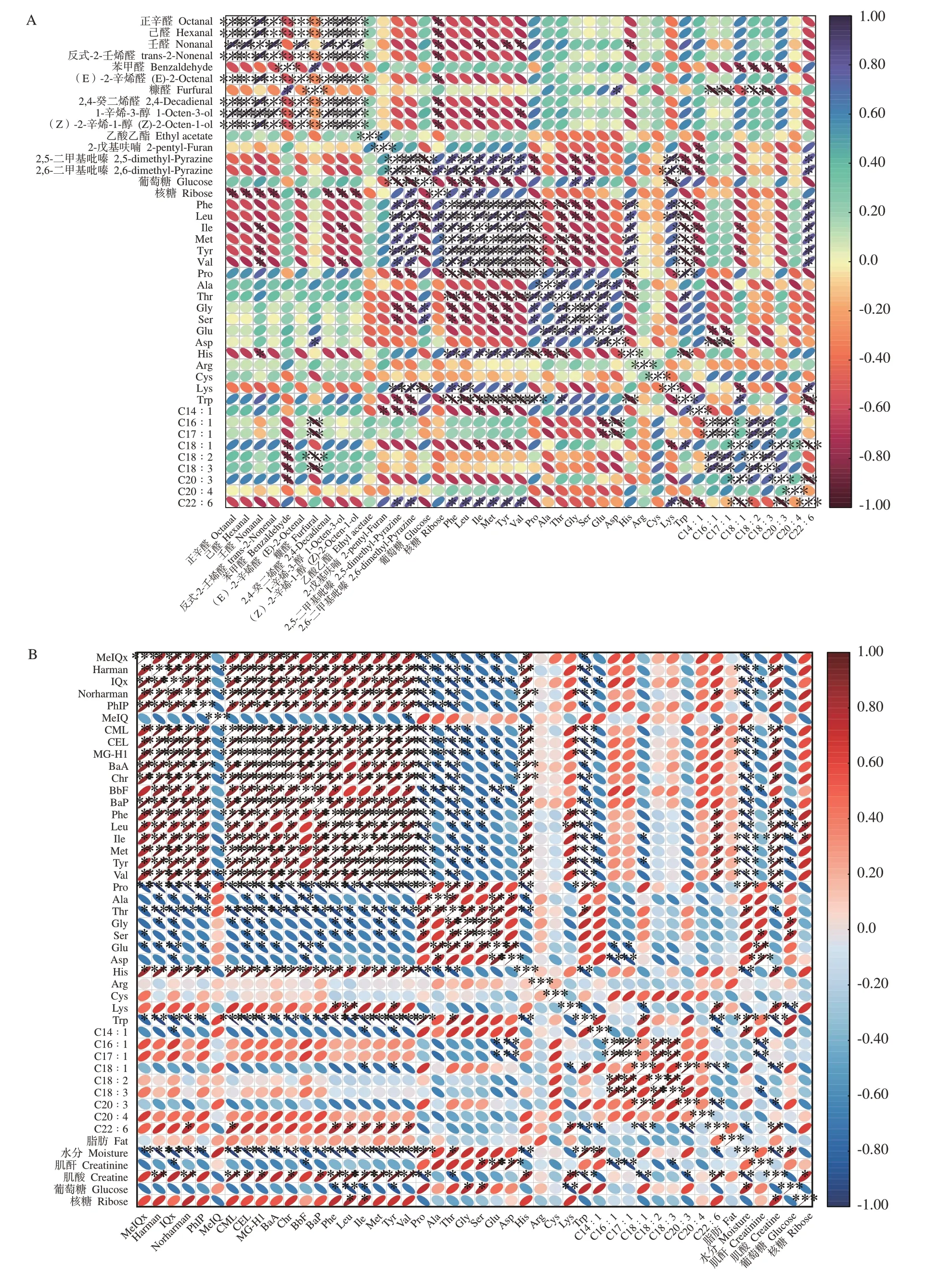
图5 熏制过程鸡腿中关键香气化合物(A)、危害物(B)与前体物的相关性Fig.5 Correlation of key aroma compounds,hazardous compounds and precursors in chicken thigh during the smoking processes
危害物与前体物含量相关性分析如图5-B所示,除MeIQ外,HAs(MeIQx、PhIP、IQx、Norharman、Harman)含量与苯丙氨酸、甲硫氨酸含量呈显著或极显著正相关,与脯氨酸、丙氨酸、苏氨酸、谷氨酸、色氨酸、水分和肌酐含量呈显著或极显著负相关(P<0.05或P<0.01),与Gibis等[30]的研究结果一致。AGEs(CML、CEL、MG-H1)和PAH4含量也与苯丙氨酸、甲硫氨酸、酪氨酸含量呈显著正相关,与脯氨酸、苏氨酸、色氨酸和水分含量呈显著或极显著负相关(P<0.05或P<0.01)。赖氨酸和精氨酸为生成CML与CEL的重要前体物[4],相互间存在相关性但不显著(P>0.05)。危害物含量间表现出显著正相关,这可能归因于化合物间的协同生成效应,且具有共同的前体物质及类似的生成反应条件。综上,苯丙氨酸、甲硫氨酸、酪氨酸和色氨酸等对香气化合物和危害物形成有共同显著调控作用(P<0.05或P<0.01)。
3 讨论
本研究发现,在熏制过程中,聊城熏鸡腿肉酚类化合物种类及含量增加,从7种增至21种。Pham等[31]调查发现,消费者更喜爱烟熏火腿中的愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚、2,6-二氧基苯酚气味(P<0.05)。上述物质也是聊城熏鸡腿肉中的关键香气化合物,这可能是其深受消费者喜爱的原因之一。醛类阈值低且呈肉香味,经卤煮后的鸡腿肉中醛类物质较多,但在熏制过程中的种类与数量逐渐减少,推测其在烟熏过程中有损失,且强烟熏味对醛类的肉香味有掩盖作用,但具体原因有待进一步探究。除酚类外,呋喃和吡嗪类被认为是烟熏肉中重要的香气化合物。呋喃类可以缓和酚类带来的强烈烟熏味,使烟熏产品形成令人愉悦、易接受的混合烟熏香味[5]。熏鸡腿肉中除苯并呋喃、2-戊基呋喃外,二苯并呋喃、2-乙酰基-5-甲基呋喃、3,4-二甲基呋喃、2-甲基苯并呋喃等为熏制过程中产生的化合物。吡嗪类是杂环含氮化合物,由于木材含有氮源,鸡腿肉在烟熏过程中产生了7种吡嗪类物质,包括2-乙基-5-甲基吡嗪、2,6-二乙基吡嗪、2,5-二甲基吡嗪、三甲基吡嗪、2,6-二甲基吡嗪、甲基吡嗪和2-乙基-3-乙基吡嗪。
食品中的脂肪、蛋白质、碳水化合物及其中间体在高温下不仅产生香气化合物,还可生成HAs、AGEs、PAHs等潜在致癌物质,从而对人体健康造成危害。Yu等[4]对烟熏香肠中脂质氧化和CML、CEL生成之间的相关性进行分析,发现脂质氧化值和CML、CEL含量间呈指数相关性,储藏期间易发生脂质氧化。因此,肉制品在加热及储藏过程中均可促进CML和CEL的积累,这可能也是本研究熏鸡腿肉中CML和CEL含量较高的原因之一。脂肪、脂肪酸是形成PAHs的重要前体物质,熏鸡腿中检测到不饱和脂肪酸共9种,且油酸、亚油酸、花生四烯酸、二十二碳六烯酸为主要的不饱和脂肪酸,这表明香气化合物产生的同时也有利于PAHs的生成,与Silva等[8]的研究结果一致。
Montazeri等[32]研究表明,熏鸡挥发性化合物和危害物的形成主要与烟熏材料的类型和化学成分有关。除熏制材料外,对香气化合物和危害物影响的主要因素为熏制温度、时间和熏材含水量等[33]。另外,HAs的形成受到前体物类型和水平及其相互间摩尔比的影响。非极性HAs不依赖于肌酸的存在,因为它们仅由碳水化合物和氨基酸形成,如色氨酸[34]。熏制样品中HAs成分的变化可能是由烟雾成分在生成HAs中的贡献所致。如烟雾中的醇类可能在高温下反应形成醛或酮类,醛、酮类可能与吡啶/吡嗪及肌酐反应促进极性HAs生成[35],这进一步解释了温熏条件下极性HAs增加的原因。
4 结论
本研究初步揭示了烟熏鸡腿肉关键香气化合物为愈创木酚,主要危害物为Norharman、CML、CEL和Chr,且烟熏可增加关键酚类物质和危害物的种类及含量。控制烟熏时间在6 h左右可使熏鸡保持令人愉悦的香气,同时危害物含量较低。初步阐明了香气化合物和危害物协同底物伴生关系,熏鸡关键香气化合物含量与核糖、游离氨基酸酪氨酸、色氨酸和游离脂肪酸油酸、亚油酸、α-亚麻酸等含量呈显著负相关,与苯丙氨酸、甲硫氨酸、赖氨酸等含量呈显著正相关;HAs、AGEs、PAH4含量与水分、葡萄糖、肌酐和游离氨基酸苏氨酸、色氨酸等含量呈显著或极显著负相关,与苯丙氨酸、甲硫氨酸、酪氨酸等含量呈显著正相关。

