双酶辅助水蒸气蒸馏法提取肉豆蔻精油及其GC-MS成分分析
盖旭 程庠 姜子涛 罗君萍
摘要:采用双酶辅助水蒸气蒸馏法提取广西产肉豆蔻的精油,并通过GC-MS对其进行成分分析。正交实验结果表明,最优提取工艺条件为加酶量2%、酶解pH 4.0、酶解温度40 ℃,在此条件下,肉豆蔻精油的得率为6.50 mL/100 g。利用GC-MS和保留指数法从精油中鉴定出56种化合物,占精油总量的99.71%,主要成分为肉豆蔻醚(16.60%)、甲基丁香酚(14.78%)、桧烯(13.47%)、(+)-柠檬烯(7.29%)、4-萜烯醇(6.75%)、榄香素(6.62%)、γ-松油烯(4.28%)、反式-甲基异丁香酚(3.73%)、β-蒎烯(3.59%)和黄樟素(3.22%)。
关键词:肉豆蔻精油;双酶辅助水蒸气蒸馏;提取;气相色谱-质谱;成分分析;保留指数
中图分类号:TS225.19 文献标志码:A 文章编号:1000-9973(2024)02-0165-06
Extraction of Myristica fragrans Houtt. Essential Oil by Dual Enzyme Assisted Steam Distillation and Its Component Analysis by GC-MS
Abstract: Dual enzyme assisted steam distillation is used to extract essential oil from Myristica fragrans Houtt. in Guangxi, and its components are analyzed by GC-MS. The orthogonal experimental results indicate that the optimal extraction process conditions are enzyme addition amount of 2%, enzymatic hydrolysis pH of 4.0 and enzymatic hydrolysis temperature of 40 ℃. Under these conditions, the yield of essential oil from Myristica fragrans Houtt. is 6.50 mL/100 g. Fifty-six compounds are identified in essential oil by GC-MS and retention index method, accounting for 99.71% of the total essential oil. The main components are myristicin (16.60%), methyleugenol (14.78%), sabinene (13.47%), (+)-limonene (7.29%), terpinen-4-ol (6.75%), elemicin (6.62%), γ-terpinene (4.28%), trans-methyl eugenol (3.73%), β-pinene (3.59%) and safrole (3.22%).
Key words: essential oil from Myristica fragrans Houtt.; dual enzyme assisted steam distillation; extraction; GC-MS; component analysis; retention index
肉豆蔻(Myristica fragrans Houtt.),又稱顶头肉、玉果、扎地,是木兰目肉豆蔻科豆蔻属乔木植物肉豆蔻的干燥种仁,原产于马鲁古群岛,如今在印度尼西亚、马来西亚、西印度群岛、巴西以及我国的粤、桂、琼、闽、黔和台湾等热带、亚热带地区分布广泛[1],其外表呈椭圆形,黑褐色,有皱纹,内部有斑缬纹,易与草豆蔻(Alpinia katsumadai Hayata)和白豆蔻(Amomum verum Blackw.)混淆。肉豆蔻具有较高的药食两用价值,作为食品中常用的香辛料,有去异味、去腥、增香等功效,常用于卤水及火锅等中;另外,还有涩肠止泻、温中行气、抑菌和平喘等药用功效。肉豆蔻中含有肉豆蔻油、木脂素、苯丙素、总酚、黄酮、无机必需元素等成分[2],其中精油含量较高,约占8%~15%,研究表明其具有抗癌、抗氧化、抑菌、降血糖、降血脂、保肝护肝等多种功能活性,有重要的开发利用价值[3-5]。
目前肉豆蔻精油的提取方法主要有水蒸气蒸馏法、微波辅助水蒸气蒸馏法、超声-微波辅助水蒸气蒸馏法以及超临界CO2萃取法等[6-9]。酶辅助法是在水蒸气蒸馏前加入适宜的酶对原料进行处理,使植物细胞壁组织水解,有效成分溶出,以提高精油得率的一种方法。此法可以缩短整体提取时间,且无需特殊设备、操作简便。目前采用混合酶辅助水蒸气蒸馏法提取肉豆蔻精油并进行成分分析的研究鲜有报道。本研究以广西产肉豆蔻为对象,优化纤维素酶和果胶酶双酶辅助水蒸气蒸馏法提取肉豆蔻精油的工艺,并采用GC-MS分析其成分,为完善和丰富肉豆蔻挥发性物质的提取方法和指纹图谱提供基础数据,并为其在天然抗氧化剂、保鲜剂以及抗菌剂等方面的应用提供依据。
1 材料与方法
1.1 材料与试剂
肉豆蔻:产地广西壮族自治区;纤维素酶(10万U/g)、果胶酶(6万U/g):浙江一诺生物科技有限公司;无水硫酸钠、氢氧化钠、氯化钠、盐酸(均为分析纯):天津市风船化学试剂科技有限公司;乙酸乙酯、正己烷(均为色谱纯):默克股份两合公司;C7~C40正构烷烃标准品:Sigma-Aldrich 公司;实验用水为去离子水。
1.2 仪器与设备
YP1201N电子天平 上海精密科学仪器有限公司;800Y高速粉碎机 永康市铂欧五金制品有限公司;XMTD-204水浴锅 天津市欧诺仪器仪表有限公司;TSQ8000气相色谱-三重四极杆质谱联用仪 赛默飞世尔科技公司;水蒸气蒸馏装置 上海予申仪器有限公司。
1.3 肉豆蔻精油的提取
1.3.1 原料前处理
将干燥、完整的原料肉豆蔻用高速粉碎机粉碎后,过80目筛,常温密封备用。
1.3.2 提取工艺
根据《中国药典》(2020年版)四部通则2204 挥发油测定法[10]和徐兴堂等[11]的方法进行改良。称取肉豆蔻粉末20 g,放入1 000 mL圆底烧瓶中,按料水比1∶10加入去离子水,加入2%的双酶(纤维素酶∶果胶酶为1∶1),并用盐酸调节pH至4.0,50 ℃下水浴酶解40 min;连接油水分离器和冷凝管,采用电热套加热至沸腾,水蒸气蒸馏提取3 h。馏出液冷却静置30 min,读取精油体积,计算提取得率。得率的计算公式如下:
1.3.3 单因素实验设计
1.3.3.1 加酶量
分别加入0.5%、1%、2%、3%、4%的酶进行酶解反应,其他步骤同1.3.2。
1.3.3.2 酶的比例
分别添加纤维素酶、果胶酶,纤维素酶和果胶酶的比例分别为2∶1、1∶1、1∶2,进行酶解反应,其他步骤同1.3.2。
1.3.3.3 酶解时间
分别选择10,20,40,60,80 min进行酶解反应,其他步骤同1.3.2。
1.3.3.4 酶解温度
分别于30,40,50,60,70 ℃水浴加热进行酶解反应,其他步骤同1.3.2。
1.3.3.5 酶解pH
分别将提取液的pH值调整至2.0,3.0,4.0,5.0,6.0进行酶解反应,其他步骤同1.3.2。
1.3.4 正交实验优化
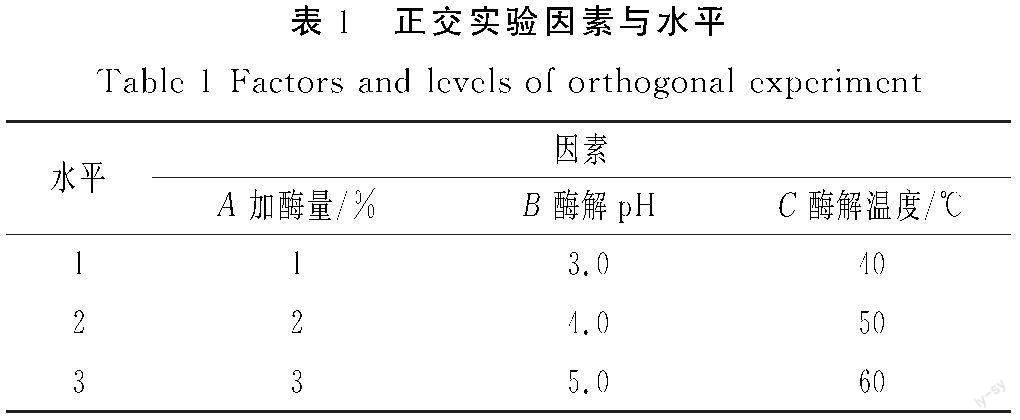
根据单因素实验结果,选择加酶量、酶解pH、酶解温度3个因素,以精油提取得率作为考察指标,设计L9(33)正交实验,筛选最佳提取工艺。正交实验因素水平表见表1。
1.4 肉豆蔻精油的GC-MS成分分析
C7~C40正构烷烃标准品用正己烷稀释至100 μg/mL, 经0.22 μm滤膜过滤后,供GC-MS进行保留指数分析。提取所得肉豆蔻精油样品,加入无水硫酸钠除水后,离心,取上清液,用乙酸乙酯稀释至一定浓度,经0.22 μm滤膜过滤后,供GC-MS分析。
气相色谱条件:HP-5MS 石英毛细管柱(50 m×0.25 mm,0.25 μm),进样口温度260 ℃,载气:氦气,载气流速 1 mL/min,进样量1 μL。程序升温:初始温度40 ℃,以5 ℃/min的速率升温至70 ℃(保持5 min),以5 ℃/min的速率升温至160 ℃(保持5 min),以5 ℃/min的速率升温至200 ℃(保持2 min);质谱条件:离子源 EI 源,离子源温度250 ℃,四极杆温度150 ℃,电子能量70 eV,倍增管电压1.2 kV,接口温度260 ℃,质量扫描范围(m/z):40~550 u。
2 结果与分析
2.1 单因素实验结果
2.1.1 加酶量对肉豆蔻精油提取得率的影响
酶的添加能分解构成肉豆蔻细胞壁的纤维素、半纤维素及果胶,从而破坏细胞壁的结构,产生局部的坍塌、溶解、疏松,减少溶剂提取时来自细胞壁和细胞间质的阻力,加快精油成分溶出细胞的速率。不同加酶量下精油的提取得率见图1。
由图1可知,加酶量在2%时得率最高。在一定范围内,得率随着加酶量的升高而增加,这是由于酶用量的增加使得酶解反应更加充分、完整,因此提取得率显著增加。当加酶量大于2%时,得率反而降低,可能是因为酶与肉豆蔻充分接触,反应更快、更彻底,导致后期步骤中部分精油挥发而损失,使最终得率不高[12]。且酶用量增加会使生产成本增加,因此较优的加酶量为2%。
2.1.2 酶的比例对肉豆蔻精油提取得率的影响
不同酶的比例下精油的提取得率见图2。
由图2可知,双酶复合提取肉豆蔻精油的得率高于单酶。当纤维素酶和果胶酶的比例为1∶1时得率最高。这是因为双酶协同作用提升了原料细胞壁中纤维和果胶等成分的分解效果,得率提高。因此,较优的酶的比例为1∶1。
2.1.3 酶解时间对肉豆蔻精油提取得率的影响
不同酶解时间下精油的提取得率见图3。
由图3可知,随着酶解时间的增加,酶与肉豆蔻的接触时间更长,酶解更彻底,得率增大。当酶解时间超过40 min后,得率显著降低,可能是因为酶解时间过长,酶活性逐渐降低,甚至失活。因此,较优的酶解时间为40 min。
2.1.4 酶解温度对肉豆蔻精油提取得率的影响
不同种类的酶作用温度不同,纤维素酶的反应温度范围为40~50 ℃,果胶酶的作用温度范围为15~55 ℃。不同酶解温度下精油的提取得率见图4。
由图4可知,酶解温度在50 ℃时得率最高,低于50 ℃时,得率随温度的升高而增加。因为随着温度升高,纤维素酶、果胶酶的活力提高,促进了肉豆蔻细胞壁中纤维素、果胶的分解,使得率相应增加。当温度超过50 ℃后,得率降低,這是因为温度过高,超过了纤维素酶和果胶酶协同作用的最适温度,酶活降低,减缓了分解速度,使得率降低。因此,较优的酶解温度为50 ℃。
2.1.5 酶解pH对肉豆蔻精油提取得率的影响
不同种类的酶作用pH不同,在一定pH范围内,酶均有一定活性。根据酶的产品说明,纤维素酶的作用pH为4.5~6.5,最适pH为4.8;果胶酶的作用pH为2.5~6.0,最适pH为3.5。不同酶解pH下精油的提取得率见图5。
由图5可知,酶解pH越接近4.0,精油得率越高。这是因为越接近双酶协同的最适pH,酶活越高,促进了细胞壁分解和产物释放;当酶解pH小于或者大于4.0时,即高于或低于最适pH,都会导致酶的活性降低,甚至逐渐失活,得率降低[12]。pH为2.0时得率最低,仅有3.50%。因此,较优的酶解pH为4.0。
2.2 正交实验结果分析
正交实验结果见表2。
由表2可知,R值反映各因素影响实验结果的主次关系,R值越大,表明该因素对实验指标的影响越大,该因素越重要[13]。由极差分析结果可知,3个因素对得率的影响程度为A>B>C,正交实验范围内的最优条件为A2B2C1,即加酶量2%、酶解pH 4.0、酶解温度40 ℃。
2.3 精油成分分析
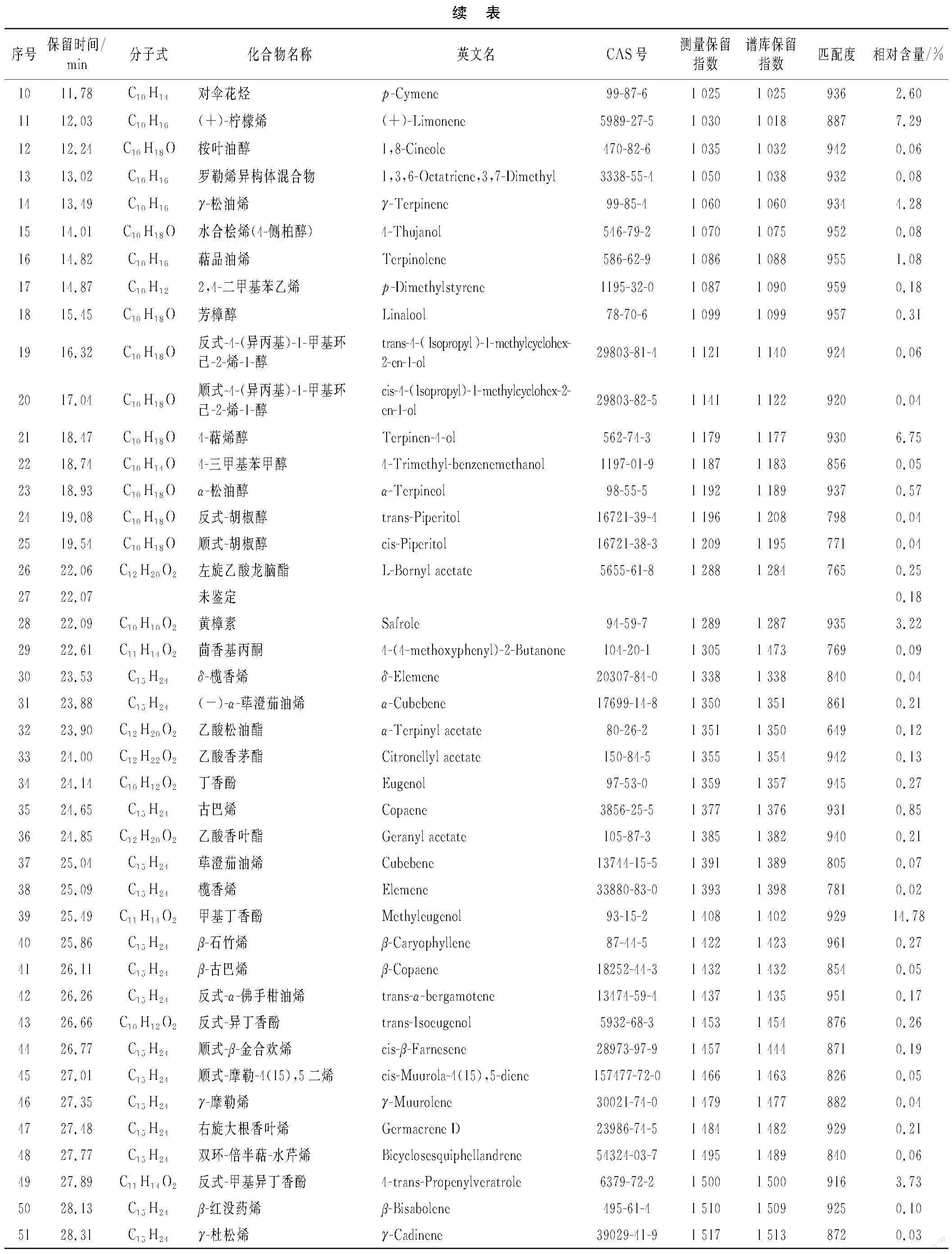
所提取的肉豆蔻精油经GC-MS分离出58种化合物,与NIST质谱图库比对并结合保留指数,共鉴定出56种成分,占精油成分总量的99.71%,未鉴定出化合物2种,总离子流色谱图见图6。通过峰面积归一化法计算各组分的相对含量,精油成分及含量见表3。
文献[14-19]研究表明,不同部位、季节、产地、提取方法得到的肉豆蔻精油成分及含量差异比较大,但均以萜烯类和酚类化合物为主。由表3可知,含量大于3%的成分有10种,其中肉豆蔻醚含量(16.60%)最高,其次为甲基丁香酚(14.78%)、桧烯(13.47%)、(+)-柠檬烯(7.29%)、4-萜烯醇(6.75%)、榄香素(6.62%)、γ-松油烯(4.28%)、β-蒎烯(4.17%)、反式-甲基异丁香酚(3.73%)和黄樟素(3.22%)。精油中肉豆蔻醚、甲基丁香酚、甲基异丁香酚、4-萜烯醇和榄香素等含氧化合物含量较高,对于其抗氧化性和抑菌性起到了较关键的作用。同时,顺式-摩勒-4(15),5二烯、榄香烯、δ-榄香烯3种成分为首次发现。
3 结论
本研究以广西产肉豆蔻为原料,采用纤维素酶、果胶酶双酶辅助水蒸气蒸馏法提取肉豆蔻精油,通过正交实验得到的最优工艺条件为加酶量2%、酶解pH 4.0、酶解时间3 h,在此条件下提取得率为6.50 mL/100 g,3个因素对得率的影响程度为加酶量>酶解pH>酶解时间;利用GC-MS对所提取的精油进行成分分析,共鉴定出化合物56种,占精油总量的99.71%,其中含量大于3%的成分有10种,首次发现的成分有3种。综上所述,双酶辅助水蒸气蒸馏法较传统的水蒸气蒸馏法整体提取时间缩短,得率有一定提高;所提取的精油在成分上与我国云南产的肉豆蔻精油较接近,但是甲基丁香酚和榄香素的含量与其他产地和提取方法的肉豆蔻精油相比明显较高。
参考文献:
[1]贺志荣,宋继敏,赵三虎,等.肉豆蔻油提取工艺及其功能作用研究进展[J].中国调味品,2019,44(7):188-190.
[2]BARMAN R, BORA P K, SAIKIA J, et al.Nutmegs and wild nutmegs: an update on ethnomedicines, phytochemicals, pharmacology, and toxicity of the Myristicaceae species[J].Phytotherapy Research,2021,35(9):4632-4659.
[3]NIKOLIC V, NIKOLIC L, DINIC A, et al. Chemical composition, antioxidant and antimicrobial activity of nutmeg (Myristica fragrans Houtt.) seed essential oil[J].Journal of Essential Oil Bearing Plants,2021,24(2):218-227.
[4]张庆华,王志萍.中药挥发油提取技术研究进展[J].食品与药品,2009,11(3):62-64.
[5]杨柳,陈宇飞.肉豆蔻精油抑菌效果及其在发酵香肠中的应用[J].中国调味品,2014,39(12):37-40.
[6]付敏东,黄启,李成欢.肉豆蔻有效成分的提取及抗菌、 抗氧化性研究[J].中国药师,2012,15(1):50-53.
[7]李荣,孙健平,姜子涛.肉豆蔻精油抗氧化性能及清除自由基能力的研究[J].食品研究与开发,2009,30(11):75-80.
[8]高亚伟,罗君萍,盖旭,等.超声微波协同水蒸气蒸馏法提取肉豆蔻挥发油[J].食品安全导刊,2022(36):131-133,138.
[9]贺志荣,史晓耘,郝少楠,等.肉豆蔻主要功能成分提取研究进展[J].甘肃农业科技,2020(5):69-73.
[10]国家药典委员会.中华人民共和国药典四部(2020年版)[M].北京:中国医药科技出版社,2020:233.
[11]徐兴堂,张子东,王玉红.酶辅助水蒸气蒸馏法提取兴安落叶松针叶精油工艺[J].中国林副特产,2018(5):15-18.
[12]吕橄,陈斯婷,武广珩,等.酶辅助水蒸气蒸馏法提取蜜柚柚皮精油及其抑菌活性研究[J].广东化工,2019,46(23):17-19,33.
[13]周芳,朱亚伟,位翠杰.正交试验法从茶叶中提取咖啡因的工艺研究[J].安徽农业科学,2015(19):274-275.
[14]赵祥升,黄立标,陈宏降,等.肉豆蔻叶和种仁挥发油GC-MS分析[J].现代中药研究与实践,2012,26(3):69-72.
[15]林杰,卢金清,江汉美,等.春、冬季采收肉豆蔻中挥发性成分分析[J].中国调味品,2017,42(3):118-120.
[16]徐杨斌,王德懿,冒德寿,等.不同产地肉豆蔻油中挥发性成分的GC-TOF/MS分析[J].香料香精化妆品,2018(1): 31-36.
[17]DUPUY N, MOLINET J, MEHL F, et al. Chemometric analysis of mid infrared and gas chromatography data of Indonesian nutmeg essential oils[J].Industrial Crops & Products,2012,43:596-601.
[18]李力,潘倩雯,郭偲,等.不同方法提取肉豆蔻揮发油成分的气相色谱-质谱法分析[J].医药导报,2019,38(12):1630-1634.
[19]李荣,姜子涛.微波辅助水蒸气蒸馏调味香料肉豆蔻挥发油化学成分的研究[J].中国调味品,2011,36(3):102-104,108.

