胃类器官: 迟来者的崛起
杨佳晨,张宇航,胡 兵
杨佳晨,张宇航,胡兵,四川大学华西医院消化内科 四川省成都市 610041
0 引言
胃肠道类器官是指利用干细胞技术和组织工程技术,通过体外培养,构建出具有胃肠道器官结构和功能特征的三维细胞聚集体[1,2].相比传统二维细胞培养模型,类器官模型具有更多优势.类器官模型提供了三维细胞培养环境,更好地模拟了真实组织的结构和功能,充分模拟细胞在体内的自然排列和相互作用[3-5].此外,胃类器官能够长期维持,并具有自我更新的能力,使它们成为长期研究和重复实验的理想选择[6,7].
胃肠道类器官的研究始于2009年,Hans Clevers团队[3]利用成体干细胞(adult stem cells,AdSCs)培育出首个肠道类器官,他们将小鼠肠道的Lgr5+干细胞种植到细胞外基质中,并在含有特定成分的培养基中培养.干细胞经过增殖、扩张形成囊性结构,然后经过出芽、极化形成类似肠道管腔的三维细胞聚集体.这些细胞自我组织成隐窝与绒毛结构,前者大部分由肠干细胞构成,另有Paneth细胞和祖细胞;而后者则由肠细胞、杯状细胞和肠内分泌细胞等组成[3].这项研究是肠道干细胞研究的重要里程碑,开创了类器官研究的新时代.自2009年以来,类器官领域研究成果不断,许多新型类器官和更复杂的类器官不断涌现,不仅在动物模型上取得了重要进展,也在人类干细胞上实现了胃肠道类器官的构建.
在胃肠道类器官中,胃类器官相对于肠道类器官较晚出现,可能的原因是肠道细胞的自我更新和再生能力较强,这种高度的再生能力使得肠道在实验室条件下的培养相对胃容易一些.此外,胃类器官面临着更多的挑战和困难,主要源于其发育与分化过程的复杂性以及其结构、功能、疾病和癌变的多层次复杂性.胃类器官的研究相对较少,技术也较为困难.然而,胃类器官的应用前景十分广阔,不仅可以为胃的发育和分化机制提供新的视角,也可以为胃的感染和炎症、胃癌的发生和发展、药物的筛选和评价、胃组织的修复和移植等提供新的平台和方法.
本文旨在从胃类器官结构与功能特征、建模、应用、局限性和挑战等多个方面,对胃类器官的研究进展和前景进行综合概述,以期为未来该领域的深入研究和应用提供参考和启示.
1 胃类器官的建模挑战
1.1 胃及胃相关疾病的复杂性
1.1.1 胃的解剖结构和生理功能复杂: 胃自身结构的复杂性向类器官建模提出了较高要求,不仅要满足包含各种细胞成分,还要尽量满足体内胃黏膜的层次机构.胃的黏膜层分为三个部分: 上皮层、固有层和黏膜肌层.其中,上皮层由单层柱状上皮细胞构成,内含多种胃腺.这些腺体从底部到顶部分为四个不同区域: 底部、颈部、峡部和表面/小凹部[8].其中峡部区域含有增殖细胞,长期以来被认为是胃上皮干细胞的所在地[9].胃内不同细胞在功能和位置上各异[8],这对类器官模型的空间分布和功能模拟提出了挑战.
要满足长期建立胃类器官模型,需要有特定的胃干细胞持续不断地更新类器官内的各个细胞组分.这些干细胞具有自我更新和多向分化能力,主要分布在胃黏膜层,并因胃区域不同而存在差异,见表1.

表1 常见胃干细胞的分子标记物及其特点
胃的不同细胞类型之间存在着复杂的相互作用,这些交互对于维持整体胃功能至关重要.在类器官模型中模拟这些相互作用是一个挑战.此外,胃的微环境,包括pH值、酶活性和微生物群落,对维持胃的健康状态非常重要.在类器官模型中准确再现这些微环境条件是较为困难的.如何在体外构建出具有完整的胃结构和功能的类器官,是胃类器官建模的重要难题.
1.1.2 胃发育所需细胞成分与信号通路复杂: 胃黏膜中含有多种细胞类型,每种细胞都有其独特的功能和发育路径.如何在类器官模型中复制这种多样性是一个挑战.此外,胃细胞谱系寿命各异,如表面的黏液细胞寿命大约3 d-5 d,而主细胞则可存活数月[10].尽管胃上皮中含有干细胞和前体细胞以支持上皮更新,但是不同细胞标记的胃干细胞可能负责更新着不同类型的细胞系,这增加了类器官体外培养的不确定性.
胃的发育过程中还需要所有三个胚层的贡献.上皮细胞来自内胚层,平滑肌和血管细胞来自中胚层,而肠神经元和神经胶质细胞来自外胚层[11].所有这些细胞类型之间的通信对于胃功能的协调至关重要[12].此外,胃上皮与其下层间质之间的相互作用始于器官发育的早期阶段,与形态发生因子,如无翅膀型白血病毒整合位点家族(wingless-type MMTV integration site family,WNTs)、骨形成蛋白(bone morphogenetic protein,BMP)、索尼克刺猬(sonic hedgehog,SHH)[13,14]共同建立了上皮和间质区域化[11].
胃是由前肠内胚层分化而来的,其发育受到多种信号分子和转录因子的调控,在胃的不同区域和不同阶段发挥着不同的作用,决定了胃的形态发生和组织分化[13-16].如何在体外模拟这些信号分子和转录因子的时空表达,并诱导不同区域和类型细胞的分化,是胃类器官建模的重要难题.
1.2 胃类器官建模与优化的手段
1.2.1 利用干细胞技术培养: 胃类器官的建立可以从胃组织衍生的AdSCs以及多能干细胞(pluripotent stem cells,PSCs)出发.AdSCs只能生成特定细胞类型,而PSCs具有分化为任何细胞类型的能力[1].在胃上皮中,富含亮氨酸重复的G蛋白偶联受体5(leucine-rich repeat-containing G protein-coupled receptor 5,Lgr5)+干细胞位于幽门腺底部,负责组织自我更新,能够长期产生类器官,也可以从PSCs生成[6,17,18].另外,Troy+细胞是小鼠胃体中的一种PSCs类型,可用于长期建立胃类器官模型[7,19].
首个AdSCs衍生的胃类器官小鼠模型建立于含Lgr5+干细胞的胃腺体,通过在肠道类器官培养系统的基础上添加成纤维细胞生长因子(fibroblast growth factor,FGF)和胃泌素发展而来的[6].Bartfeld等[5]从胃的黏膜层分离出胃干细胞,通过体外培养形成具有胃特征的细胞团,并建立了一种可以无限期扩展人类胃细胞的三维培养系统,并分别培养了来自健康胃组织、单个分选干细胞或肿瘤组织的细胞.
McCracken等[17,20]描述了首个将人类PSCs分化为胃类器官的方案.此方案将人类PSCs首先激活Nodal/转化生长因子-β(Transforming Growth Factor-beta,TGF-β)信号通路进而分化为内胚层,再通过刺激WNT通路激活性别决定区Y-盒2(sex-determining region Y-box 2,SOX2)表达并抑制尾部型同源盒2(caudal type homeobox 2,CDX2)表达,形成前肠.最终,通过添加视黄酸和表皮生长因子(epidermal growth factor,EGF),完成胃腺的分化[17,21].
1.2.2 优化培养条件和基质: 胃类器官的培养条件和基质对其形成和发育至关重要.通过优化这些条件,可以提升胃类器官的形成效率和质量.
改变生长因子组合可诱导胃类器官的增殖或分化,使其更贴近原生胃组织的结构和功能.例如,Bartfeld等[5]发现添加烟酰胺和撤除WNT,有助于胃类器官分化成熟.而高浓度(100 ng/mL)EGF可促进胃窦类器官生长[22].添加Rho激酶抑制剂Y-27632和GSK3b激酶抑制剂,可增强类器官的培养和传代[23,24],或是添加A83-01抑制TGF-β信号通路实现长期生长[5].
培养基的组成对类器官的形态、转录组特征和对化疗及靶向治疗的敏感性有显著影响.Hogenson等[25]发现用不含血清培养基比用含有WNT3a、R-spondin和Noggin的培养基培养的患者衍生的类器官(patientderived oragnoids,PDOs)对靶向药物治疗的反应敏感.对此提出培养基的组成是预测供体肿瘤治疗反应的关键变量.
类器官的结构和行为同时也受基质组成的影响.通过改变培养基质的材料,使用天然或合成材料作为培养基质,如含有层黏蛋白、致密蛋白、蛋白聚糖和胶原Ⅳ等的Matrigel,可提供更好的支撑和营养,使类器官更接近原生胃组织[23,24].此外,微流体技术可促进器官组织的共培养,以模拟复杂的微环境[23,26].
因此,优化培养条件与基质可以改善胃类器官的生长、存活和分化行为.未来的研究应着重系统研究不同生长因子、细胞外基质和培养基组成对胃类器官的生长、功能和疾病建模能力的影响.
2 胃类器官的表型特征与分子特征
2.1 胃类器官的表型特征 胃类器官的表型特征包括其在显微镜或肉眼下的形状、大小和颜色等外观特征.这些特征与原生胃组织相似,但也存在差异[27,28].胃类器官具有腺体结构和腔隙的形成,其大小和形状会根据培养条件和基质变化,通常为球形或椭圆形,直径几百微米至几毫米,有时形成分支状结构.其表面覆盖单层柱状上皮细胞,内含多种腺体细胞,可分化为胃底或胃窦特征细胞[28,29].胃类器官外层有一层由基底膜和细胞外基质组成的浆膜层,与培养基相接触[28].此外,Bartfeld等[5]通过改变培养基成分,观察到胃类器官可形成芽生结构与大囊等显微结构,见表2.

表2 胃类器官的显微结构
2.2 胃类器官的分子学特征 胃类器官的分子学特征是指其在基因、蛋白质或代谢物等水平上,所表达或产生的分子的种类、数量、活性等特征.
胃类器官可表达与胃的发育和分化以及与胃的功能相关的基因和蛋白质.例如,胃类器官中表达了与胃的形态发生和组织分化相关的信号分子和转录因子,如WNT、BMP、SHH、SOX2、Barx1、CDX2等[13-16].胃类器官中也表达了与胃的分泌功能相关的细胞标志物和酶,如胃泌素、胃蛋白酶原等.
胃类器官表达多种细胞标记物见表3,例如Lgr5,这是一种WNT靶基因和R-spondin受体,其标志着胃腺底部的细胞,这些细胞可产生各种类型的胃上皮细胞[5,6,30,31].目前,不同干细胞群体之间的(可能是层级性的)关系尚不清楚[32].此外,成熟分化的细胞表达特异的胃分化标志物表明了胃类器官的功能成熟和多样性,如粘蛋白(Muc5ac、Muc6)、胃蛋白酶原C(Pepsinogen C,PGC)、胃内因子(gastric intrinsic factor,GIF)、胆囊收缩素B受体(cholecystokinin B receptor,Cckbr)和生长激素释放肽(ghrelin,Ghrl),这些标志物对应胃的不同细胞类型[5,21].在病理情况下,胃类器官可表达幽门螺杆菌(Helicobacter pylori,H.pylori)感染、炎症和癌症相关的标志物,如细胞毒素相关基因A蛋白(cytotoxin-associated gene A,CagA)、白细胞介素-8(interleukin-8,IL-8) 和肿瘤蛋白53(tumor protein 53,p53)[30,33].

表3 胃类器官的常见标记物及其意义
3 胃类器官的应用
胃类器官的应用领域十分广泛,包括胃的发育和分化机制的研究、胃的感染和炎症的研究、胃癌的发生和发展的研究、药物筛选和评价的研究、再生医学和个性化治疗的研究等.
3.1 胃的发育和分化机制的研究 胃从胚胎期到成体期,经历的形态发生和组织分化的过程,以及其背后的分子和细胞的调控.胃的发育和分化机制是胃的基本生物学问题,也是胃的疾病和癌变的重要基础.胃类器官可以为胃的发育和分化机制的研究提供新的视角和方法,不仅可以模拟胃的发育和分化的过程,也可以探索胃的发育和分化的规律和原理.胃类器官,揭示了胃的形态发生和组织分化的信号通路,即确定性内胚层形成、后前肠区域化、胃特化和模式形成,以及上皮生长和分化[17,22],见表4.
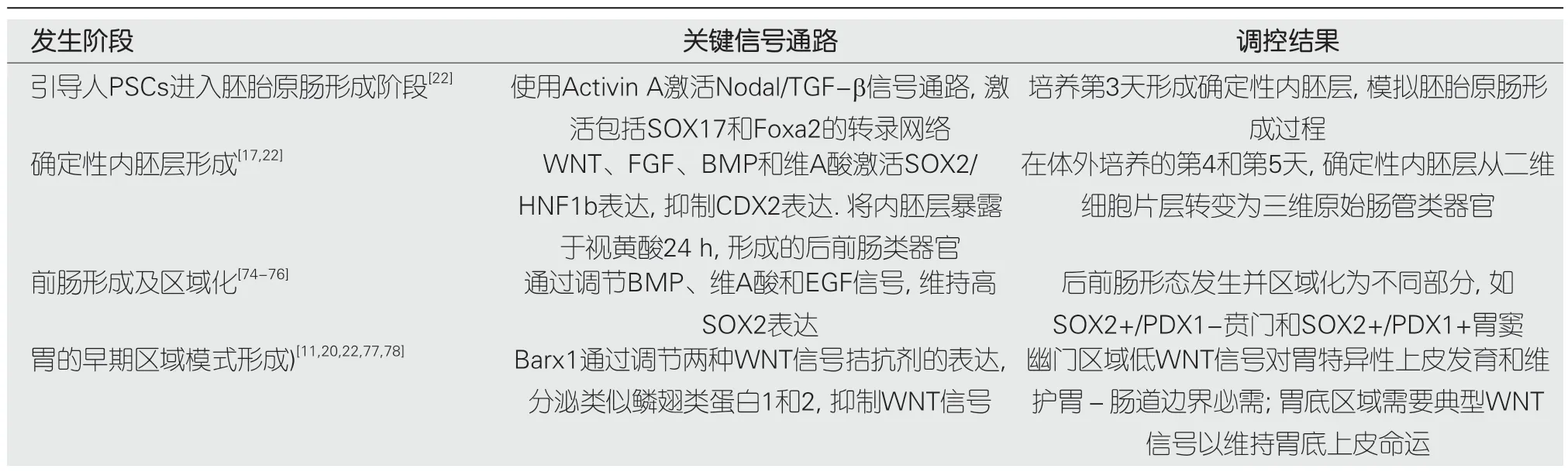
表4 胃的形态发生和组织分化的信号通路调控
研究发现,这些信号通路在胃的不同区域和不同阶段发挥着不同的作用,决定了胃的形态发生和组织分化.这些信号通路之间存在着复杂的相互作用和反馈调节,维持了胃的发育和分化的平衡和稳定.这些研究为胃的发育和分化机制提供了新的认识和证据,也为胃的疾病和癌变的预防和治疗提供了新的靶点和策略.
3.2 胃的感染和炎症的研究 胃类器官为研究胃的感染和炎症提供了一个新的模型系统.类器官被视为感染研究的新工具,尤其在研究H.pylori感染相关的现象时具有多种优势.

表5 胃类器官重现H.pylori感染特征
胃类器官可以由AdSCs以及PSCs生成胃中的所有主要细胞类型,这种多样性使研究者能够更全面地研究H.pylori感染对不同细胞类型的影响[6,17].类器官模型提供了一个接近体内环境的研究平台,可以更准确地模拟病原体与宿主相互作用的复杂性,对于理解病原体如何影响胃组织和引起疾病至关重要[5].
胃类器官作为模拟胃部感染和炎症的先进模型,已成功再现H.pylori感染的关键特征,如细菌的附着、核因子-κB(nuclear factor-κB,NF-κB)激活、CagA与酪氨酸激酶受体c-MET相互作用,以及宿主细胞增殖的增加、炎症反应等,见表5.不同于传统的癌细胞系,类器官模型展现了H.pylori在保护性黏液层中的繁殖过程[34,35].该模型中黏液层通常覆盖着上皮细胞的顶部并指向器官内部[36],更贴近体内实际环境.Bartfeld等[5]通过微注射技术将H.pylori注入类器官,模拟自然感染,发现类器官中的H.pylori感染激活了NF-κB和IL-8的表达,与传统癌细胞系模型不同,这一表达不依赖于H.pylori的特定毒力因子cagPAI[37,38].同时,他们观察到,靠近腺体表面的细胞对感染的反应更为强烈,这可能是黏液屏障的效果,这是以前的体外2D模型无法实现的.此外,人类胃类器官中也观察到了细菌的CagA蛋白与宿主细胞表面的c-MET受体的相互作用[17,39],发现CagA能促进细胞增殖,这一过程似乎与c-MET的激活有关,而非细胞损失的补偿,因为细胞凋亡水平未发生变化[34].
胃类器官为研究胃的感染和炎症提供了一个更接近于体内的模型,可以揭示H.pylori的致病机制和耐药性的分子基础,为开发新的治疗策略和预防措施提供了新的思路和方法.
3.3 胃癌的发生和发展的研究 胃癌类器官模型为研究胃癌提供了一个接近体内的新系统.它们模拟了组织的结构和功能,保持了肿瘤细胞的特性,优于传统模型[40].此外,类器官可以进行遗传编辑(如使用CRISPR/Cas9)和组学分析,以生成或修正致病基因[41-43].通过使用这些细胞系,科学家们可以生成病变的、经过基因校正的类器官组织,从而对人类疾病的机制进行前所未有的研究[44].
PDOs在遗传和表观遗传分析方面尤其有效.高通量测序技术使得研究人员能够对肿瘤的DNA序列、RNA表达模式以及DNA甲基化等表观遗传改变进行全面分析.在胃癌PDOs中观察到的突变模式与癌症基因组图谱中描述的胃癌亚型相符合.这表明PDOs能够准确反映胃癌的不同分子亚型[45].
胃癌类器官展示了不同的生长模式与形态表型,包括具有或不具有增厚(多层)壁、非连贯的葡萄状生长模式,以及紧凑的细胞团块没有腔室的结构[46].Nanki和Yan的研究将这些不同的形态分为三种亚型,并将它们与Lauren分类相关联[41,47,48],见表6.Nanki等[41]通过CDH1基因敲除,诱导类器官从正常的囊性结构变为具有强烈迁移活性的实体结构,展示了表型与基因型之间的联系.此外,他们发现KRAS基因的突变和RTK的扩增导致PDOs获得了对EGF和FGF的独立性[41],表明它们可能通过内源性机制激活了相关的信号通路.

表6 胃类器官的形态亚型与Lauren分类
胃癌类器官模型的建立可来自PSCs和AdSCs衍生,也可来自PDOs.这些胃癌类器官的培养方案基于正常胃组织类器官基础之上[5].PDO可从外科切除标本以及内镜、超声和CT引导的活检或腹水穿刺中获得了组织样本,进而建立胃癌类器官生物库,进一步分析原发癌内的亚克隆类型[41,46,48,49].此外,胃癌类器官作为患者肿瘤的替代品,个别癌症类器官可以用来预测对特定药物的治疗反应.同时,PDO生物库与药物筛选的结合,将增加研究人员对患者间和患者内异质性的了解,有望为各种疾病的个性化治疗带来希望.
胃类器官可以揭示胃癌的分子分型、肿瘤干细胞和肿瘤微环境的特征和作用.类器官技术使得可以建立患者衍生的类器官集合,进行遗传操作和各种组学研究,为个体化治疗测试和深入分析病理生物学提供了前所未有的新可能性.特别是借助类器官生物库,可以进行高通量药物筛选,以识别新的治疗选择[50].
3.4 药物筛选和个性化治疗 胃类器官模型为药物筛选和评价提供了一种新方法,特别是对于胃病和胃癌的新药研发和测试.这种模型可以用来检测不同药物对胃病和胃癌的治疗效果、作用机制和副作用,提供了一种高通量的药物测试方式[51].
胃类器官还能测试药物对不同类型和阶段胃病和胃癌的治疗效果.通过胃癌PDOs进行化疗药物测试,发现不同PDO对药物的反应不同,类似于患者的临床反应[46,48],这对个性化治疗非常有价值.此外,PDOs也被用于筛选新的治疗目标[52].胃癌PDOs已经被用于这样的筛选,结果显示不同PDO线之间的反应模式存在显著差异[48,49].这意味着即使是同一类型的胃癌,不同患者的肿瘤也可能对相同的药物表现出不同的反应.这种差异性强调了个体化治疗的重要性,即针对每个患者的独特肿瘤特征选择最合适的治疗方案.
除了传统化疗药物和耗时耗资的药物筛选外,个别PDOs还可以用针对在测序数据中识别出的分子改变的靶向药物进行治疗.例如,测序发现携带ERBB2扩增的胃癌PDO,对曲妥珠单抗有反应[53].相应地,胃癌PDO线以及突变的PDO对曲妥珠单抗有反应[46].同样,AKT1基因突变的PDO对AKT抑制剂敏感[49],而CDKN2A基因改变的PDO对CDK4/6抑制剂敏感[46,48].
胃类器官为研究药物筛选和评价提供了一个更接近于体内的模型,可以揭示药物对胃病和胃癌的治疗效果和作用机制,能够在临床试验之前提供关于药物效果的重要信息,从而有助于指导个性化治疗策略.
3.5 再生医学的研究 胃类器官模型为胃组织修复和移植提供了新的研究方法.这些技术依赖于移植外源性胃细胞或组织,并着重于最小化植入后的免疫反应[54],但供体稀缺性、兼容性和排斥问题仍是挑战.
将胃类器官用于再生医学组织工程领域的一种方法是将类器官技术与工程化的培养方法相结合,使用三维支架来复制胃的结构和功能[55].Maemura等[56]使用了由上皮器官单位种植在可降解支架腔室内的胃补片支架.该支架在移植后能与宿主组织融合并重建上皮和肌肉层.另一种方法是通过将类器官植入体内促使其成熟为功能性胃肠道,包括使用合成支架仿生胃肠道,以及利用胃肠道黏膜下组织作为支架的直接类器官移植[55].这种方法优势是在体内将器官组织培育得更大[57].Speer等[58]使用聚乙醇酸合成支架进行组织工程,种植的类器官单位能在腹腔内形成类似原生胃的完全分化上皮和肌肉层.
用再生医学来补偿切除后的缺损,使用患者自己的再生组织来补偿丢失的功能和组织将是理想的治疗方法[59].虽然完整人造器官的培养尚未成功,但在胃类器官功能性方面已有进展.Schumacher等[19]首次展示了胃类器官的功能性,他们建立了人类胃底部来源的类器官,其表达了壁细胞的特异性标记物(H+K+-ATP酶),并用组胺和奥美拉唑进行干预,成功复现了壁细胞的功能活性.
胃类器官可以揭示胃类器官对胃组织的修复和移植效果和作用机制,为开发新的胃组织再生和移植技术和优化胃组织修复和移植方案提供了新的思路和方法.类器官技术在再生医学中的应用不仅用于恢复组织结构功能,也可用于细胞替代疗法[55].
4 胃类器官局限性与挑战
虽然胃类器官在生物医学领域具有广阔的应用前景,但是它们也面临着一些局限性和挑战,需要进一步的研究和改进.
4.1 胃类器官的多样性、异质性和可重复性的保证 胃类器官一般是通过人工诱导和操纵而形成,而原代胃组织是通过自然发育和分化而形成[17,22].这些差异可能会影响胃类器官的稳定性、可重复性和可预测性等.胃类器官的遗传和表观遗传与原代胃组织不同,胃类器官一般是由单一或少数的胃干细胞或PSCs衍生而来,而原代胃组织是由多种来源和类型的细胞组成[17,22].这些差异可能会影响胃类器官的多样性、异质性和适应性等.
目前,胃类器官的多样性、异质性和可重复性还存在一定的差距和不足.一方面,胃类器官的构建方法和培养条件还不够优化和标准化,导致胃类器官的形成效率和质量不稳定,有时会出现胃类器官的缺陷、变异、退化等现象[5].另一方面,胃类器官的表征和评价方法还不够完善和统一,导致胃类器官的结构和功能特征的测量存在一定的主观性和不确定性.
为了改善胃类器官的多样性、异质性和可重复性,可能需要从以下几个方面进行努力: (1)优化胃类器官的构建方法和培养条件.例如,探索不同的胃干细胞或PSC的来源和分化诱导因子,优化胃类器官的培养基和基质,调节胃类器官的生长因子和激素,模拟胃类器官的机械、化学刺激与微环境等,采用新型的微流体技术、共培养技术、类器官芯片技术等[60-62];(2)完善胃类器官的表征和评价方法,提高胃类器官的结构和功能特征的测量的准确性和客观性;(3)推进胃类器官的标准化、规范化和商业化,提高胃类器官的可用性和普及性.
4.2 胃类器官的血管化、神经化和免疫化的实现 胃类器官一般缺乏足够的血管、神经和免疫细胞,而原代胃组织具有丰富的血管、神经和免疫系统.这些差异可能会影响胃类器官的营养供应、信号传递、感染防御和炎症反应等 .
为了实现胃类器官的血管化、神经化和免疫化,需要探索构建方法和培养条件.例如,利用血管内皮细胞、平滑肌细胞、神经细胞、免疫细胞等不同来源和类型的细胞,与胃类器官的胃干细胞或PSC进行共培养,促进胃类器官的血管化、神经化和免疫化的分化和发育[63,64];利用微流控芯片、生物打印、生物反应器等不同的技术和设备调节胃类器官的血流、氧气、营养、激素、神经递质、炎症因子等的供应和消耗,模拟胃类器官的生理和病理环境,增强胃类器官的功能和稳定性[60,62].
5 结论
胃类器官是一种新兴的生物医学研究工具,它能够模拟胃的结构和功能,为胃的发育和分化机制、胃的感染和炎症、胃癌的发生和发展、药物筛选和评价、再生医学和个性化治疗等提供了一个有效的平台.胃类器官的崛起,为胃肠道类器官的研究和应用带来了新的机遇和挑战,也为生物医学领域的进步和创新做出了贡献.我们期待着胃类器官的进一步发展和完善,以及胃类器官与其他消化道类器官的整合和协调,为人类的健康和福祉服务.

