枇杷叶三萜酸联合重组人表皮生长因子对激素依赖性皮炎豚鼠皮肤屏障功能的修复及免疫失衡的影响
姚莹,张杰
(河南科技大学第二附属医院,河南 洛阳 471000)
激素依赖性皮炎(Hormonedependencedermatitis,HDD)指长期使用含有糖皮质激素的药物后,一旦停用病情会复发或加重的皮肤炎性反应,主要表现为毛细血管扩张、红斑、痤疮、脱屑和烧灼感等,使患者的身体和心理受到双重损害[1]。我国化妆品皮肤病中青年女性约占95%,其中21~40 岁为高发年龄,面部HDD 约占整个化妆品皮肤病患者的20%[2]。HDD 具体发病机制尚不清楚,可能与炎性细胞因子活化、机体免疫功能失衡、皮肤屏障受损、微生物感染、代谢物堆积和轴突反射有关。临床上多以抗炎、修复皮肤屏障、抗微生物及心理干预等治疗为主,但治疗周期相对较长,容易产生药物依赖性,且治疗后容易复发,彻底治愈比较困难[3]。因此,探讨周期短、不良反应小、安全性高的联合治疗方法是临床关注的重要话题。重组人表皮生长因子(Recombinant human-epidermal growth factor,rh-EGF)有促进外胚层和内胚层各种细胞增殖迁移的作用,临床常用于修复创伤及各类皮肤炎性反应[4]。枇杷叶三萜酸(TAL)类化合物是枇杷叶的主要活性成分之一,有明显的抗菌消炎和免疫调节药理功能[5]。本实验通过建立豚鼠HDD 模型,探讨TAL 和rh-EGF联合用药对皮肤屏障功能及免疫功能的改善效果,旨在为临床治疗提供实验参考。
1 材料与方法
1.1 实验材料
1.1.1 动物 40 只无特定病原(SPF)级豚鼠,雌雄各半,2~3 个月龄,体质量270~350 g,购自吉林特研生物技术有限责任公司,许可证号:SCXK(吉)2019-0010。环境温度:20~24 ℃,湿度40%~60%。分笼饲养,定期清洁鼠笼,每日1 次,定期补充维生素C 预防足部溃疡。
1.1.2 试剂与仪器 TAL 粉末(纯度≥98%,安徽省安泰医药生物技术有限责任公司)、rh-EGF 凝胶(杭州纽龙生物科技有限公司)、卤米松乳膏(重庆华邦制药股份有限公司)、豚鼠免疫球蛋白E(IgE)酶联免疫吸附测定(ELISA)法检测试剂盒(北京杰辉博高生物技术有限公司,货号:15596018)、SOFT1160 型多功能皮肤生理参数检测仪(美国安捷伦科技有限公司)、石蜡包埋机(德国莱卡公司)、USorvall ST40R 台式高速离心机(美国赛默飞世尔科技公司)。
1.2 实验方法
1.2.1 HDD 豚鼠模型建立 所有豚鼠适应性喂养7 d,按体质量排序编号,利用计算机生成随机数分为:对照组、模型组、rh-EGF 组、TAL 组和联合组,每组8 只。除对照组外,其余各组参与HDD 模型建立:每只豚鼠背部左右两侧选取3 cm×3 cm 大小的区域,剔除毛发,用0.05%卤米松乳膏外用涂抹,按摩1~2 min,各组给药每日2 次,连续45 d[6]。制模过程中每日观察豚鼠皮肤组织变化,药物停用3 d 后,制模区皮肤出现红斑、肿胀、结痂等炎性反应,表明制模成功[7]。对照组常规饲养,剔除3 cm×3 cm 毛发,不做其他处理。
1.2.2 分组及给药 制模成功后7 d,对照组和模型组用0.9%氯化钠溶液涂抹处理,rh-EGF 组在皮损处均匀涂抹薄层rh-EGF 凝胶;TAL 组涂抹TAL溶液,参照文献[8]用量,按450 mg/kg 体质量,将TAL 用2 mL 0.9%氯化钠溶液稀释后均匀涂抹于皮损处;联合组涂抹rh-EGF 凝胶,晾干后,再涂抹TAL 溶液。每日涂抹2 次,连续15 d[9]。自给药开始,每天观察并记录实验豚鼠背部激发部位皮肤变化情况。
1.2.3 皮肤炎性程度评分 每日观察并记录豚鼠背部皮肤变化,参照文献[10]方法对各组豚鼠皮肤组织进行评分。根据皮损处水肿、红斑和毛细血管扩张的严重程度评分:0 分为无症状;1 分为轻微;2分为中度;3 分为严重。评分越高表明皮肤组织病变程度越严重,详细评定标准见表1。
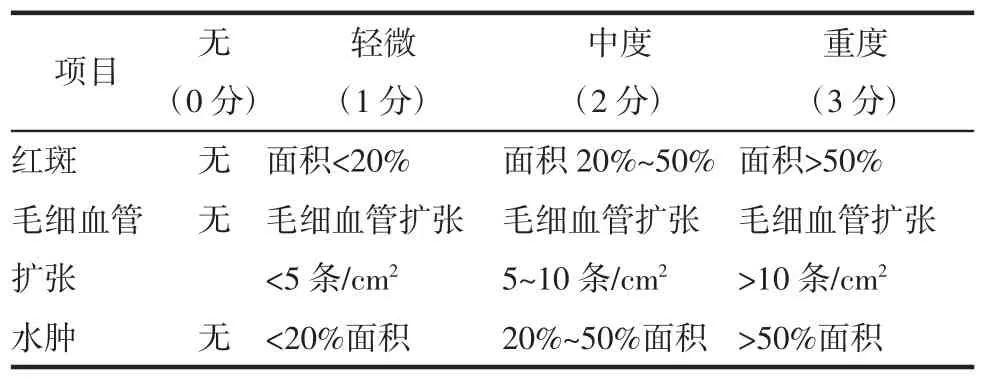
表1 评分指标与评分标准
1.2.4 皮肤屏障功能测定 使用SOFT1160 型多功能皮肤生理参数检测仪检测皮肤屏障功能指标:包括经皮水分丢失(Transepidermal waterloss,TEWL)、角质层含水量(Water content of the stratum corneum,WCSC)和皮脂量(Sebum content,SC)。室温24 ℃、湿度60%,对豚鼠背部用药处皮肤进行测量,测试过程中尽量保持测试探头的垂直稳定。
1.2.5 皮肤组织病理学观察 麻醉豚鼠,分别取背部用药区左侧1 cm×1 cm 皮肤,置于4%多聚甲醛固定液中,经脱水、石蜡包埋,切片约4 μm 厚度,脱蜡、水化后,HE 染色,中性树胶封片,光学显微镜下观察皮肤各层细胞及附件的变化情况。
1.2.6 血清IgE、IL-4 及IFN-γ 含量检测 末次涂药结束24 h 后,选取豚鼠尾部采血3 mL,离心半径为12 cm,4 500 r/min 离心20 min,取上清液体,保存于-80 ℃冰箱,用ELISA 法检测总IgE、白细胞介素-4(IL-4)及干扰素-γ(IFN-γ)。
1.3 统计学分析 采用SPSS 24.0 统计软件进行数据分析,符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较用LSD-t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 皮肤炎性损伤程度比较 对照组豚鼠皮肤状态良好,未出现水肿、红斑及结痂等症状;模型组背部皮肤可见明显红斑、水肿及脱屑等,实验结束后症状未见消退。rh-EGF 组和TAL 组从涂药第9 天开始,红斑、水肿逐渐消退明显,实验结束后症状轻微。联合组从第6 天开始皮损症状逐渐明显减轻,至实验结束时发炎处已基本痊愈。
与模型组比较,rh-EGF 组、TAL 组和联合组第6、9、12、15 天皮肤组织炎性损伤程度评分降低(P<0.05)。与rh-EGF 组和TAL 组比较,联合组第9、12、15 天皮肤组织炎性损伤程度评分均降低(P<0.05)。rh-EGF 组与TAL 组各时间皮肤组织炎性损伤程度评分比较,差异无统计学意义(P>0.05)。见表2。
表2 各组皮肤组织炎性损伤程度评分比较 (分,±s)
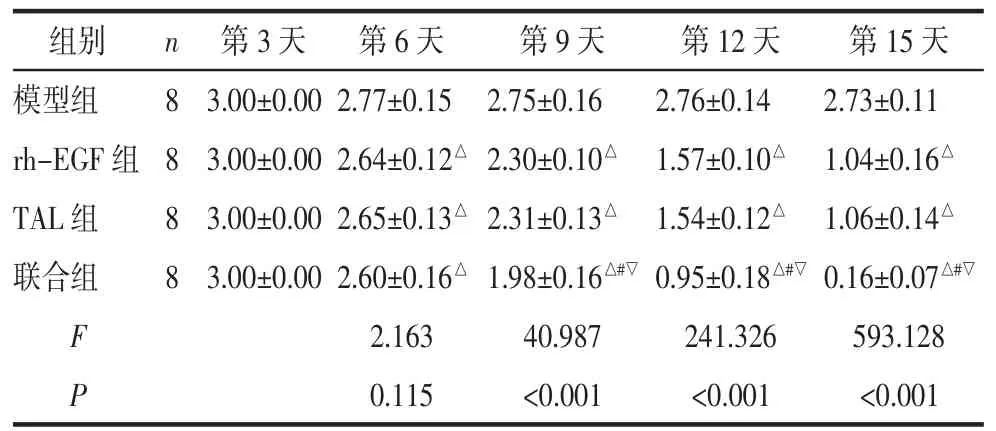
表2 各组皮肤组织炎性损伤程度评分比较 (分,±s)
注:与模型组比较,△P<0.05;与rh-EGF 组比较,#P<0.05;与TAL组比较,▽P<0.05。
组别模型组rh-EGF 组TAL 组联合组n 8 8 8 8 F P第3 天第6 天第9 天第12 天第15 天3.00±0.00 2.77±0.15 2.75±0.162.76±0.142.73±0.11 3.00±0.00 2.64±0.12△2.30±0.10△ 1.57±0.10△ 1.04±0.16△3.00±0.00 2.65±0.13△2.31±0.13△ 1.54±0.12△ 1.06±0.14△3.00±0.00 2.60±0.16△1.98±0.16△#▽0.95±0.18△#▽0.16±0.07△#▽2.16340.987241.326593.128 0.115<0.001<0.001<0.001
2.2 皮肤屏障功能比较 与对照组比较,模型组TEWL 增加,WCSC 和SC 减少(P<0.05)。与模型组比较,rh-EGF 组、TAL 组和联合组TEWL 减少,WCSC 和SC 增加(P<0.05)。与rh-EGF 组和TAL 组比较,联合组TEWL 减少、WCSC 和SC 增加(P<0.05)。rh-EGF 组与TAL 组TEWL、WCSC 和SC 比较,差异无统计学意义(P>0.05)。见表3。
表3 各组皮肤屏障功能指标比较(±s)

表3 各组皮肤屏障功能指标比较(±s)
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05;与rh-EGF组比较,#P<0.05;与TAL 组比较,▽P<0.05。
组别对照组模型组rh-EGF 组TAL 组联合组n 8 8 8 8 8 F P TWEL[g/(h·m2)]WCSC(U)SC(U)15.24±2.0450.59±3.1038.81±1.98 32.83±3.65*22.19±1.79*16.40±1.55*25.52±1.66*△32.34±2.73*△28.28±1.77*△26.35±2.13*△31.27±2.84*△30.03±1.86*△17.31±1.61*△#▽ 45.10±2.51*△#▽ 36.54±1.49*△#▽75.189150.643203.697<0.001<0.001<0.001
2.3 皮肤组织病理学观察 对照组皮肤组织结构完整清晰,真皮层胶原纤维排列致密,复层扁平上皮层较薄,角化层明显,染色均一。模型组皮肤组织病变明显,表皮明显增厚,细胞层数减少,排列紊乱,角质层上皮细胞角化不全或角化过度,真皮层胶原纤维数量减少,排列紊乱。rh-EGF 组、TAL 组和联合组表皮结构较紊乱,表皮角质层改善,棘层增生情况好转,真皮层成纤维细胞增多,真皮网状层胶原纤维数量恢复,细胞排列整齐致密,基本恢复正常。其中联合组较rh-EGF 组、TAL 组改善更明显。见图1。
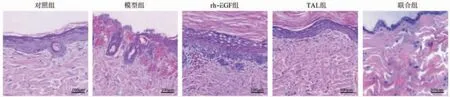
图1 各组大鼠皮肤组织病理学表现(HE 染色×100)
2.4 免疫因子水平比较 与对照组比较,模型组豚鼠IgE 和IL-4 水平升高,IFN-γ 水平降低(P<0.05)。与模型组比较,rh-EGF 组、TAL 组和联合组豚鼠IgE 和IL-4 水平降低、IFN-γ 水平升高(P<0.05)。与rh-EGF 组和TAL 组比较,联合组豚鼠IgE 和IL-4水平降低、IFN-γ 水平升高(P<0.05)。rh-EGF 组与TAL 组IgE、IL-4 和IFN-γ 比较,差异无统计学意义(P>0.05)。见表4。
表4 各组免疫因子IgE、IL-4 和IFN-γ(±s)
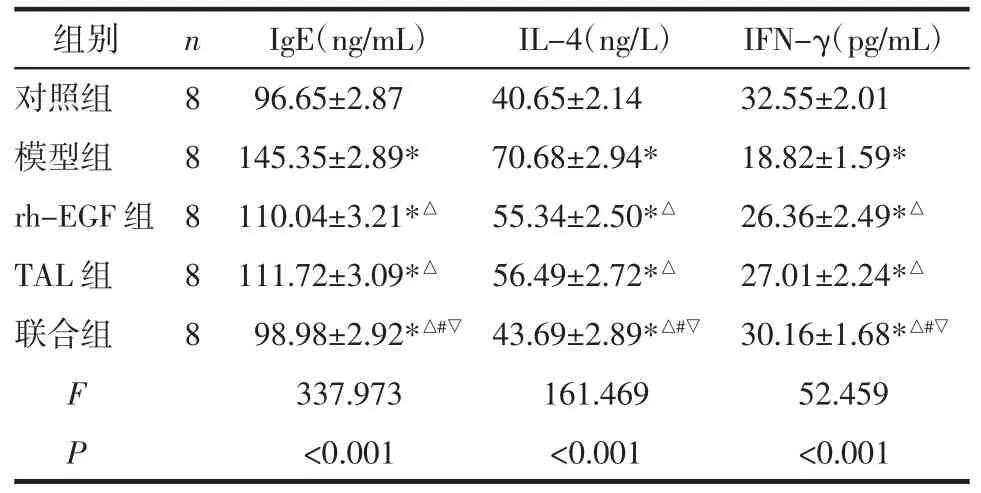
表4 各组免疫因子IgE、IL-4 和IFN-γ(±s)
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05;与rh-EGF组比较,#P<0.05;与TAL 组比较,▽P<0.05。
组别对照组模型组rh-EGF 组TAL 组联合组n 8 8 8 8 8 F P IgE(ng/mL)IL-4(ng/L)IFN-γ(pg/mL)96.65±2.8740.65±2.1432.55±2.01 145.35±2.89*70.68±2.94*18.82±1.59*110.04±3.21*△55.34±2.50*△26.36±2.49*△111.72±3.09*△56.49±2.72*△27.01±2.24*△98.98±2.92*△#▽ 43.69±2.89*△#▽ 30.16±1.68*△#▽337.973161.46952.459<0.001<0.001<0.001
3 讨论
本实验豚鼠皮肤炎性观察可以看出,模型构建成功后,豚鼠皮肤出现水肿、红斑、毛细血管扩张,结痂和脱屑等症状,各治疗组用药后症状逐渐恢复。豚鼠皮肤病理学观察也可以看出,构建的豚鼠模型,皮肤表皮受损严重,出现细胞排列紊乱、坏死等症状,各治疗组用药后细胞状态逐渐恢复,且联合组与单用rh-EGF 和TAL 比较,见效早、恢复更好,表明TAL 联合rh-EGF 可减轻HDD 临床症状,且比单独使用rh-EGF 和TAL 效果更好。
皮肤屏障的检测中,TEWL 是指水从真皮和表皮通过角质层扩散到皮肤表面的通量密度,即皮肤表面的水蒸气压梯度来表明水分散失情况。皮肤屏障功能的优劣与代表角质层水分流失量的TEWL呈负相关关系,当屏障受损时,TEWL 值增高[11]。皮肤屏障功能与WCSC 和SC 成正比,WCSC 和SC 越多说明皮肤屏障功能越好。与对照组比较,模型组TEWL 增加,WCSC 与SC 减少,说明皮肤屏障功能受损;与模型组比较,rh-EGF、TAL 单独及联合用药治疗后,TEWL 减少,WCSC 与SC 增加,说明rh-EGF 和TAL 均对皮肤屏障功能有修复作用,且二者联合用药后对皮损的改善更显著,说明TAL 联合rh-EGF 能够起到皮肤屏障修复作用,且比rh-EGF、TAL 单独使用效果更好。
当免疫因子失衡时,就会导致机体免疫系统紊乱,引起自身免疫性疾病的发生。IgE 是一类免疫球蛋白,可通过结合肥大细胞和嗜碱粒细胞,进而共同诱发Ⅰ型超敏反应,其含量高低与过敏性疾病发生发展密切相关[12]。IL-4 是一种经典的Th2 型细胞因子,可刺激活化B 细胞和T 细胞增殖、诱导B 细胞产生IgE,引起过敏反应,在人体免疫调节过程中发挥重要作用[13]。IFN-γ 由Th1 细胞分泌,能明显减少IgE 的合成和发展,从而抑制超敏反应,IFN-γ 水平与病情严重程度呈负相关[14]。临床研究表明,在激素依赖性皮炎中存在免疫失衡现象,患者IgE、IL-4水平较高,IFN-γ 水平较低,经治疗后,IgE、IL-4 水平逐渐降低,而IFN-γ 水平逐渐升高[15]。本研究结果显示,与对照组比较,模型组IgE 和IL-4 水平显著升高,IFN-γ 水平显著降低,提示模型豚鼠发生免疫失衡;与模型组比较,rh-EGF 组、TAL 组和联合组IgE 和IL-4 水平显著降低,IFN-γ 水平升高,且联合组效果更加显著,说明TAL 联合rh-EGF 治疗能够调节皮肤免疫因子,抑制豚鼠皮肤炎性反应,较rh-EGF、TAL 单独使用效果更佳。
本次实验验证TAL 联合rh-EGF 对于治疗HDD 有显著的改善作用,可能与TAL 的抗炎、抑菌、抗氧化及免疫调节作用有关[16-17]。郭磊等[8]研究枇杷叶三萜酸对慢性支气管炎大鼠的作用效果,猜测其作用机制可能与降低炎性细胞因子表达、减轻机体氧化损伤有关。Jian 等[5]报告,TAL 可通过调节相关信号通路,抑制炎性反应,减轻氧化应激,改善慢性阻塞性肺病小鼠肺组织损伤。本研究结果显示,TAL 联合rh-EGF 可以改善HDD 豚鼠的临床症状及体征,还能够改善豚鼠皮肤屏障功能及免疫功能,且改善效果较单独使用rh-EGF 的效果好,可为临床HDD 的治疗提供新的思路和理论依据。

