基于POE教学策略的无机化学实验教学*
——以物质性质的三个实验为例
杨舒帆,谭 帅,翁哲慧,李艳妮,杨艳华
(昆明学院 化学化工学院 云南省金属有机分子材料与器件重点实验室(筹),云南 昆明 650214)
1981年,澳大利亚莫纳什大学的Richard F.Gunstone和Richard T.White以物理系学生对8个生活情境中的重力概念理解为内容,通过预测-观察-解释(predict-observe-explain,POE)的方法,探察学生对科学概念的理解,并于1992年正式提出了POE教学策略[1-2]。POE教学策略的实质是以学生为中心,在学生已有认知基础上,对未知实验的现象进行合理预测,并在预测中显露出学生的前概念(即学生在新课前掌握的科学概念)掌握情况。通过具体的实验操作及现象,产生认知冲突,在讨论的基础上,形成对实验现象的科学解释,最终实现学生的概念转变[3]。这不仅符合学生的认知发展规律,而且对以实验为主的探究式教学具有很好的指导作用[4]。在化学教学中,POE教学策略主要应用于中学化学教材中的演示型实验改革和探究型实验教学中,并归纳出抽象性的概念知识和元素化合物性质[5-8]。但是,POE教学策略在大学化学实验教学中的应用和研究几乎未见报道。
对传统教学模式的不断改革和创新,是提升实验教学质量的重要途径之一[9-11]。无机化学实验课程在整个化学实验科学中处于基础地位,使学生加深对无机物性质的认识及无机化学基本理论的理解,是课程的主要目的之一;培养学生辩证唯物主义世界观、实事求是的科学态度和严谨的实验作风,全面提高学生的知识、能力和素质,为后续实验课程打好基础,为学生终身发展奠定基础,是课程的主要任务之一。虽然课程中的大多数实验与中学化学相似,属于验证性实验,但其中一部分实验内容是课程教学的延伸,学生有所了解但理解不深入、不透彻,易产生认知冲突,在教学过程中适合采用POE教学策略。因此,本文选取自编实验教材中,以最能体现POE教学策略的3个实验为示例进行教学设计[12],旨在帮助学生构建完善的化学知识体系,加深对物质性质的理解,强化基础实验操作技能。
1 Zn与HNO3的反应
此实验是“氧化还原反应”和“氮和磷”的一个教学实验,分别出现在教材76页和94页,安排在大一上学期和下学期。
[实验内容]在两支试管中各加入一粒Zn,在试管①中加入 1 mL 浓HNO3(质量分数约为68%)、试管②中加入 1 mL 2 mol/L 的HNO3,观察实验现象。
[学生预测P]P1:根据人教版义务教育教科书《化学》 (九年级下册)<第八单元 金属和金属材料>“课题2 金属的化学性质”和“实验活动4 金属的物理性质和某些化学性质”,学生已经掌握了金属活动性顺序,知道金属单质与稀HCl和稀H2SO4等稀酸反应可以生成氢气。然而,金属单质与稀HNO3反应不会生成H2。
P2:根据人教版普通高中教科书《化学》(必修第二册)〈第五章 化工生产中的重要非金属元素〉“第二节 氮及其化合物”中,单质Cu与浓HNO3和稀HNO3反应,分别生成NO2和NO,但NO易与O2反应生成NO2。因此,预测单质Zn和稀HNO3反应,可观察到生成红棕色气体。
P3:常温下,活泼金属单质Fe、Al等与浓HNO3和浓H2SO4接触时,单质表面生成一层致密氧化膜,阻止反应进一步进行。因此,预测单质Zn与浓HNO3的反应,观察不到现象。
在面对新的知识情境时,学生根据已有认知,对实验现象进行了合理解释,并提出以上3点预测信息。在规范操作的基础上,对预测结果与实验现象的一致性进行验证。
[实验现象O]观察到的现象如图1所示。1)试管①产生大量红棕色气体并放热,现象与预测P3相矛盾。2)试管②生成无色气体,现象与预测P2相矛盾,且试管②生成的气体是否为H2不可知,即是否与预测P1相矛盾不可知。

图1 单质Zn与浓HNO3和稀HNO3反应的实验现象
观察是POE教学策略,重点强调通过观察物质颜色、状态、气味等的物理变化,强化学生的实验观察能力。当观察到的实验现象与预测不相符时,会产生认知冲突,进而激发学生的探索欲和学习兴趣。无论实验结果是否与预测一致,都需要学生对实验现象进行分析、查阅资料和讨论,最终提出合理的解释[13-14]。
[解释E]E1:硝酸根中有一个离域π键,易断键,使HNO3的氧化性增强。因此,金属单质与稀HNO3反应,不会生成H2,稀HNO3不显示酸性,而是显示氧化性。与预测P1结果一致,说明试管②生成的无色气体不是H2。
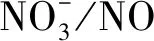
E3:金属单质Zn与浓HNO3接触后,表面生成ZnO,Zn-O键的键能较低,且不够致密[15],易发生解释E2的反应。
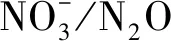
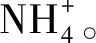

图2 气室法检测湿润的酚酞试纸变红
[归纳总结]试管①



试管②


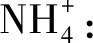

通过预测阶段和观察现象的对比,产生认知冲突,激发学生主动学习欲望。在合作交流、查阅资料、教师总结及解释的基础上,促进前概念的转化,建立新的知识概念,形成更为完善的知识体系,符合建构主义学习理论和皮亚杰认知发展理论。
2 Al与I2的反应
此实验是“硼和铝”的一个教学实验,出现在教材106页,安排在大一下学期。
[实验内容]将 0.25 g 铝粉和 0.5 g 预先研细的碘的干燥混合物,放在蒸发皿中混匀,堆成一小堆,加2滴 80 ℃ 左右的热水,观察实验现象并解释(此反应在通风橱中或抽风机下进行)。
[学生预测 P]学生已经掌握卤素可与单质Al反应,最为熟悉的是Cl2在加热条件下与Al反应生成AlCl3,且单质I2在常温下就可与活泼金属单质反应,但与Al反应的大部分实验都需在加热下进行。根据前概念推测此反应生成AlI3,但对反应机理及过程的理解不清楚。
[实验现象 O]观察到的现象如图3所示。1)先观察到有紫色的烟并伴随着刺激性气味。2)反应结束后蒸发皿中剩余比反应物更高的一堆物质,这主要由反应产生的气体和单质碘升华造成生成物膨胀造成。3)反应后的堆积物很蓬松,玻璃棒戳一下后成灰色的灰烬。

图3 铝粉与单质碘反应实验现象

E2:在热水作用下,单质I2升华,可观测到紫色的烟,有刺激性气味。

E4:AlI3水解产生的HI气体,也具有刺激性气味。
综上所述,先观察到有紫色的烟并伴随着刺激性气味,反应最后生成Al(OH)3。
[归纳总结]实验原理:

3 FeCl3与KSCN的反应
此实验是“铁、钴、镍”的一个教学实验,出现在教材123页,安排在大一下学期。
[实验内容]在FeCl3溶液中加入KSCN溶液,观察现象。然后再加入 0.1 mol/L 的NH4F溶液,观察有何变化,并解释原因。

P2:根据配位化学基础知识,F-的电负性强于SCN-中的配位原子S,因此,F-与Fe3+可形成更加稳定的配合物,红色溶液颜色消失。
[实验现象 O]观察到的现象如图4所示。1)淡黄色的FeCl3溶液中滴加无色的KSCN试剂后,溶液颜色变成红色。2)红色的溶液中滴加无色的NH4F试剂后,同学可观察到四种溶液颜色,依次变为橙黄色、橙色、黄色和无色。
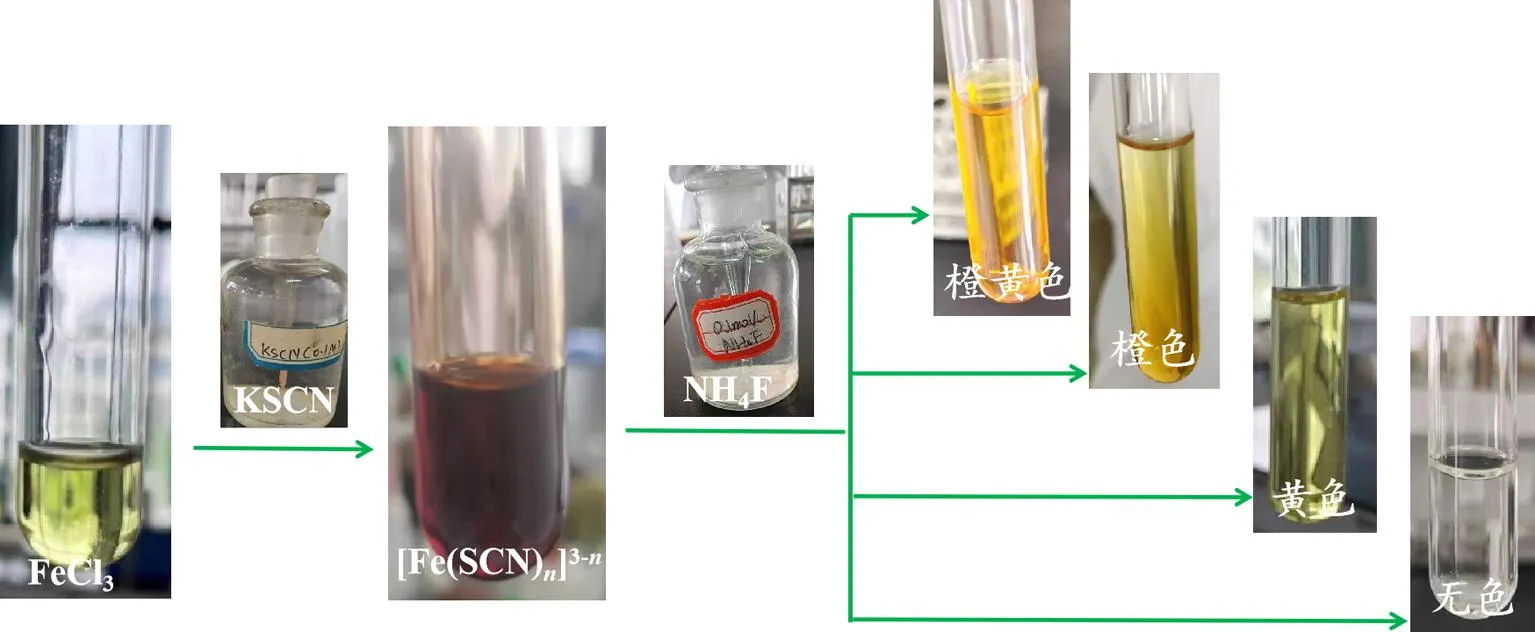
图4 FeCl3与KSCN反应后滴加NH4F溶液反应现象


E3:根据软硬酸碱结合原则分析,Fe3+的价层电子排布为3d54s0,d轨道和s轨道分别处于稳定的半满和全空状态,且可以接受电子对,电子云的变形性小,属于硬酸。F-的价层电子排布为2p6,p轨道处于稳定的全满状态,且可以给出电子对,电子云的变形性也小,属于硬碱。而SCN-中存在离域的π键,易失去电子、易断键,基团电子云易变形,属于软碱。因此,硬酸Fe3+与硬碱F-结合的配合物稳定性强于硬酸Fe3+与软碱SCN-结合的配合物,F-可与[Fe(SCN)n]3-n反应。
解释E2和E3是在预测P2的基础上进一步系统分析的结果,能够鼓励学生深入挖掘现象背后的本质,进而构建成体系的化学原理知识。
[归纳总结]实验原理:


[FeFm]3-m(m=1~6) 的稳定性强于 [Fe(SCN)n]3-n(n=1~6)
4 展望
无机化学实验教学内容较多,在探索物质基本性质和熟悉基本的实验操作基础上,采用POE教学策略,可以更好的激发学生化学思维,更加充分的调动学生学习积极性。在此基础上,通过在课程教学中对学生的操作过程给予全程关注和指导,能够更好的将理论与实践相结合,得出科学的解释和结论。应用POE教学策略的教学实验设计,在符合学生认知规律的建构主义发展理论下,重视理论的知识构建过程,不仅可以进一步提升学生的探究能力,而且还能培养学生探究问题的意识,提升课堂教学质量和效率。

