过硫酸钾与盐酸制取氯气的最佳条件探索*
吴佳鑫,丁浩栋,吴嘉欣,梁永锋
(宁夏师范学院 化学化工学院,宁夏 固原 756000 )
《普通高中化学课程标准(2017年版2020年修订)》明确提出,普通高中化学教育教学过程中,要全面发展学生的“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”“科学探究与创新意识”“科学态度与社会责任”化学学科核心素养[1]。化学是以实验为基础的自然科学,化学实验既是化学科学赖以形成和发展的基础,也是检验化学科学知识是否正确的真理性标准。因此,化学实验不仅是化学课程教学中的重要构成内容,同时也是实施化学教学的重要途径。化学实验教学对于培养学生的“科学探究与创新意识”“证据推理与模型认知”“科学态度与社会责任”等化学核心素养,尤其是对学生掌握科学实验的初步方法和技能具有重要价值。通过化学实验不仅可以帮助学生形成化学概念,理解和巩固化学知识,获得实验技能,而且通过有计划地、周密地、观察实验现象和通过分析、推理、判断等思维活动,有利于学生的观察能力、想象能力、记忆能力和思维能力培养。
“氯及其化合物”是“物质的相互转化”无机物性质主题大概念下非金属及其化合物的核心知识之一。江苏凤凰教育出版社2020年6月出版的《普通高中化学教科书必修》第一册和人民教育出版社2019年4月出版的《普通高中化学教科书必修》第一册中均选编了氯气的实验室制法及性质[2-3]。高中化学中通过氯气的制备和性质实验学习,促使学生的科学态度与社会责任、实验探究与创新意识、证据推理与模型认知等核心素养得到发展,也将使学生的宏观辨识与微观、变化观念与平衡思想等化学核心素养得到提升。为保证高中化学教学中氯气制备演示实验和学生实验的教学效果,为中学化学教师和学生提供多样化的实验室制备氯气的方法,开展实验室制备氯气实验的改进具有非常重要的意义。
1 用二氧化锰与浓盐酸共热制氯气的缺陷
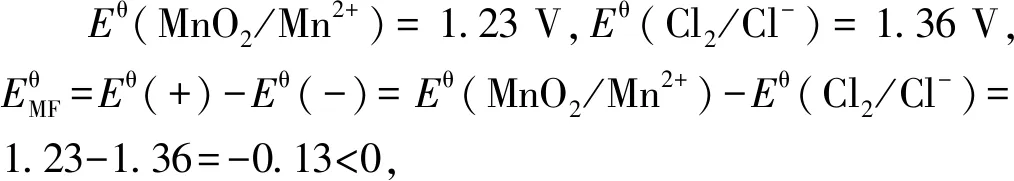
2 过硫酸钾制取氯气的原理及可行性
2.1 过硫酸钾与盐酸反应制备氯气的原理
过硫酸钾与盐酸的反应为:

2.2 过硫酸钾与盐酸反应作制取氯气可行性
3 盐酸最低浓度及反应速率探索
3.1 实验试剂及主要仪器
K2S2O8,HCl(38%),KCl饱和溶液,分液漏斗,250 mL 圆底烧瓶,酒精灯,铁架台,125 mL 的集气瓶,NaOH溶液。
3.2 实验步骤
1)根据教科书中氯气制备及性质实验所需要的氯气,初步实验过程中每次取38%(12 mol·L-1)的盐酸 12.6 mL,然后根据实验方案中规定的盐酸浓度加入计量的蒸馏水,使之达到规定的浓度与 10 g K2S2O8反应。
2)实验装置如图1所示,采用 125 mL 集气瓶计量。
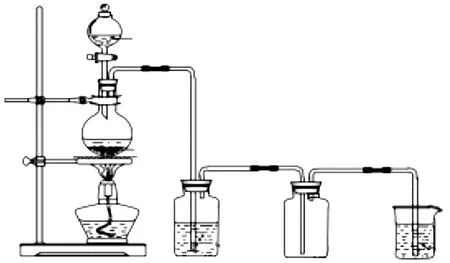
图1 实验室用过硫酸钾与盐酸制取氯气装置
3)实验开始用酒精灯加热至过硫酸钾固体完全溶解后停止加热,并撤去酒精灯。
3.3 实验方案及实验结果
实验方案及实验结果见表1。
4 最佳条件的确定
4.1 实验指标的确定
本实验选定Cl2产率和生成Cl2时间为指标,再综合评价实验结果的优劣。
指标1:Cl2产率是本实验考核的主要指标,占70%;
指标2:Cl2产生时间作为本次实验的次要指标,占30%。
以3.3节中用38%HCl与水体积比1∶7(1.5 mol·L-1盐酸)收集1瓶氯气(125 mL)所用时间 90 s为100分。在此基础上,时间每延长 20 s 减10分,每减少 20 s 加10分。
4.2 实验因素、水平的选定
本实验选择的因素有:过硫酸钾的质量、38%盐酸与水的体积比、38%盐酸的体积。每个因素分别选取三个不同水平进行实验。具体见表2。

表2 实验因素水平表
4.3 实验方案及其结果分析
本实验是三因素三水平实验,选用L9(34)正交表安排实验。实验方案及其结果分析见表3。
5 结论
1)实验表明,用过硫酸钾与盐酸反应制备氯气的最佳条件是A2B1C1,即取 10.15 g 氯酸钾放入圆底烧瓶中,用分液漏斗加入 11.6 mL 38%的盐酸,按照VHCl∶VH2O=1∶6用蒸馏水稀释。在此条件下反应速率适中,收集到的氯气得率比较高,而且收集到的氯气完全可以满足探究氯气化学性质的要求。
2)综合分析表明,用过硫酸钾与盐酸反应制备氯气在所选定的因素、水平范围内,各因素对实验指标影响的主次关系为:

3) 实验发现,用过硫酸钾与盐酸反应制取氯气,避免了二氧化锰与浓盐酸共热制取氯气实验中的缺陷,同时实验过程中没有白雾产生,实验现象明显,反应速率适中,完全满足了课堂演示和学生实验的要求。因此,建议高中化学教学中选用过硫酸钾与盐酸反应制取氯气的实验进行课堂演示和学生实验。
4) 此方法也为实验室制取氯气提供了一种新的途径。

