于氏解郁调肝散微生物限度检测方法考察*
梁林辉,章 斌**,芦 珂,姚永秀,何 露
(1.雅安职业技术学院,药学与检验学院,雅安市食品药品应用开发工程技术研究中心,四川 雅安 625000; 2.华润三九(雅安)药业有限公司,四川 雅安 625000)
于氏解郁调肝散是由木香、大黄、陈皮、郁金、熊胆粉等中药组成,按照一定的工艺制成的散剂。其来源于名老中医于荣光的经验处方,在经过祖传验方的基础上,经多年临床研究及中药应用并明确病因病机后筛选出《万病回春》木香调气散,又经过多年临床应用演变固定成于氏解郁调肝散处方[1-2]。该药物主要用于肝郁、痰饮、瘀血所致的气滞作痛、食入作胀、胃纳不香、吐酸嗳气、便秘、肠风下血、痈疽恶疮等及癥瘕积聚、痛风、糖尿病等患者见上述证候者[3]。
于氏解郁调肝散是成都高新伍德堂中医诊所的特色制剂,已临床应用多年,疗效显著,安全性好。前期,本研究小组已经建立该制剂的含量检测及定性鉴别方法,为该制剂的生产及质量控制提供了科学依据。考虑到微生物限度是保障口服制剂的安全的一项重要指标,且对含有抑菌作用的药物进行微生物限度检查时需考察抑菌性对检查结果的影响[4]。本文依据2020版中国药典[5]及参考文献对该制剂微生物检测方法适用性进行考察[6-7],为一步加强制剂的质量控制,保证用药安全,完善于氏解郁调肝散质量控制提供了参考。
1 仪器和材料
1.1 仪器
电热恒温培养箱DNP-9272(上海精宏) ;霉菌培养箱SHP-150 (北京中兴伟业);电子分析天平FA1004(上海力辰邦西仪器);生物安全柜BSC-1600ⅡA2(苏净安泰);超净工作台SW-CJ-2FD(苏净安泰);立式蒸汽灭菌器DGLS-100B(登冠医疗)。
1.2 药品与试剂
于氏解郁调肝散(成都黄在军医院,批号:20220601、20220602、20220603);培养基及稀释液:pH=7无菌氯化钠蛋白胨缓冲液(广东环凯,批号:220304A10);胰酪大豆胨琼脂培养基TSA(广东环凯,批号:220302A10);胰酪大豆胨液体培养基TSB(广东环凯,批号:220202A10);沙门葡萄糖琼脂培养基SDA(广东环凯,批号:220210A20);麦康凯液体培养基(北京陆桥,批号:22022613);麦康凯琼脂培养基(北京陆桥,批号:22021810);RV沙门菌增菌液体培养基(北京陆桥,批号:22030401);木糖赖氨酸脱氧胆酸盐琼脂培养基(北京陆桥,批号:22020401);肠道菌增菌液体培养基(北京陆桥,批号:22031601);紫红胆盐葡萄糖琼脂(北京陆桥,批号:22021610)。其他试剂均为市售常规试剂。
菌种:所有菌种均来源中国医学菌种保藏中心,购于中国食品药品检定研究院。
2 方法
2.1 菌液制备
1)需氧菌菌液制备:取大肠埃希菌、乙型副伤寒沙门菌、金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌分别接种至 10 mL TSB培养基内,依据药典方法进行培养,然后用0.9%无菌氯化钠溶液稀释成每 1 mL 含菌量小于 100 cfu 的菌悬液。
2)酵母菌菌液制备:取新鲜白色念珠菌菌种接种至 10 mL 沙氏葡萄糖液体培养基中,依据药典方法进行培养,然后同“2.1中1)”方法稀释成每 1 mL 含菌量小于 100 cfu 的菌悬液。
3)霉菌菌液制备:取新鲜黑曲霉孢子培养物接种至SDA培养基中,依据药典方法进行培养并收集孢子悬液至无菌试管内,用含0.05%(体积分数)聚山梨酯80的pH=7.0无菌氯化钠溶液制成适宜浓度的孢子悬液[3]。
2.2 供试液制备
称取供试品 10 g,加入 100 mL 温度低于 45 ℃、pH=7.0的无菌氯化钠蛋白胨缓冲液,充分振摇混匀,制成10-1的供试液。取10-1供试液 10 mL,加入 90 mL 上述稀释液中,得10-2供试液。同法制成10-3供试液。
2.3 需氧菌、霉菌及酵母菌计数方法适用性试验
A试验组:将10-1供试液分装至试管,10 mL/支,共5支;将 “2.1中1)”制成的5种菌悬液各 0.1 mL 依次加入对应的5支试管,混匀,使5种供试液中含菌量均低于 100 cfu/mL;取供试液 1 mL,注入 90 mm 的无菌平皿中,平行制备2个平皿,依据需氧菌的种类倾注适宜的TSA或SDA培养基,混匀,凝固,并逐日观察计数。
B供试品对照组:取10-1供试液 10 mL 于试管中,加入 0.1 mL pH=7.0无菌氯化钠-蛋白胨缓冲液代替菌液,后续同试验组操作。
C阳性对照组:取5支装有 10 mL 的pH=7.0无菌氯化钠-蛋白胨缓冲液的试管,对应加入5种菌悬液各 0.1 mL,后续同试验组操作。
D阴性对照组:取pH=7.0无菌氯化钠-蛋白胨缓冲液 1 mL,注入直径 90 mm 的无菌平皿中,后续同试验组操作。

2.4 控制菌检验方法适用性试验
因该制剂为含药材原粉口服固体给药剂,依据2020版《中国药典》确认控制菌为大肠埃希菌、沙门菌、耐胆盐革兰阴性菌。
2.4.1 大肠埃希菌检查
A试验组:取10-1供试液 10 mL,加入 100 mL TSB中,加入大肠埃希菌菌液使含菌量不大于 100 cfu,混匀,依据2020版《中国药典》进行接种、划线培养。
B供试品对照组:取10-1供试液 10 mL,加入 100 mL TSB中,后续不加菌液。同试验组操作。
C阳性对照组:取大肠埃希菌菌液加入 100 mL TSB中,含菌量不大于 100 cfu,后续培养同试验组操作。
D阴性对照组:用pH=7.0无菌氯化钠-蛋白胨缓冲液代替供试液,后续不加菌。同试验组操作。
2.4.2 沙门菌检查
A试验组:称取 10 g 供试品加入 100 mL TSB中,加入沙门菌使含菌量不大于 100 cfu,混匀,后续依据2020版《中国药典》进行接种、选择和分离培养。
B供试品对照组:取 10 g 供试品加入 100 mL TSB中,后续不加菌同试验组操作。
C阳性对照组:取含菌量不大于 100 cfu 的沙门菌加入 100 mL TSB中,后续培养同试验组操作。
D阴性对照组:取 100 mL TSB,后续不加菌。同试验组操作。
2.4.3 耐胆盐革兰阴性菌检查
A试验组:称取 10 g 供试品加入 100 mL TSB中,混匀,于室温培养 2 h。再用TSB培养基作为稀释剂制成得10-2供试液,同法制成10-3供试液。取三种稀释度供试液分别接种于 10 mL 肠道菌增菌液体培养基中,依据2020版《中国药典》进行接种、选择和分离培养。
B供试品对照组:取上述实验组中10-1培养物 1 mL 分别接种至2支 10 mL 肠道菌增菌液体培养基中,分别加入含菌量均小于 100 cfu 的大肠埃希菌和铜绿假单胞菌菌液,后续同实验组操作。
C阳性对照组:取含菌量小于 100 cfu 的大肠埃希菌、铜绿假单胞菌菌液分别加入 10 mL 肠道菌增菌液体培养基中,后续培养同试验组操作。
D阴性对照组:取 1 mL TSB,加入 10 mL 肠道菌增菌液体培养基中,后续培养同试验组操作。
3 结果
3.1 需氧菌、霉菌及酵母菌计数方法适用性试验结果
取于氏解郁调肝散(批号:20220601),按照“2.3项”下分组及检测方法,常规及稀释检测,供试品各实验菌株结果如表1。需氧菌中金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌回收率均不符合药典要求,随进行稀释检测;10-2供试液及10-3供试液需氧菌稀释检测结果如表2、表3。由表2、表3可知,需氧菌检测需将样品稀释至1∶1000才能使所有实验菌回收率满足药典要求。

表1 10-1供试液需氧菌、霉菌及酵母总数及回收率结果
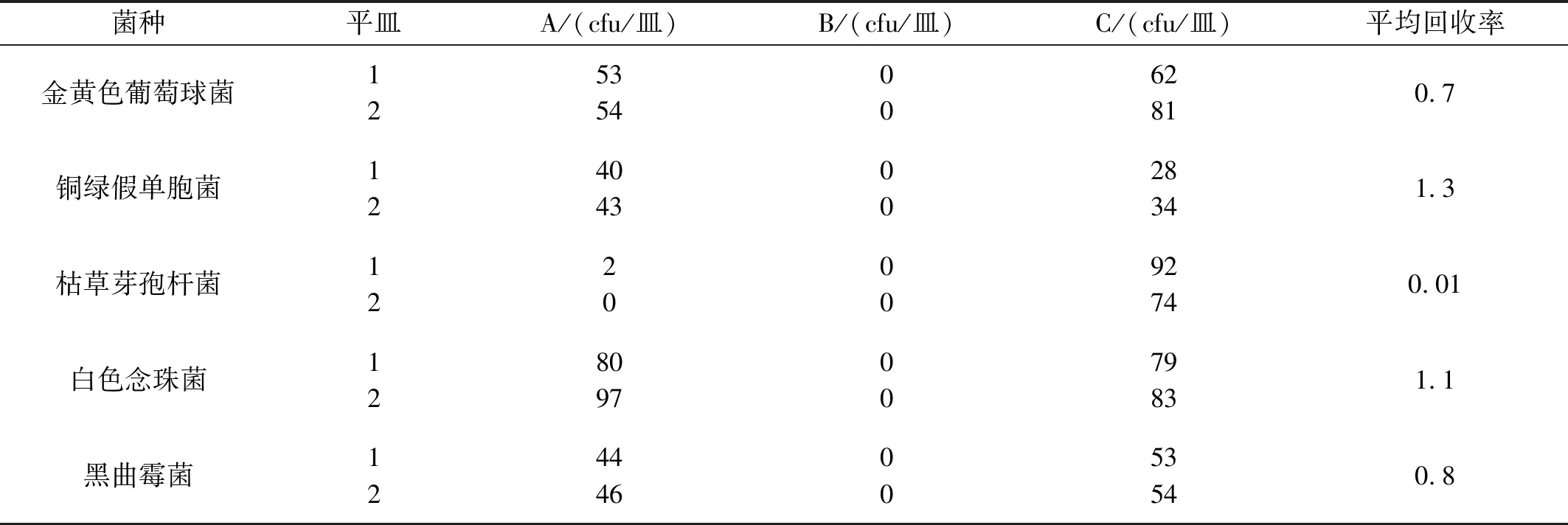
表2 10-2供试液需氧菌总数及回收率结果

表3 10-3供试液需氧菌总数及回收率结果
3.2 需氧菌、霉菌及酵母菌计数方法适用性验证
取于氏解郁调肝散2批(批号:20220602、20220603),按照“3.1项”下所得稀释倍数结果和“2.3项”下分组及检测方法,验证待测菌株并计算回收率,结果如表4。

表4 需氧菌、霉菌及酵母菌验证回收率
3.3 控制菌检验方法适用性试验结果
取三批于氏解郁调肝散,按照2.4项下分组及检测方法进行检测,供试品各控制菌检测结果如表5。由表5可知,大肠埃希菌、沙门菌和耐胆盐革兰阴性菌在3个批次的实验组和阳性对照组均检出,供试品对照组和阴性对照组未检出。可用常规方法进行控制菌检查。

表5 控制菌检测结果
4 讨论
于氏解郁调肝散是含有药材原粉的散剂,由于药材来源、加工工艺、保存条件等影响,导致中药饮片微生物污染严重,进而对含有药材原粉成品制剂的微生物限度有较大的影响[8-9]。因此,需要完善中药饮片的微生物限度标准,控制饮片的加工生产过程,保障药品安全。2020版药典增加了中药饮片的微生物限度检查法,从源头加强制剂原料的质量控制,对中药安全性、国际化有重要的意义。
于氏解郁调肝散中含木香、大黄、陈皮、郁金、熊胆粉等中药,有文献表明,药典要求口服散剂需要检测的项目有需氧菌、霉菌及酵母菌、大肠埃希菌、沙门菌和铜绿假单胞菌。木香提取物及挥发油对金黄色葡萄球菌、绿脓杆菌、表皮葡萄球菌和粪肠球菌有较强的抑菌性[10-11]。大黄中蒽醌类化合物,特别是大黄素、大黄酸同样有较强的抑菌作用,大黄素对金黄色葡萄球菌最小抑菌浓度只有 0.025 mg/mL[12-13]。陈皮和郁金含有大量挥发油,对大肠杆菌、金黄色葡萄球菌、巴氏杆菌等也有明显的抑制作用[14-15],具有抗氧化、抗菌、保鲜等活性,可用做水果保鲜添加剂[16];熊胆粉由黑熊胆汁干燥而来,主要成分为去氧胆酸、胆酸,对大肠埃希菌、金黄色葡萄球菌、枯草芽胞杆菌有抑菌作用[17-18]。考虑到配方原料及制备方法可能造成的微生物限准确性差异,有必要建立并验证于氏解郁调肝散微生物限度检查方法。
制剂中含有药材原粉,所以,本实验排除了薄膜过滤法。首先考虑采用常规法及稀释法,如果供试菌回收率不满足要求,再考虑中和剂法。结果表明,于氏解郁调肝散对金黄色葡萄球菌、铜绿假单饱菌和枯草芽孢杆菌具有明显的抑制作用,检测金黄色葡萄球菌和铜绿假单饱菌需将样品按1∶100稀释,检测枯草芽孢杆菌需将样品按1∶1000稀释。药典规定,含有药材原粉的口服制剂中需氧菌落总数不超过104,因此,可选择制剂1∶1000稀释度进行检测[5]。可采用1∶10供试液进行霉菌及酵母菌检测,满足回收率在0.5~2范围。控制菌采用常规方法进行检验即可满足要求。
综上所述,本研究所建立于氏解郁调肝散微生物限度检测方法简便易行、准确、重复性好,对于完善该制剂的质量控制和质量标准的建立提供了科学依据,为进一步制剂工业化生产和临床应用奠定了药学基础。

