解磷细菌活化水稻土中低品位磷矿粉的效果与机制
宋雅荣,常单娜,周国朋,高嵩涓,段廷玉✉,曹卫东✉
1 兰州大学草种创新与草地农业生态系统全国重点实验室/兰州大学农业农村部草牧业创新重点实验室/兰州大学草地农业科技学院,兰州 730020;2 中国农业科学院农业资源与农业区划研究所/北方干旱半干旱耕地高效利用全国重点实验室,北京 100081;3 安徽农业大学资源与环境学院,合肥 230036;4 南京农业大学资源与环境科学学院,南京 210095
0 引言
【研究意义】磷是植物生长必需的营养元素,农业生产上主要通过持续增加磷肥的施入量,以保持作物高产稳产[1]。磷矿属于不可再生的矿产资源,我国已探明的磷矿主要以中低品位矿为主(全磷P2O5<28%,90%),高品位磷矿少(全磷P2O5>30%,10%)[2]。磷矿粉主要成分是氟磷酸钙,常伴有碳酸盐的物质,主要以磷酸三钙(非水溶性)的形态存在[3-4]。在生产上,高品位磷矿主要用于制作磷肥,按照目前磷肥生产速度,大约 23 年后,我国高品位磷矿资源将会逐渐枯竭[5-6]。将低品位磷矿资源直接应用于农业,可显著降低能耗,并延长高品位磷矿使用年限[7]。但低品位磷矿粉中的有效磷含量低,磷生物利用率低。因此,最大程度活化磷矿粉中的难溶性磷,是提高其农业应用效率的核心。【前人研究进展】磷矿粉的活化方法主要包括物理、化学和生物活化。物理活化可以直接机械破碎改变磷矿粉的粒径及晶格结构,粒径越小,比表面积越大,与土壤的接触面积越多,越有利于磷矿粉中难溶性磷的溶解与释放,常适用于南方酸性土壤及根际过程较强的豆科植物[8]。王晨等[9]发现机械活化磷矿粉,磷矿粉的晶格尺寸减小,许多官能团发生置换反应,使磷矿粉的可溶性磷含量提高61.6%。化学活化主要通过使用酸分解磷矿粉,或者与合成酸活化剂等反应,显著增强难溶性磷酸盐溶解,但存在一定的环境风险[10]。生物活化主要包括根系活化、解磷微生物以及二者的相互作用等,绿色环保,有助于推动我国农业的可持续发展[11]。解磷细菌解磷机制较复杂,主要通过产生胞外无机酸、有机酸和磷酸酶介导的矿化作用引起难溶性磷酸盐的溶解[12],提高磷的有效性从而提高作物产量[13]。因菌株特性及培养环境条件等因素,解磷微生物分泌的有机酸、磷酸酶存在差异[14]。目前报道的解磷微生物主要是细菌,种类繁多,有芽孢杆菌属(Bacillus)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)等[15]。解磷细菌能够活化红壤或磷矿粉中的难溶性磷,提高有效磷含量[16-17]。林启美等[18]以磷矿粉为唯一磷源培养解磷细菌,5 d 后培养液磷增加量最高可达10.91 mg·L-1。王苗[19]的研究表明,单独添加机械活化磷矿粉土壤速效磷随培养时间的延长缓慢波动增加,同时添加机械活化磷矿粉和接种解磷菌,土壤速效磷在培养过程中持续保持较高幅度的增加,但两者之间是否存在协同作用并不清楚。一方面,磷矿粉经过机械活化后粒径变小,比表面积变大,与土壤及解磷菌接触的机会增加,有利于解磷菌活化其中的难溶性磷。另一方面,经过机械活化后晶体表面的缺陷越多,更多不稳定的磷在活化过程中被释放出来,剩余残渣态磷难以被解磷菌活化。【本研究切入点】关于物理机械活化及解磷细菌对磷矿粉的溶磷作用已有相关研究,但鲜见解磷细菌对不同粒径磷矿粉的活化效果及机制的研究。【拟解决的关键问题】通过土壤培养试验,分析测定不同形态磷、有机酸、磷酸酶、phoD等指标,探讨解磷细菌对不同粒径磷矿粉在红壤上施用效果的影响,分析解磷细菌活化低品位磷矿粉(不同粒径)中难溶性磷的效应与机制,为红壤稻田高效利用低品位磷矿粉提供技术和理论支撑。
1 材料与方法
1.1 供试材料
供试磷矿粉属于低品位磷矿粉,全磷(P2O5)含量18.0%,磷矿粉粒径分别为0.18、0.10 和0.05 mm,其有效磷(P2O5)含量分别为2.1%、3.1%、4.5%,pH分别为9.41、9.55、9.58。供试菌株由北方民族大学杨国平老师提供,分别为乙酸钙不动杆菌(Acinetobacter calcoaceticus)和皮特不动杆菌(Acinetobacterpittii),平板溶磷试验发现两株菌均具有良好的解磷能力。供试土壤采自湖南省赫山区稻田,土壤pH 6.4,有机质38.6 g·kg-1,全磷0.40 g·kg-1,全氮1.7 g·kg-1,有效磷6.8 mg·kg-1,速效钾122.0 mg·kg-1。
1.2 试验设计
本试验为双因素试验,因素一为磷矿粉粒径,因素二为解磷细菌。磷矿粉粒径分别为0.18 mm(L1)、0.10 mm(L2)、0.05 mm(L3),解磷细菌分别为A.calcoaceticus(P1)和A.pittii(P2),同时设置不接种对照(P0),共9 个处理,各处理32 次重复(用于8 次破坏性取样),共288 个培养瓶。将磷矿粉与土壤(风干土)按1:100 重量比准确称取到培养瓶中,搅拌混合均匀[20],菌液按6.0%的接种率(菌液∶土重=v(mL)∶w(g))接种[21],接种处理添加含有解磷菌的溶菌肉汤(LB)培养基,对照不接菌处理添加等量无菌的LB 培养基。用透气的封口膜密封,所有培养瓶均在25 ℃黑暗培养箱中培养,定期称重补充LB 培养基至最大持水量的65.0%。
1.3 解磷细菌的培养
将4 ℃保存的菌种,接种到营养琼脂(NA)平板上。2 d 后将长好的解磷细菌接种于150 mL LB 液体培养基中,28 ℃、150 r/min 摇床中振荡培养24 h(血球板计数,菌液浓度108cfu/mL)。
NA 培养基(g·L-1):蛋白胨10 g,牛肉膏3 g,氯化钠5 g,琼脂15 g,蒸馏水1 000 mL。LB 培养基(g·L-1):蛋白胨10 g,酵母提取物5 g,氯化钠10 g,蒸馏水1 000 mL。
1.4 样品采集与指标测定
分别在培养1、3、5、10、15、30、45、60 d 动态取样,取30 g 鲜土于-20 ℃冰箱保存,用于测定微生物量磷、磷酸酶、有机酸(OA)及碱性磷酸酶功能基因phoD定量分析。剩余土样风干过筛用于测定土壤基础理化性质与磷分级。
磷矿粉中有效磷采用柠檬酸提取-钒钼黄比色法测定,磷矿粉中全磷采用1∶1 HNO3提取-钒钼黄比色法测定,有效磷采用碳酸氢钠提取-钼锑抗比色法测定,pH 采用水土比2.5∶1、电位法测定,微生物量磷采用氯仿熏蒸-NaHCO3浸提法[22]测定。磷分级参照Tiessen 磷分级法[23]测定(取培养1、30、60 d)。磷酸酶活性采用分光光度法测定[24]。有机酸测定仪器为高效液相色谱质谱联用仪(Waters Acquity UPLC,AB SCIEX 5500 Qtrap-MS),吸取样液过0.22 μm 水相滤膜进样,利用MultiQuant 软件进行积分,利用标准曲线进行含量计算[25]。
1.5 土壤总DNA 提取和荧光定量PCR 测定
土壤样品DNA 采用FastDNA®Spin Kit for Soil(MP Biomedicals)试剂盒提取。NanoDrop®ND-2000微量紫外分光光度计(Thermo Fisher,Waltham,MA,USA)检测DNA 浓度和质量。使用QuantStudio™ 6 Flex Real-Time PCR 仪(ThermoFisher,USA)测定phoD基因丰度。phoD基因正向引物和反向引物分别为(phoD-F733:5′-TGGGAYGATCAYGARGT-3′和phoD-R1083:5′-CTGSGCSAKSACRTTCCA-3′)。实时荧光定量PCR 的反应体系为10 μL,包括5 μL Hieff UNICON®Universal Blue qPCR SYBR Green Master Mix,0.2 μL 上、下游引物,1 μL DNA 模板,补充ddH2O 至10 μL。循环条件为95 ℃预变性5 min,95 ℃变性30 s,51 ℃退火30 s,72 ℃延伸45 s,循环40次[26]。将含有目的基因的质粒连续10 倍稀释度作为qPCR 标准品,构建标准曲线(R2>0.99),扩增效率达到90.0%—110.0%。通过扩增曲线及熔解曲线分析验证qPCR 扩增的质量。
1.6 数据处理及统计方法
采用Microsoft Excel2016 软件进行数据处理,用IBM SPSS Statistics23.0 软件进行方差分析与因子降维分析,使用IBM SPSS Amos26.0 构建结构方程模型和Origin2021 软件进行绘图。
2 结果
2.1 土壤有效磷的变化
图1 显示,各处理土壤有效磷含量在培养前期迅速增加,于第5 天到达最高水平后至培养结束(60 d)期间维持波动高位。培养期间,3 个粒径(0.18、0.10和0.05 mm)接种P1 菌株的土壤有效磷含量为9.8—17.4 mg·kg-1,平均分别为13.8、14.2、14.7 mg·kg-1,接种P2 菌株的土壤有效磷含量为8.3—18.0 mg·kg-1,平均分别为13.4、13.5 和14.2 mg·kg-1,均高于不接种对照(P0)处理(为6.7—11.7 mg·kg-1,平均分别为9.7、10.3 和9.6 mg·kg-1),分别提高42.3%、37.9%、53.1%和38.1%、31.1%、47.9%(P<0.05)。不同粒径相比,接种解磷细菌后粒径0.05 mm 磷矿粉处理的有效磷含量增幅最大,但两株解磷细菌之间的解磷效果差异不显著(图1-a、1-b、1-c)。培养第10天时,粒径0.05 mm 磷矿粉的土壤有效磷含量均显著高于粒径0.18、0.10 mm 磷矿粉的,分别提高19.2%、11.0%(P1)和11.3%、9.0%(P2)(P<0.05)(图1-d、1-e、1-f)。

图1 接种解磷细菌培养过程中土壤有效磷含量动态变化(a-L1;b-L2;c-L3;d-P0;e-P1;f-P2)Fig. 1 Dynamic changes of soil available phosphorus content during cultivation of phosphate-solubilizing bacteria inoculated (a-L1;b-L2; c-L3; d-P0; e-P1; f-P2)
2.2 土壤微生物量磷的变化
图2 显示,各处理微生物量磷在培养前期迅速增加,于第3 天到达最高水平后逐渐降低,在培养末期趋于平稳(45—60 d)。在3—45 d,3 个粒径(0.18、0.10、0.05 mm)磷矿粉接种P1 菌株后土壤微生物量磷含量为8.7—26.6 mg·kg-1,平均含量分别为19.6、20.0、21.4 mg·kg-1,接种P2 菌株的土壤微生物量磷含量为8.5—28.3 mg·kg-1,平均分别为18.7、19.0 和21.2 mg·kg-1,均高于P0 处理(为7.8—15.9 mg·kg-1,平均含量分别为10.6、11.8 和12.7 mg·kg-1),分别提高84.9%、69.5%、68.5%和76.4%、61.0%、66.9%(P<0.05)。培养第10 天时,粒径0.05 mm 磷矿粉处理的土壤微生物量磷含量显著高于粒径0.18 mm 磷矿粉处理,P0、P1 和P2 处理分别高31.7%、18.7%、24.6%(P<0.05)(图2-d、2-e、2-f)。

图2 接种解磷菌后培养过程中土壤微生物量磷含量的动态变化(a-L1;b-L2;c-L3;d-P0;e-P1;f-P2)Fig. 2 Dynamic changes of soil microbial biomass phosphorus content during cultivation of phosphate-solubilizing bacteria inoculated (a-L1; b-L2; c-L3; d-P0; e-P1; f-P2)
2.3 土壤磷库的变化
培养第1、30、60 天的磷形态变化如表1 所示。在整个培养过程中,随培养时间的延长,与P0 相比,P1 与P2 处理的树脂磷(Resin-Pi)逐渐增加。对于不接种解磷细菌(P0)粒径0.05 和0.10 mm 磷矿粉的Resin-Pi 含量显著高于粒径0.18 mm 磷矿粉的处理,分别为9.3、11.3 和11.8 mg·kg-1;P1 处理3 个粒径(0.18、0.10、0.05 mm)磷矿粉的Resin-Pi 平均含量分别为16.6、16.1、16.5 mg·kg-1,P2 处理下各粒径磷矿粉的Resin-Pi 平均含量分别为13.9、16.4、16.1 mg·kg-1,较P0 处理分别提高78.5%、42.5%、39.8%和49.5%、45.1%、36.4%(P<0.05)。接种解磷细菌后,粒径0.18 mm 磷矿粉Resin- Pi 平均含量增幅最明显。3 个粒径(0.18、0.10、0.05 mm)下P1 菌株的碳酸氢钠提取无机磷(NaHCO3-Pi)平均含量分别为15.6、16.2、16.5 mg·kg-1,P2 菌株的NaHCO3-Pi 平均含量分别为14.9、15.1、15.5 mg·kg-1,均高于P0 处理(分别为13.1、13.2 和13.2 mg·kg-1),分别提高19.1%、22.7%、25.0%和13.7%、14.4%、17.4%(P<0.05)。粒径0.18、0.10 mm 磷矿粉接种P2 菌株氢氧化钠提取有机磷(NaOH-Po)平均含量分别为73.5、72.0 mg·kg-1,均高于P0 处理(分别为63.0、64.1 mg·kg-1),提高了16.7%、12.3%(P<0.05)。粒径0.18 mm 磷矿粉接种P1 菌株稀盐酸提取无机磷(Dil.HCl-Pi)平均含量为339.9 mg·kg-1,高于P0 处理(为302.3 mg·kg-1),提高10.5%(P<0.05)。
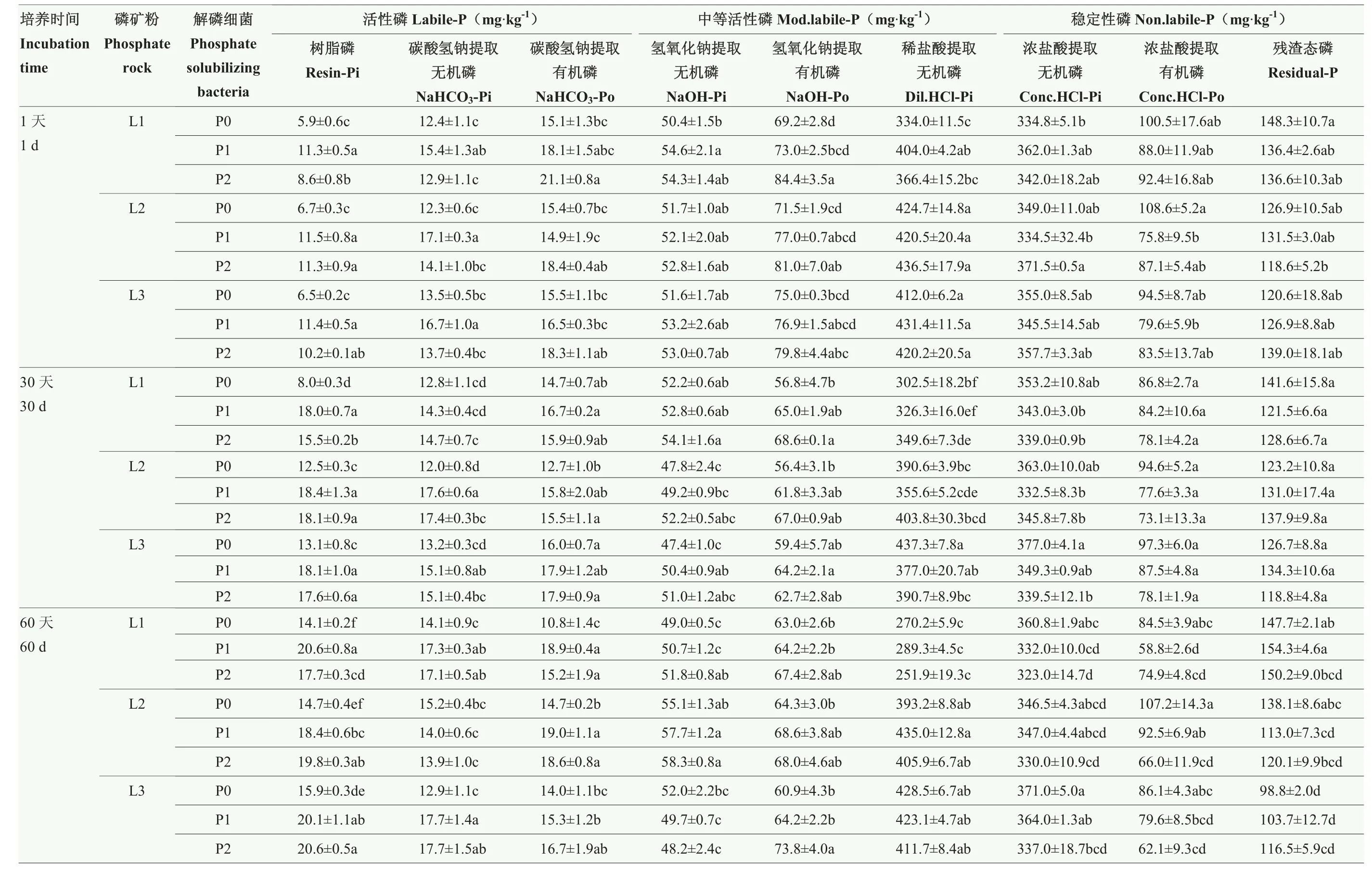
表1 接种解磷菌后培养过程中土壤不同磷形态含量的变化Table 1 Changes of phosphorus pool content during cultivation of phosphate-solubilizing bacteria inoculated
粒径0.10 和0.05 mm 的磷矿粉接种P1 菌株浓盐酸提取有机磷(Conc.HCl-Po)平均含量分别为82.0、82.2 mg·kg-1,接种P2 菌株的Conc.HCl-Po 平均含量分别为75.4、74.6 mg·kg-1,均低于P0 处理(分别为103.5、92.6 mg·kg-1),分别降低20.8%、11.2%和27.2%、19.4%(P<0.05)。
根据有效性的不同,Resin-Pi 和碳酸氢钠提取无机磷(NaHCO3-Pi)、碳酸氢钠提取有机磷(NaHCO3-Po)划分为活性磷(Labile-P);氢氧化钠提取无机磷(NaOH-Pi)、氢氧化钠提取有机磷(NaOH-Po)和稀盐酸提取无机磷(Dil.HCl-Pi)划分为中等活性磷(Mod.labile-P);浓盐酸提取无机磷(Conc.HCl-Pi)、Conc.HCl-Po 和残渣态磷(Residual-P)划分为稳定性磷(Non.labile-P)。本研究中各处理的磷形态主要以Non.labile-P 为主,其次是Mod.labile-P、Labile-P,分别占全磷的47.0%—57.0%、38.0%—48.0%和3.0%—6.0%(图3)。与P0 相比,接种解磷细菌后粒径0.18、0.10和0.05 mm 磷矿粉处理的Labile-P 分别增加28.4%—46.7%、15.0%—39.5%和19.1%—29.5%,Non.labile-P分别降低2.1%—8.0%、1.2%—12.2%和1.5%—10.6%(图4),表明接种解磷细菌后,粒径0.18 mm 磷矿粉的活性磷增幅最大。

图3 接种解磷细菌后培养过程中磷库占比(a-L1;b-L2;c-L3)Fig. 3 Proportion of phosphorus pool during cultivation of phosphate-solubilizing bacteria inoculated (a-L1; b-L2; c-L3)

图4 接种解磷细菌后培养过程中磷库相对变化比例(a-L1;b-L2;c-L3)Fig. 4 Relative change ratio of phosphorus pool during cultivation of phosphate-solubilizing bacteria inoculated (a-L1; b-L2; c-L3)
2.4 土壤pH 的变化
各处理下pH 在培养前期迅速增加(1—5 d),随后缓慢上升至逐渐平稳(5—60 d)。整个培养期间,与P0 相比,接种解磷细菌(P1 和P2)的处理均显著降低了pH,分别降低了0.20—0.35 个单位和0.18—0.28 个单位(P<0.05),但不同解磷细菌间差异不显著(图5-a,5-b,5-c)。整个培养期间,接种P1,粒径0.10 和0.05 mm 磷矿粉处理的土壤pH 较粒径0.18 mm 磷矿粉分别升高0.17—0.36 和0.14—0.25 个单位。接种P2,粒径0.05 mm 磷矿粉处理的土壤pH 较粒径0.18 mm 磷矿粉升高0.12—0.39 个单位(P<0.05)(图5-d,5-e,5-f)。
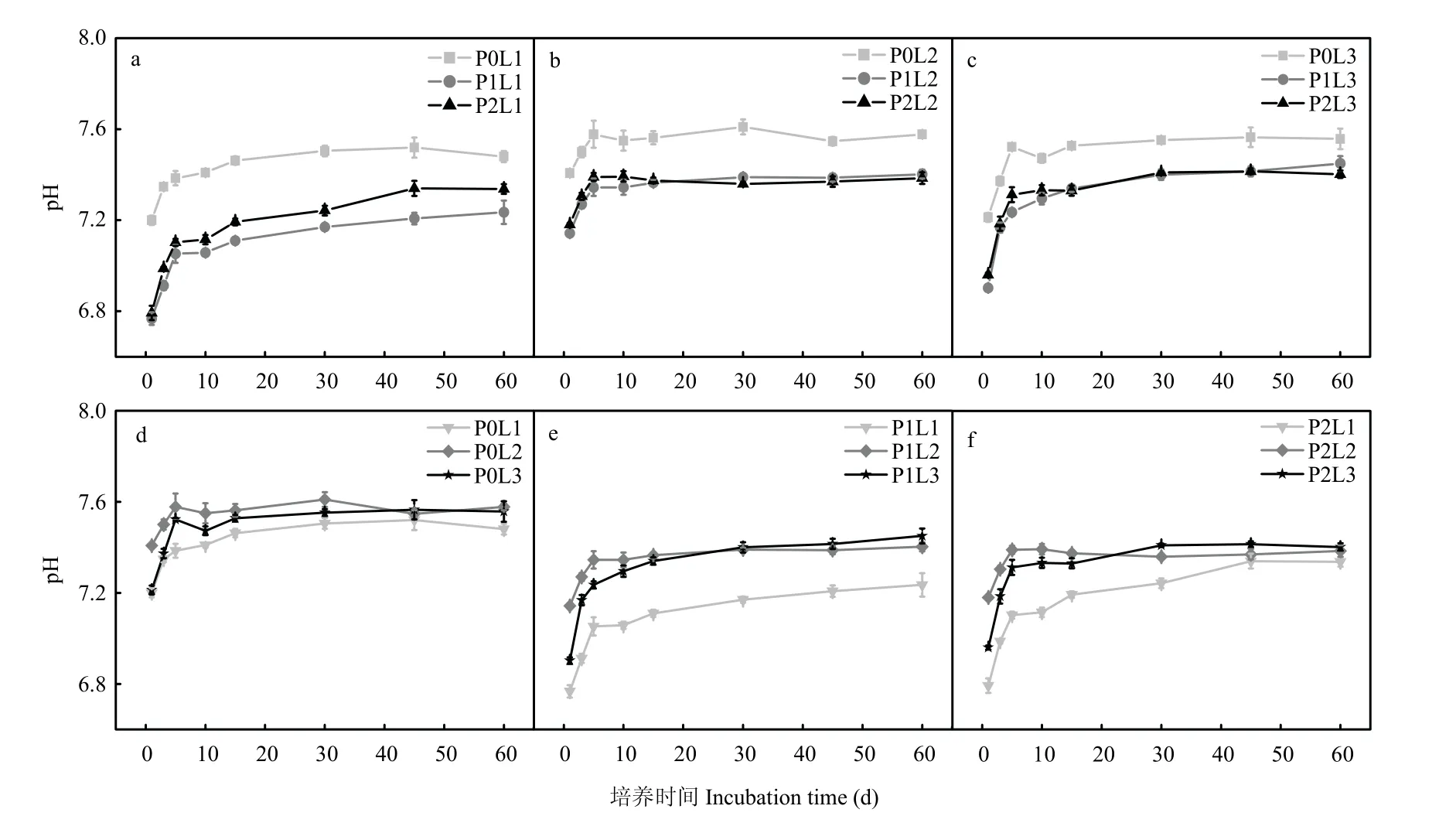
图5 接种解磷细菌后培养过程中土壤pH 动态变化(a-L1;b-L2;c-L3;d-P0;e-P1;f-P2)Fig. 5 Dynamic changes of soil pH during cultivation of phosphate-solubilizing bacteria inoculated (a-L1; b-L2; c-L3; d-P0; e-P1;f-P2)
2.5 土壤有机酸含量的变化
培养第60 天有机酸主要以乙酸(HAC)为主,其次是草酸(OXA)、丁酸(BA)、丙酸(PA)(图6)。与P0 相比,接种P1 和P2 解磷细菌后不同粒径磷矿粉处理下的HAC 含量均增加,分别提高5.2%—7.4%和9.1%—13.7%,OXA 含量分别提高3.5%—7.0%和1.5%—2.9%(粒径0.10 mm 磷矿粉除外),BA 含量显著提高27.2%—47.0%和17.2%—29.2%(P<0.05),PA 含量显著提高45.9%—94.0%和64.8%—127.5%(P<0.05)。解磷细菌与磷矿粉粒径对各有机酸含量的交互作用不显著。

图6 接种解磷细菌60 d 对土壤乙酸(a)、草酸(b)、丁酸(c)和丙酸(d)含量的影响Fig. 6 Effect of 60 days inoculation of phosphate-solubilizing bacteria on acetic acid (a), oxalic acid (b), butyric acid (c), and propionic acid (d) contents in soil
2.6 土壤磷酸酶活性及phoD 基因丰度的变化
培养第60 天碱性磷酸酶(ALP)活性高于酸性磷酸酶(ACP)活性。与P0 相比,接种P1 显著提高了不同粒径磷矿粉处理的ALP 活性,提高6.5%—13.4%(P<0.05),接种P1 和P2 解磷细菌均显著提高不同粒径磷矿粉处理的ACP 活性,分别提高7.6%—10.8%和12.8%—17.2%(P<0.05)(图7)。与P0 相比,各不同粒径磷矿粉接种解磷细菌phoD基因丰度均有增加趋势,粒径0.18 和0.05 mm 的磷矿粉接种P1 的phoD基因丰度分别显著提高98.6%、81.2%,接种P2显著提高37.1%、20.1%,且接种不同的解磷细菌phoD基因丰度存在显著差异,接种P1 的phoD基因丰度较P2 显著提高44.8%、50.8%(P<0.05)(图8),表明P1 主要分泌ALP,P2 主要分泌ACP。

图7 接种解磷细菌60 d 对土壤碱性磷酸酶(a)、酸性磷酸酶(b)活性的影响Fig. 7 Effect of 60 days inoculation of phosphate-solubilizing bacteria on alkaline phosphatase (a) and acid phosphatase (b)activities in soil

图8 接种解磷细菌对phoD 基因丰度的影响Fig. 8 Effects of phosphate-solubilizing bacteria inoculation on phoD gene abundance
2.7 土壤磷库组分与各指标的相关性分析
磷库组分与各指标的相关性分析结果表明,AP、Resin-Pi 均与有机酸(HAC、OXA、PA、BA)、phoD、磷酸酶(ALP、ACP)含量呈显著正相关,均与pH值呈显著负相关。NaHCO3-Pi 与有机酸(HAC、PA)、磷酸酶(ACP)呈显著正相关。Conc.HCl-Pi 与有机酸(HAC、PA)、磷酸酶(ACP)呈显著负相关。Conc.HCl-Po 与有机酸(HAC)、磷酸酶(ACP)显著负相关,表明接种解磷细菌主要通过分泌有机酸(HAC、PA)溶解难溶性无机磷,分泌有机酸(HAC、PA),磷酸酶(ALP、ACP)溶解难溶性有机磷(图9)。

图9 磷库组分与有机酸(a)、磷酸酶(b)的相关性分析Fig. 9 Correlation analysis of phosphorus pool components with organic acid (a) and phosphatase (b)
为了进一步揭示难溶性磷的活化机制,将有效磷与各指标的内在关系进行拟合,构建结构方程模型(图10-a),模型的卡方拟合指数/自由度(χ2/df)= 1.5,P=0.105,拟合优度指数(GFI)=0.890,比较拟合指数(CFI)=0.963。结果显示,该模型解释了74.0%的有效磷的变异,其中接种解磷细菌与磷矿粉的粒径均可直接影响土壤有效磷含量,通径系数分别为0.32 和0.25。接种解磷细菌后增加有机酸分泌(0.79),提高磷酸酶活性(0.77),有机酸与磷酸酶促进难溶性磷向活性磷转化(0.44、0.51),对土壤有效磷有直接的正效应(0.36)。有效磷(AP)的标准化总效应通径系数表明(图10-b),磷矿粉粒径(PRP)、解磷细菌(PSB)、有机酸(OA)、磷酸酶(Enzyme)、土壤理化性质(SP)、稳定性磷(Non.labile-P)、中等活性磷(Mod.labile-P)、活性磷(Labile-P)对有效磷的影响分别为0.17、0.77、0.16、0.17、-0.34、0.04、-0.03、0.36。综上分析,接种解磷细菌与添加不同粒径磷矿粉均可直接提高有效磷含量,解磷细菌对有效磷的影响更大,通过分泌有机酸、磷酸酶促进磷库的周转,增加有效磷含量。

图10 解磷细菌与磷矿粉粒径影响有效磷含量的结构方程模型(a)和有效磷的标准化总效应(b)Fig. 10 Structural equation model of phosphate solubilizing bacteria and particle size of phosphate rock powder affecting available phosphorus content (a) and total standardized effect of available phosphorus (b)
3 讨论
3.1 解磷细菌对红壤施用低品位磷矿粉的活化效应及其影响因素
本研究中影响磷有效性的因素主要有磷矿粉粒径、解磷细菌和土壤环境等。其中粒径是影响磷矿粉中磷形态的重要因素之一,同时,也影响解磷细菌对磷矿粉的活化效果。本研究表明,粒径0.05 mm 磷矿粉接种解磷细菌后土壤有效磷含量增幅较高(图1-a、1-b、1-c),可能磷矿粉粒径越小,比表面积越大,与土壤及解磷微生物的接触面积越大,活化效果越好[27]。本研究还发现,不接菌条件下,0.05 mm、0.10 mm 磷矿粉处理中Resin-Pi 含量要显著高于0.18 mm磷矿粉,说明机械活化磷矿粉产生结构缺陷使磷矿中的磷更多处于不稳定态,更多的活性磷如Resin-Pi 被释放,提高磷矿粉中磷灰石的反应活性。但粒径0.18 mm 磷矿粉接种解磷细菌后Resin-Pi 及活性磷含量增幅最大(图4),可能是粒径0.18 mm 的磷矿粉比表面积小,机械活化释放的活性磷较少,接种解磷细菌后更多不稳定性磷被活化,活性磷的增加比例更大,进一步说明接种解磷细菌能够促进外源添加磷矿粉中难溶性磷的活化[28]。磷矿粉施入土壤后其肥效受土壤pH 影响,pH 越低,磷矿粉在土壤中的溶解性越强,难溶性磷越容易释放[29]。解磷细菌在生长代谢过程中释放质子,降低土壤pH。本研究中,与不接种对照对比,接种解磷细菌pH 降低了0.18—0.35 个单位,促进了磷矿粉中难溶性磷的溶解。机械活化磷矿粉可以提高磷矿粉的pH[30]。本研究也表明,在不接菌条件下,整个培养期间,粒径0.05 和0.10 mm 磷矿粉处理的土壤pH 高于粒径0.18 mm 磷矿粉,但粒径0.05 和0.10 mm 磷矿粉接种解磷细菌后,土壤pH 显著高于粒径0.18 mm 磷矿粉。可能因为磷矿粉施入土壤,其分解后释放H2PO4-、F-、SO42-等阴离子置换了土壤胶体表面的OH-基,使土壤pH 升高[4],这两种粒径磷矿粉的比表面积大,与解磷细菌的接触面积大,接种解磷细菌后会增强此过程,导致其pH 增幅较大。
磷在土壤中以不同形态存在,因Tiessen 磷分级法同时适用于酸性、碱性土壤,将土壤磷形态划分为6 种类型,分别为树脂交换态磷、NaHCO3浸提态磷、NaOH 浸提态磷、Dil.HCl 浸提态磷、Conc.HCl 浸提态磷和残留态磷,较为全面地评价土壤无机磷和有机磷有效性,是目前广泛应用的测定土壤各磷形态的方法[31]。各磷形态的生物学意义不同,其中树脂交换态磷和NaHCO3浸提态磷,为易解离、易矿化成能被植物利用吸收的磷,NaOH 浸提态磷属于土壤黏粒或铁铝化合物表面化学吸附的磷组分,Dil.HCl 浸提态磷和Conc.HCl 浸提态磷为磷灰石型磷和闭蓄态磷,与土壤中的Ca 有关,残留态磷是土壤中最稳定的磷,植物较难吸收利用[32]。接种解磷细菌可以改变磷形态,加速土壤中磷组分循环,提高磷素有效性。LIU 等[21]研究表明,解磷细菌会使难溶性磷HCl-P 和Residual-P含量降低,将其转化成活性磷H2O-Pi、NaHCO3-Pi、NaOH-Pi,促进土壤磷素活化。LIU 等[33]发现,接种解磷细菌使活性磷H2O-Pi 含量提高46.6%,稳定性磷Residual-P 含量降低20.0%。本研究结构方程模型结果显示,接种解磷细菌对有效磷的标准化总效应通径系数为0.77,是提高有效磷的主要因素(图10)。在整个培养过程中,接种解磷细菌土壤有效磷含量增加31.1%—53.1%(图1),土壤活性磷库增加15.0%—46.7%,稳定性磷库降低1.2%—12.2%(图3),表明两株解磷细菌均能够分解难溶性磷,且随培养时间延长,接种解磷细菌处理的Resin-Pi 含量逐渐增加,说明培养期间解磷细菌能保持解磷活性,分解难溶性磷,使活性磷含量持续增加[34]。解磷细菌生长过程中利用一部分分解的磷组建其细胞成分,提高微生物量磷含量(图2),随时间延长,一部分微生物量磷又可转化成无机磷,使有效磷含量又升高[35]。
3.2 解磷细菌对红壤施用低品位磷矿粉的活化机制
3.2.1 有机酸对难溶性无机磷与有机磷的影响 碱性土壤中有机酸可以促进土壤磷酸钙盐向有效性较高的磷形态转化[36],酸性土壤中低分子量有机酸作为金属螯合剂,与土壤中的铁铝离子发生螯合[37],促进难溶性的土壤磷酸铁/铝盐的转化,提高可溶性磷酸盐含量。王树起等[38]研究发现添加柠檬酸、草酸使难溶性磷Ca10-P、Al-P 和Fe-P 含量均显著降低,可溶态磷的Ca8-P 含量显著增加,表明低分子量有机酸能与难溶性矿物中的Ca2+、Fe3+和Al3+产生螯合,促进土壤难溶态磷向可溶态磷转化。因解磷细菌种类[39]以及接种土壤环境条件(如pH、养分)等因素[40],解磷细菌分泌的有机酸种类存在差异,一般有葡萄糖酸、苹果酸、乙酸、草酸、丙酸、丁二酸等。据报道,不动杆菌属的解磷细菌通过分泌乙酸、草酸、葡萄糖酸等有机酸[41],减少磷的固定,促进土壤中植物难以利用无机磷的形态向有效性较高的无机磷形态转化[42]。本研究结果表明,接种解磷细菌增加乙酸、草酸、丙酸、丁酸的含量,降低了pH,从而促进稳定性磷酸钙盐(Conc.HCl-Pi)、磷酸铁/铝盐(NaOH-Pi)向活性较高的无机磷形态转化(Resin-Pi、NaHCO3-Pi)。相关性分析发现乙酸与难溶性有机磷Conc.HCl-Po呈显著负相关,乙酸、丙酸与难溶性无机磷Conc.HCl-Pi 呈显著负相关,与活性无机磷Resin-Pi、NaHCO3-Pi 显著正相关(图9-a),表明这两种酸在促进难溶性无机磷的转化中占主导地位,且对难溶性有机磷具有很好的溶解效果,说明这两株菌株能够溶解难溶性无机磷和有机磷。
3.2.2 磷酸酶对难溶性有机磷的影响 解磷细菌产生的磷酸酶可水解C–O–P 酯键从有机磷中释放出无机磷[43],促进难溶性有机磷的分解,转化成利于被植物吸收利用的可溶性无机磷。本研究中接种2 株解磷细菌均增加了酸性和碱性磷酸酶活性(图7),但可能因菌株自身遗传特性等因素[44],两株解磷细菌主要分泌的磷酸酶种类亦不同。结构方程模型显示接种解磷细菌可以促进磷酸酶分泌(0.51),且磷酸酶对活性磷库有显著的正向直接效应(0.56),对难溶性磷库有显著的负向直接效应(-0.43),磷酸酶对有效磷的标准化总效应通径系数为0.17(图10),表明磷酸酶的分泌会影响磷库组分,促进磷库周转,其中酸性磷酸酶与难溶性有机磷Conc.HCl-Po 显著负相关,与活性无机磷Resin-Pi、NaHCO3-Pi 显著正相关(图9-b),碱性磷酸酶与AP、Resin-Pi 含量显著正相关,表明磷酸酶可以促进难溶性有机磷溶解,从而提高无机磷含量。研究发现,酸性土壤主要以酸性磷酸酶为主[45],但在本研究中的碱性磷酸酶活性高,主要是接种解磷细菌显著增加了phoD基因丰度(图8),接种解磷细菌导致phoD编码的微生物群落组成发生变化,富集了phoD基因丰度,进而释放出更多的碱性磷酸酶[46]。HE 等[47]研究发现,接种不动杆菌属解磷细菌增加了与有机磷转化相关的phoD功能基因丰度,提高磷的有效性,这与本研究结果一致。
4 结论
接种解磷细菌能促进磷矿粉中难溶性磷的活化,增加土壤有效磷含量及活性磷的占比,粒径0.05 mm的磷矿粉有效磷增幅最大,但粒径0.18 mm 磷矿粉中活性磷的占比增幅最大,活化效果最好。两株解磷细菌主要通过分泌乙酸、丙酸溶解难溶性有机磷(Conc.HCl-Po)与无机磷(Conc.HCl-Pi、NaOH-Pi),分泌酸性磷酸酶与碱性磷酸酶溶解难溶性有机磷(Conc.HCl-Po),向活性较高的Resin-Pi、NaHCO3-Pi转化,促进磷库的周转,提高磷矿粉在红壤性水稻土中的施用效果。

