黄芪多糖通过减轻免疫炎症抑制病毒性肝炎小鼠肝损伤
陈辰 胡丽霞 (武汉市第一医院,武汉 430000)
病毒性肝炎是指由肝炎病毒感染引起的肝脏病变,是临床上常见的传染病。流行病学资料显示,我国常见的病毒性肝炎病毒类型有甲型、乙型、丙型、丁型和戊型肝炎病毒,其中乙型肝炎病毒最为常见,其发病率约为81.54/100 000,病死率约为0.05/100 000[1]。另有资料指出,病毒性肝炎是肝癌的危险因素,其中慢性乙型肝炎患者罹患肝癌的概率约是健康人群的200倍,可见其危害极为严重[2]。目前临床上针对病毒性肝炎患者主要采用抗病毒、免疫调节、保肝、控制并发症等方案治疗,但仍有部分患者效果不佳[3-4]。黄芪多糖是中药材黄芪的有效成分,可调节机体免疫,且具有抗病毒、抗炎等作用,且有研究证实黄芪多糖注射液可保护乙肝患者的肝功能,但其具体作用机制有待深入探讨[5]。核苷酸结合寡聚化结构域1(NOD1)是一类胞浆内受体,对细胞内的病原体有特异性的识别作用,当细胞内侵入病原体后NOD1表达升高,可激活其下游的受体相互作用蛋白2(RIP2),进而上调核转录因子-κB p65(NF-κB p65),促进NF-κB p65磷酸化(p-NF-κB p65)参与免疫炎症反应,并诱导组织损害[6-7]。有研究证实在病毒性肝炎发生及发展过程中NOD1/RIP2/NF-κB通路被激活,而阻断该通路信号传导有助于减轻免疫炎症反应,抵抗肝损伤[8]。然而黄芪多糖是否可通过该途径保护病毒性肝炎的肝组织结构和肝功能尚不清楚。为探讨该问题,本研究取60只雌性C3H/HeJ小鼠建立病毒性肝炎模型开展动物实验,旨在为黄芪多糖在病毒性肝炎患者中的推广使用奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物与细胞 60只雌性C3H/HeJ小鼠,无特定病原体级,6~8周龄,体质量(21±2) g,购自中国科学院上海实验动物中心,许可证号:SCXK(沪)2020-0001,饲养于小鼠标准代谢笼中,温度21~25 ℃,相对湿度40%~70%,12 h光照/12 h黑暗,自由进食、饮水,适应性喂养1周。L2细胞株(货号:G10561)购自中国上海拜利生物科技有限公司。本研究经武汉大学实验动物中心伦理委员会审批通过,审批号:WDRM动(福)第20200607号。
1.1.2 药物与试剂 黄芪多糖冻干(北京爱迪森生物科技公司,批号:2006134);胸腺肽-α1(上海丰寿生物科技公司,批号:2004128);3型鼠肝炎病毒(MHV-3)(上海雅吉公司,货号:14-36430);磷酸盐缓冲液(PBS)、甲基纤维素、二甲苯溶液、细胞裂解液(美国Sigma公司,批号:200413、200711、200116、200518);苏木素-伊红(HE)染色试剂盒(Solarbio中国公司,批号:2007135);结晶紫染色试剂盒、鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)检测试剂盒、鼠血清肿瘤坏死因子-α(TNF-α)、IL-1β、IL-8检测试剂盒(上海歌凡生物,批号:2003169、2004155、2003128、2006196、2007102、2005119、2005203);最小必需培养基-2(MEM-2)(美国Cellgro公司,货号:G1002159);Trizol试剂(美国Invitrogen公司,货号:15896075);逆转录试剂盒(美国Qiagen公司,货号:208132);NOD1、RIP2、NF-κB p65与内参甘油醛-3-磷酸脱氢酶(GAPDH)引物序列(参照Gene bank信息,利用Primer5.0软件设计,委托深圳晶美生物科技有限公司合成并验证);二甲喹啉法(BCA)蛋白定量试剂盒(美国Sigma公司,批号:200716);兔抗鼠NOD1、RIP2、NF-κB p65、p-NF-κB p65单克隆抗体工作液,羊抗兔NOD1、RIP2、NF-κB p65、p-NF-κB p65多克隆抗体工作液(Abcam中国公司,批号:RS02507A、RS02611C、RS02718A、RS02756A、RM02619B、RM02723B、RM02804A、RM03108C)。
1.1.3 仪器 RM5220型小鼠标准代谢笼(上海玉研生物科技);OptiMair型超净工作台(新加坡易思高);TP-114型电子天平(美国Denver公司);AllegraX-5型台式离心机(美国Beckman coulter公司);MDF-U32V型超低温冰箱(日本Sanyo公司);IN55型CO2培养箱(德国Memmert公司);TONE96型聚合酶链反应(PCR)仪(德国Jena公司);NSW-20PHC型光学显微镜(日本Carton公司);AU480型全自动生化分析仪(美国Beckman coulter公司);Trans-Blot Turbo型转膜仪、PowerPacTM型凝胶电泳仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 建模、分组与给药方法 将60只雌性C3H/HeJ小鼠,采用随机数字表法分为建模组(50只)和正常组(10只)。建模组采用MHV-3腹腔注射建立病毒性肝炎小鼠模型[9],取0.01 mol/L磷酸盐缓冲液(PBS)对MHV-3进行稀释,纯化后取10 pfu/200 μl腹腔注射,每只200 μl,正常组同步腹腔注射等量无菌PBS。2周后建模组和正常组中各随机取1只小鼠断头法处死,迅速剥离肝组织,HE染色观察肝组织病理改变;检测肝组织病毒空斑数[10],计数病毒空斑(同1.2.3)。验证建模成功后,将建模组存活小鼠采用随机数字表法分为模型组、胸腺肽组、黄芪多糖低、中、高剂量组。胸腺肽组腹腔注射胸腺肽-α1 10 μg,黄芪多糖低、中、高剂量组腹腔注射100、200、400 mg/kg黄芪多糖冻干溶于1 ml/100 g体质量的生理盐水中腹腔注射(相当于临床等效剂量、2倍临床等效剂量、4倍临床等效剂量),模型组和正常组予以等量生理盐水腹腔注射,各组均每天给药1次,连续1个月。
1.2.2 肝脏指数、肝功能指标及炎症因子水平检测 各组小鼠均于干预后采用断头法处死,电子天平称取体质量和肝脏质量,肝脏指数(%)=体质量/肝脏质量×100%。另摘取小鼠眼球取外周血,3 500 r/min离心,取上清液采用全自动生化分析仪测定各组肝功能指标(ALT、AST、TBIL)和炎症因子(TNF-α、IL-1β、IL-8)水平。
1.2.3 肝组织HE染色和病毒滴度检测 剥离各组小鼠肝组织,用10%甲醛固定,石蜡包埋,连续4 μm切片,烤片,二甲苯15 min脱蜡2次,梯度乙醇水化(无水乙醇、95%、85%、75%乙醇各3 min),蒸馏水水化3 min。苏木素染色10 min,流水冲洗后盐酸乙醇分化,流水蓝化,伊红复染1 min,梯度乙醇脱水(75%、85%、95%乙醇和无水乙醇各1 min),二甲苯透明后封固,观察肝组织病理变化。检测肝组织病毒空斑数[10],取肝组织匀浆,用MEM-2培养基梯度稀释上清液做滴度分析,另于24孔板内培养基培养L2细胞至汇合率达90%。将L2细胞陈旧培养基弃去,用PBS洗涤,将50 μl稀释好的肝脏组织上清液均匀铺于细胞层,室温下无菌操作台内每10~15 min混合1次,共3次,促使细胞与病毒充分接触。将2%甲基纤维素取出与培养液等体积比例混合,500 μl/孔细胞均匀铺在被病毒感染的细胞层,待其凝固后转移细胞培养板至CO2培养箱中37 ℃ 16~20 h,取出细胞并将上层甲基纤维素-培养层挑出,结晶紫染色,5 min后自来水冲洗,计数病毒空斑。
1.2.4 肝组织NOD1、RIP2、NF-κB p65 mRNA表达 采用实时逆转录PCR法检测肝组织上述基因表达。将肝组织液氮研磨,加入1 ml 预冷Trizol试剂混匀后提取RNA,调整浓度为0.5 μg/μl,合成互补的DNA。设计并合成PCR反应引物,其中NOD1正向引物:5'-GAACTCGAGAATGAAATGAAATTAAATATGG-3',反向引物:5'-GAACCGCGGACTCATTCATTCAGGGAAACTGG-3',预计产物长度186 bp;RIP2:正向引物:5'-CTGAATATCCTGATGTTGCTTGGC-3',反向引物:5'-TTGCTACTTCGTGACTGTGAGAG-3',预计产物长度198 bp;NF-κB p65:正向引物:5'-AGTTGAGGGGACTTCCCAGG-3',反向引物:5'-CCTGGGAAAGTCCCCTCAACT-3',预计产物长度210 bp;GAPDH:正向引物:5'-GACCACAGTCCATGCCATCAC-3',反向引物:5'-ACGCCTGCTTCACCACCTT-3',预计产物长度140 bp。扩增反应:94 ℃5 min,40次循环,94 ℃ 15 s、60 ℃ 45 s,54 ℃ 10 min。设置阴性对照,即加入不含扩增基因的模板PCR反应。60 ℃测定荧光值绘制熔解曲线,2-ΔΔCt计算。
1.2.5 肝组织NOD1、RIP2、NF-κB p65蛋白表达及p-NF-κB p65水平 采用免疫印迹法检测肝组织上述蛋白表达及p-NF-κB p65水平。取100 mg肝脏组织匀浆后加入细胞裂解液1 ml,提取总蛋白后定量。凝胶分离50 μg蛋白的抽提物,电泳后将其转膜,并于洗膜后加入兔抗鼠单克隆抗体(稀释比例1∶1 000),4 ℃过夜。再次洗膜后加入酶标记的羊抗兔多克隆抗体工作液(稀释比例1∶2 500),37 ℃ 2 h。再次洗膜后压片,以Quantity one软件分析目的蛋白条带灰度值与内参条带灰度值,计算二者的比值;免疫组化法检测肝组织上述蛋白表达及p-NF-κB p65水平,取100 mg肝脏组织,经0.1 mol/L甲醛溶液浸泡24 h固定。石蜡包埋、修整,梯度浓度乙醇脱水(70%乙醇溶液6 h→80%乙醇溶液6 h→95%乙醇溶液Ⅰ12 h→95%乙醇溶液Ⅱ 12 h→100%乙醇Ⅰ1.5 h→100%乙醇Ⅱ 1.5 h)。柠檬酸0.1 g+柠檬酸三钠0.75 g+200 ml蒸馏水对组织块进行抗原热修复,连续切片(层厚4 μm),65 ℃、24 h烤片。二甲苯15 min 3次,乙醇水化,冲洗5 min,3%过氧化氢溶液孵育(室温15 min)。37 ℃封闭孵育0.5 h,滴加一抗,冲洗5 min 3次,滴加二抗(1∶2 000),冲洗5 min×3次。二氨基联苯胺显色,苏木精复染,树胶封片。Image J软件分析各蛋白的积分光密度(IOD)。
1.3 统计学方法 采用SPSS24.0软件进行统计学分析,计量资料符合正态分布,采用±s描述,并用单因素方差分析和SNK-q检验,两样本比较采用成组t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 模型验证及各组样本量、结局情况 正常组和建模组小鼠肝组织HE染色显示,正常组肝细胞索以中央静脉为中心向四周放射,肝小叶结构清晰,肝细胞联系紧密且核大、核圆,核仁明显,胞质丰富,汇管区结构清晰;建模组肝细胞明显肿胀,且有水样变性,胞质疏松,有散在点状坏死和淋巴细胞浸润,见图1。
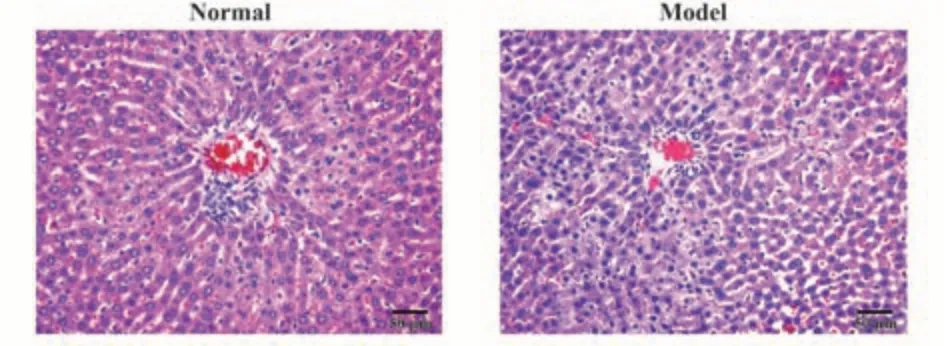
图1 正常组与建模组小鼠肝组织病理改变(HE染色,×200)Fig.1 Pathological changes of liver tissue in normal group and modeling group (HE staining, ×200)
正常组小鼠肝组织病毒空斑数为0,建模组为4.20×104个/g),差异有统计学意义(t=148.975,P<0.001)。根据HE染色和肝组织病毒空斑数对比结果证实建模组模型建立成功,其中正常组余9只小鼠,建模组有49只存活小鼠,将其采用随机数字表分为模型组(10只)、胸腺肽组(9只)、黄芪多糖低、中、高剂量组(各10只),给药期间均无小鼠死亡。
2.2 干预后各组小鼠肝脏指数、血清ALT、AST和TBIL水平比较 干预后各组小鼠肝脏指数、血清ALT、AST和TBIL水平比较差异均有统计学意义(P<0.05);与正常组比较,模型组肝脏指数、血清ALT、AST和TBIL水平均升高(P<0.05);与模型组比较,胸腺肽组、黄芪多糖各剂量组肝脏指数、血清ALT、AST和TBIL水平均降低(P<0.05);与胸腺肽组比较,黄芪多糖低剂量组肝脏指数、血清ALT、AST和TBIL水平均升高(P<0.05),黄芪多糖高剂量组肝脏指数、血清ALT、AST和TBIL水平均降低(P<0.05),见表1。
表1 干预后各组小鼠肝脏指数、血清ALT、AST和TBIL水平比较(±s)Tab.1 Comparison of liver indexes, serum ALT, AST and TBIL levels of mice in each group after intervention (±s)
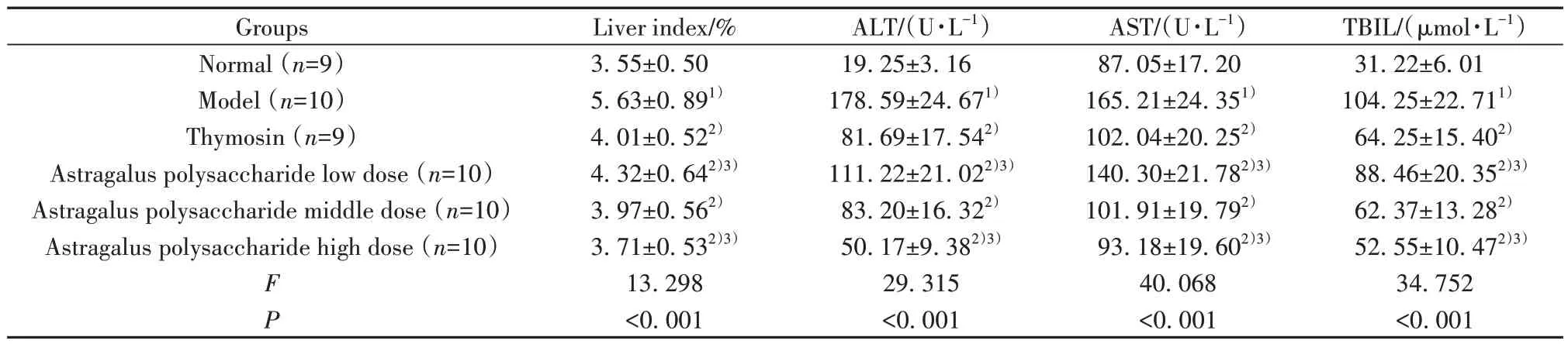
表1 干预后各组小鼠肝脏指数、血清ALT、AST和TBIL水平比较(±s)Tab.1 Comparison of liver indexes, serum ALT, AST and TBIL levels of mice in each group after intervention (±s)
Note:Compared with normal group, 1)P<0.05; compared with model group, 2)P<0.05;compared with thymosin group, 3)P<0.05.
TBIL/(μmol·L-1)31.22±6.01 104.25±22.711)64.25±15.402)88.46±20.352)3)62.37±13.282)52.55±10.472)3)34.752<0.001 Groups Normal (n=9)Model (n=10)Thymosin (n=9)Astragalus polysaccharide low dose (n=10)Astragalus polysaccharide middle dose (n=10)Astragalus polysaccharide high dose (n=10)F P Liver index/%3.55±0.50 5.63±0.891)4.01±0.522)4.32±0.642)3)3.97±0.562)3.71±0.532)3)13.298<0.001 ALT/(U·L-1)19.25±3.16 178.59±24.671)81.69±17.542)111.22±21.022)3)83.20±16.322)50.17±9.382)3)29.315<0.001 AST/(U·L-1)87.05±17.20 165.21±24.351)102.04±20.252)140.30±21.782)3)101.91±19.792)93.18±19.602)3)40.068<0.001
2.3 干预后各组小鼠血清TNF-α、IL-1β和IL-8水平比较 干预后各组小鼠血清TNF-α、IL-1β和IL-8水平比较差异均有统计学意义(P<0.05);与正常组比较,模型组血清TNF-α、IL-1β和IL-8水平均升高(P<0.05);与模型组比较,胸腺肽组、黄芪多糖各剂量组血清TNF-α、IL-1β和IL-8水平均降低(P<0.05);与胸腺肽组比较,黄芪多糖低剂量组血清TNF-α、IL-1β和IL-8水平均升高(P<0.05),黄芪多糖高剂量组血清TNF-α、IL-1β和IL-8水平均降低(P<0.05),见表2。
表2 干预后各组小鼠血清TNF-α、IL-1β和IL-8水平比较(±s)Tab.2 Serum TNF-α, IL-1β and IL-8 levels of mice in each group after intervention (±s)
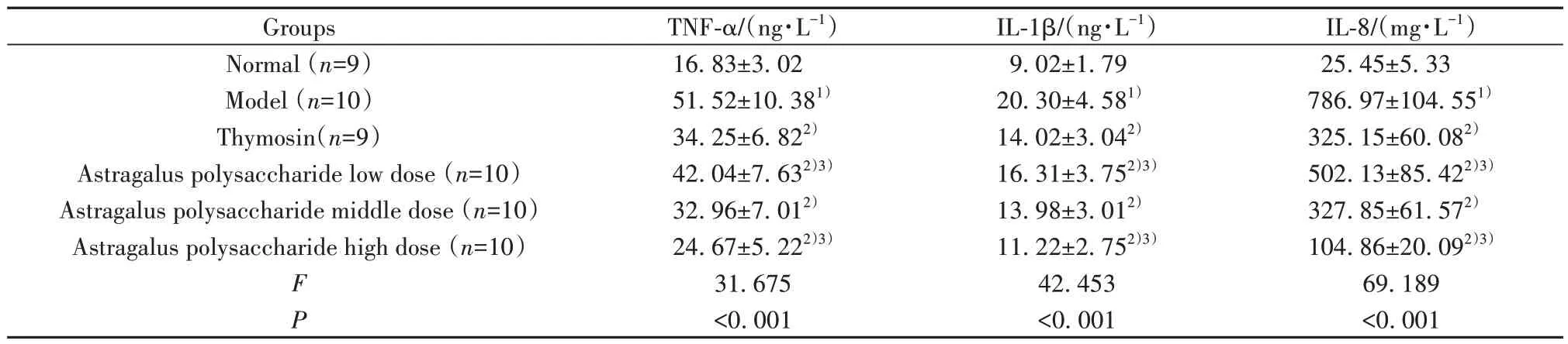
表2 干预后各组小鼠血清TNF-α、IL-1β和IL-8水平比较(±s)Tab.2 Serum TNF-α, IL-1β and IL-8 levels of mice in each group after intervention (±s)
Note:Compared with normal group, 1)P<0.05; compared with model group, 2)P<0.05; compared with thymosin group, 3)P<0.05.
IL-8/(mg·L-1)25.45±5.33 786.97±104.551)325.15±60.082)502.13±85.422)3)327.85±61.572)104.86±20.092)3)69.189<0.001 Groups Normal (n=9)Model (n=10)Thymosin(n=9)Astragalus polysaccharide low dose (n=10)Astragalus polysaccharide middle dose (n=10)Astragalus polysaccharide high dose (n=10)F P TNF-α/(ng·L-1)16.83±3.02 51.52±10.381)34.25±6.822)42.04±7.632)3)32.96±7.012)24.67±5.222)3)31.675<0.001 IL-1β/(ng·L-1)9.02±1.79 20.30±4.581)14.02±3.042)16.31±3.752)3)13.98±3.012)11.22±2.752)3)42.453<0.001
2.4 干预后各组小鼠肝组织病理改变比较 干预后正常组小鼠肝组织HE染色表现同2.1;模型组肝细胞有严重水肿,且可见大量点状坏死灶,有严重肝索排列紊乱、肝窦挤压变窄、炎症浸润等表现;黄芪多糖低剂量组肝细胞有明显水肿,有部分点状坏死灶,肝索排列紊乱、肝窦挤压变窄等表现;黄芪多糖中剂量组和胸腺肽组肝细胞有水肿,可见少部分点状坏死灶,有轻微肝索排列紊乱、肝窦挤压变窄等表现;黄芪多糖高剂量组少部分肝细胞水肿,极少坏死,肝细胞基本联系紧密且胞质丰富,见图2。

图2 干预后各组小鼠肝组织病理改变(HE染色,×200)Fig.2 Pathological changes of liver tissue of mice in each group after intervention (HE staining, ×200)
2.5 干预后各组小鼠肝组织病毒空斑数比较 干预后各组小鼠肝组织病毒空斑数比较差异有统计学意义(P<0.05);与正常组比较,模型组肝组织病毒空斑数增多(P<0.05);与模型组比较,胸腺肽组、黄芪多糖剂量组肝组织病毒空斑数均降低(P<0.05);与胸腺肽组比较,黄芪多糖低剂量组肝组织病毒空斑数增多(P<0.05),黄芪多糖高剂量组肝组织病毒空斑数减少(P<0.05),见表3。
表3 干预后各组小鼠肝组织病毒空斑数比较(±s,1×104个/g)Tab.3 Comparison of viral plaque number in liver tissue of mice in each group after intervention (±s,1×104/g)
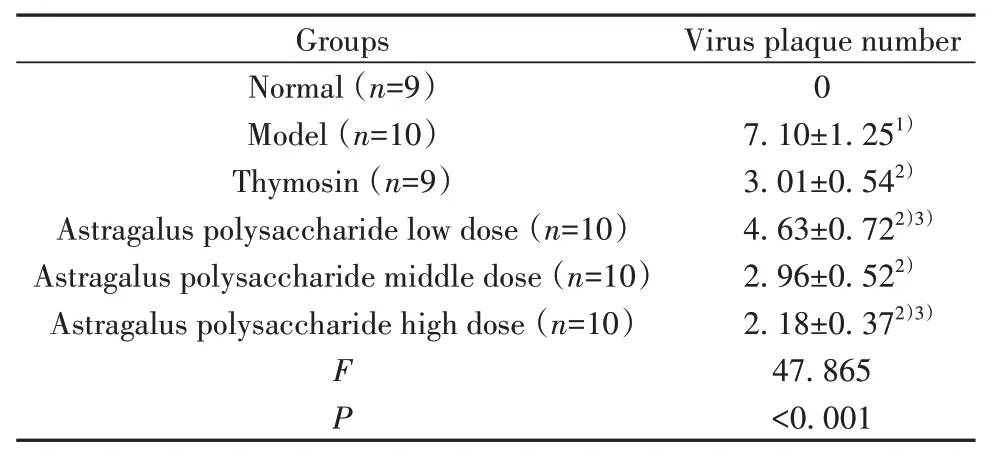
表3 干预后各组小鼠肝组织病毒空斑数比较(±s,1×104个/g)Tab.3 Comparison of viral plaque number in liver tissue of mice in each group after intervention (±s,1×104/g)
Note:Compared with normal group, 1)P<0.05; compared with model group, 2)P<0.05;compared with thymosin group, 3)P<0.05.
Groups Virus plaque number Normal (n=9)Model (n=10)Thymosin (n=9)Astragalus polysaccharide low dose (n=10)Astragalus polysaccharide middle dose (n=10)Astragalus polysaccharide high dose (n=10)0 7.10±1.251)3.01±0.542)4.63±0.722)3)2.96±0.522)2.18±0.372)3)47.865<0.001 F P
2.6 干预后各组小鼠肝组织NOD1、RIP2、NF-κB p65 mRNA表达比较 干预后各组小鼠肝组织NOD1、RIP2、NF-κB p65 mRNA表达比较差异均有统计学意义(P<0.05);与正常组比较,模型组肝组织NOD1、RIP2、NF-κB p65 mRNA表达均升高(P<0.05);与模型组比较,胸腺肽组、黄芪多糖剂量组肝组织NOD1、RIP2、NF-κB p65 mRNA表达均降低(P<0.05);与胸腺肽组比较,黄芪多糖低剂量组肝组织NOD1、RIP2、NF-κB p65 mRNA表达均升高(P<0.05),黄芪多糖高剂量组肝组织NOD1、RIP2、NFκB p65 mRNA表达均降低(P<0.05),见表4。
表4 干预后各组小鼠肝组织NOD1、RIP2、NF-κB p65 mRNA表达比较(±s)Tab.4 Comparison of mRNA expressions of NOD1,RIP2 and NF-κB p65 in liver tissues of mice in each group after intervention (xˉ±s)
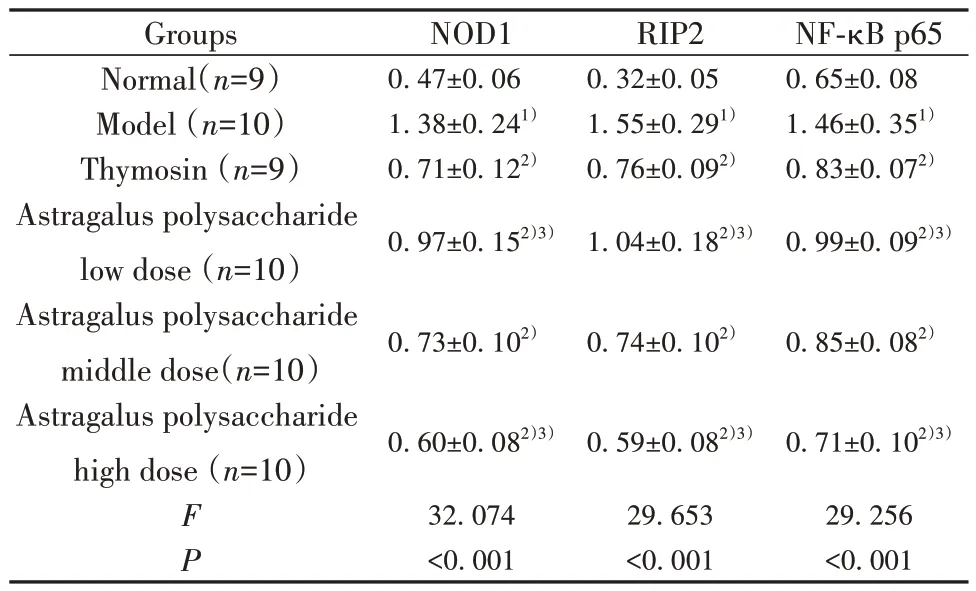
表4 干预后各组小鼠肝组织NOD1、RIP2、NF-κB p65 mRNA表达比较(±s)Tab.4 Comparison of mRNA expressions of NOD1,RIP2 and NF-κB p65 in liver tissues of mice in each group after intervention (xˉ±s)
Note:Compared with normal group, 1)P<0.05; compared with model group, 2)P<0.05;compared with thymosin group, 3)P<0.05.
Groups Normal(n=9)Model (n=10)Thymosin (n=9)Astragalus polysaccharide low dose (n=10)Astragalus polysaccharide middle dose(n=10)Astragalus polysaccharide high dose (n=10)NOD1 0.47±0.06 1.38±0.241)0.71±0.122)0.97±0.152)3)RIP2 0.32±0.05 1.55±0.291)0.76±0.092)1.04±0.182)3)NF-κB p65 0.65±0.08 1.46±0.351)0.83±0.072)0.99±0.092)3)0.73±0.102)0.74±0.102)0.85±0.082)0.71±0.102)3)29.256<0.001 F P 0.60±0.082)3)32.074<0.001 0.59±0.082)3)29.653<0.001
2.7 干预后各组小鼠肝组织NOD1、RIP2、NF-κB p65蛋白表达、p-NF-κB p65水平比较 干预后各组小鼠肝组织NOD1、RIP2、NF-κB p65蛋白表达、p-NF-κB p65水平比较差异均有统计学意义(P<0.05);与正常组比较,模型组肝组织NOD1、RIP2、NF-κB p65蛋白表达、p-NF-κB p65水平均升高(P<0.05);与模型组比较,胸腺肽组、黄芪多糖剂量组肝组织NOD1、RIP2、NF-κB p65蛋白表达、p-NF-κB p65水平均降低(P<0.05);与胸腺肽组比较,黄芪多糖低剂量组肝组织NOD1、RIP2、NF-κB p65蛋白表达、p-NF-κB p65水平均升高(P<0.05),黄芪多糖高剂量组肝组织NOD1、RIP2、NF-κB p65蛋白表达、p-NF-κB p65水平均降低(P<0.05),见图3、图4、表5、表6。
表5 干预后各组小鼠肝组织NOD1、RIP2、NF-κB p65蛋白表达、p-NF-κB p65水平比较(±s)Tab.5 Comparison of NOD1, RIP2 and NF-κB p65 protein expressions and p-NF-κB p65 levels in liver tissue of mice in each group after intervention (±s)
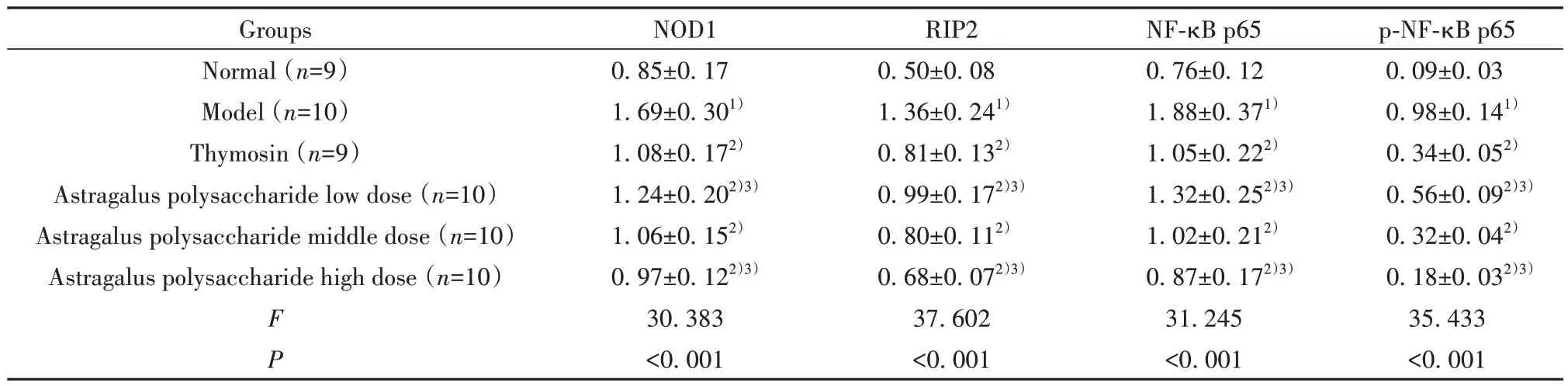
表5 干预后各组小鼠肝组织NOD1、RIP2、NF-κB p65蛋白表达、p-NF-κB p65水平比较(±s)Tab.5 Comparison of NOD1, RIP2 and NF-κB p65 protein expressions and p-NF-κB p65 levels in liver tissue of mice in each group after intervention (±s)
Note:Compared with normal group, 1)P<0.05; compared with model group, 2)P<0.05;compared with thymosin group, 3)P<0.05.
Groups Normal (n=9)Model (n=10)Thymosin (n=9)Astragalus polysaccharide low dose (n=10)Astragalus polysaccharide middle dose (n=10)Astragalus polysaccharide high dose (n=10)NF-κB p65 p-NF-κB p65 0.09±0.03 0.98±0.141)0.34±0.052)0.56±0.092)3)0.32±0.042)0.18±0.032)3)35.433<0.001 F P NOD1 0.85±0.17 1.69±0.301)1.08±0.172)1.24±0.202)3)1.06±0.152)0.97±0.122)3)30.383<0.001 RIP2 0.50±0.08 1.36±0.241)0.81±0.132)0.99±0.172)3)0.80±0.112)0.68±0.072)3)37.602<0.001 0.76±0.12 1.88±0.371)1.05±0.222)1.32±0.252)3)1.02±0.212)0.87±0.172)3)31.245<0.001
表6 干预后各组小鼠肝组织NOD1、RIP2、NF-κB p65蛋白、p-NF-κB p65水平IOD比较(±s)Tab.6 Comparison of IOD of NOD1, RIP2 and NF-κB p65 protein comparisons and p-NF-κB p65 levels in liver tissue of mice in each group after intervention (±s)
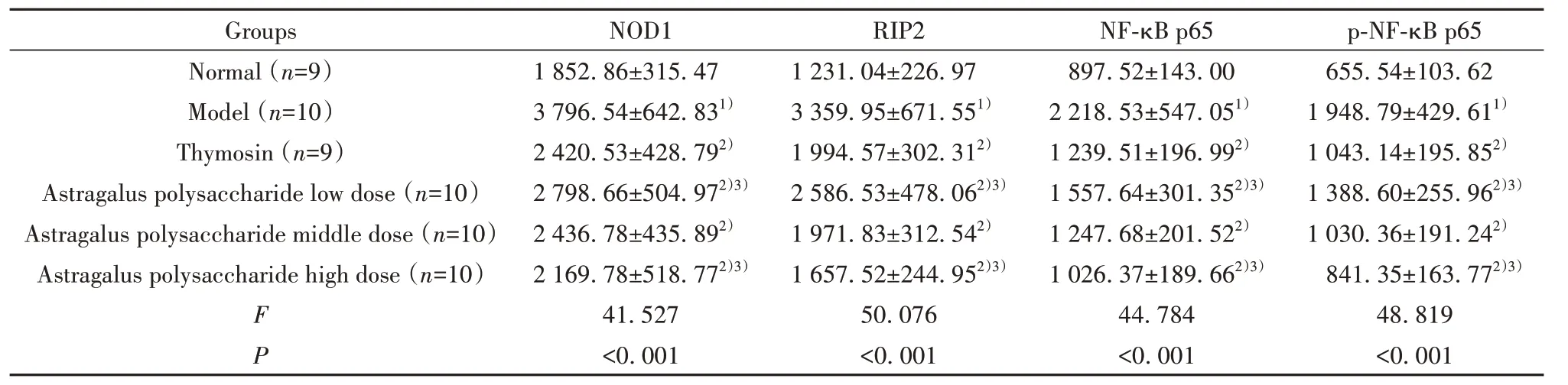
表6 干预后各组小鼠肝组织NOD1、RIP2、NF-κB p65蛋白、p-NF-κB p65水平IOD比较(±s)Tab.6 Comparison of IOD of NOD1, RIP2 and NF-κB p65 protein comparisons and p-NF-κB p65 levels in liver tissue of mice in each group after intervention (±s)
Note:Compared with normal group, 1)P<0.05; compared with model group, 2)P<0.05;compared with thymosin group, 3)P<0.05.
p-NF-κB p65 Groups NOD1 RIP2 NF-κB p65 655.54±103.62 1 948.79±429.611)1 043.14±195.852)1 388.60±255.962)3)1 030.36±191.242)841.35±163.772)3)48.819<0.001 Normal (n=9)Model (n=10)Thymosin (n=9)Astragalus polysaccharide low dose (n=10)Astragalus polysaccharide middle dose (n=10)Astragalus polysaccharide high dose (n=10)F P 1 852.86±315.47 3 796.54±642.831)2 420.53±428.792)2 798.66±504.972)3)2 436.78±435.892)2 169.78±518.772)3)41.527<0.001 1 231.04±226.97 3 359.95±671.551)1 994.57±302.312)2 586.53±478.062)3)1 971.83±312.542)1 657.52±244.952)3)50.076<0.001 897.52±143.00 2 218.53±547.051)1 239.51±196.992)1 557.64±301.352)3)1 247.68±201.522)1 026.37±189.662)3)44.784<0.001

图3 干预后各组小鼠肝组织NOD1、RIP2、NF-κB p65蛋白表达、p-NF-κB p65水平检测Fig.3 Detection of NOD1, RIP2 and NF-κB p65 protein expressions and p-NF-κB p65 levels in liver tissues of mice in each group after intervention
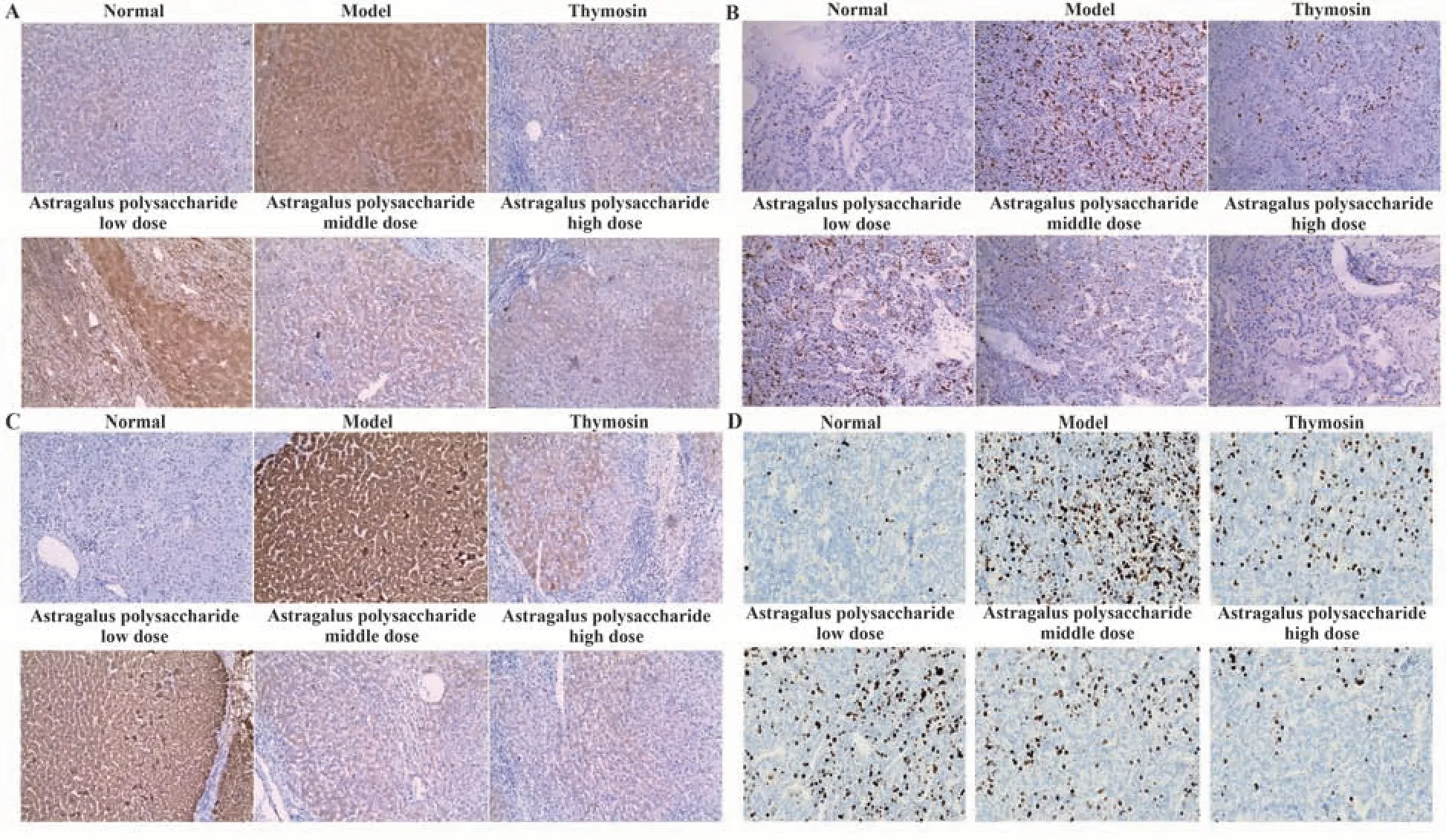
图4 干预后各组小鼠肝组织NOD1、NF-κB p65、RIP2蛋白及p-NF-κB p65水平检测(免疫组化法,×100)Fig.4 Detection of NOD1 protein,NF-κB p65 protein,RIP2 protein and p-NF-κB p65 levels in liver tissue of mice in each group after intervention (immunohistochemical method, ×100)
3 讨论
病毒性肝炎不仅可导致肝组织炎症损伤,还可发展为肝硬化、肝功能衰竭甚至是肝细胞癌。然而目前常用的抗病毒药物虽然能抑制或杀灭病毒、减轻对肝组织造成的损伤,但其效果仍有改进空间。黄芪多糖是中药材黄芪提取物的主要成分,具有抗病毒、调节机体免疫、保护肝脏等作用[11-12],因此本研究重点探讨该药物对病毒性肝炎小鼠的作用及分子机制。
当病毒侵入机体后,巨噬细胞与树突状细胞等可快速识别病原微生物并吞噬、消灭,并且同时可产生干扰素及相关的细胞因子,将病毒信息加工处理后传递给淋巴细胞,进而激活免疫应答,增强对病毒的抵抗作用[13]。然而在病毒感染情况下免疫细胞可产生干扰素和炎症细胞因子,包括TNF-α、IL-1β和IL-8等促炎症因子,诱发炎症反应,若免疫激活状态失控则可产生大量的干扰素和炎症细胞因子,导致炎症性组织损害。有报道指出,在病毒性肝炎小鼠可见肝组织炎症浸润和点状坏死灶,且肝细胞有肿胀、变性表现[14],本研究结果与该报道相符,证实病毒感染可导致肝组织炎症损伤,也提示抑制免疫炎症反应是减轻病毒性肝炎肝损伤的重要途径。
MHV-3腹腔注射是常用的病毒性肝炎建模方法,该病毒株稳定,毒力强,可引起小鼠病毒性肝炎炎症损伤[15]。C3H/HeJ小鼠存在Toll样受体4(TLR4)基因自发性突变,对脂多糖无反应[16]。而TLR4可与肝炎病毒相互作用引起组织炎症,因此本研究选用MHV-3腹腔注射方法对C3H/HeJ雌鼠建立病毒性肝炎模型,且获得了与吴婷等[17]学者一致的结果,为后续实验的顺利开展奠定了基础。
本研究中干预后模型组小鼠肝脏指数、肝功能、炎症因子水平和肝组织病毒空斑数均高于正常组,证实病毒性肝炎小鼠建模成功,肝组织中有大量MHV-3病毒,且可造成炎症反应并引起肝功能损害,模型组肝组织病理较正常组严重改变,表明该建模方法可导致肝组织损害。此外,本研究中胸腺肽组和黄芪多糖剂量组肝脏指数、肝功能、炎症因子水平和肝组织病毒空斑数均低于模型组,肝组织病理也较模型组减轻,且黄芪多糖高剂量组的效果与作用均最佳,可知胸腺肽和黄芪多糖均可保护病毒性肝炎小鼠的肝功能,减轻炎症反应和肝组织病理改变,推测与肝组织中病毒感染和复制受到抑制有直接关系。黄芪多糖增强机体免疫力、抗病毒的作用已经得到既往报道的认可[18-20]。有研究指出,黄芪多糖可诱导产生干扰素,促进抗体形成,增强机体免疫功能[21];另有报道表明,黄芪多糖主要是通过提高非特异性抗体水平增强机体免疫力从而发挥抗病毒作用,这表明黄芪多糖很可能通过抑制病毒性肝炎小鼠免疫激活导致的炎症反应减轻肝组织损伤[22]。既往报道显示,黄芪多糖可降低免疫性肝损伤小鼠血清炎症因子TNF-α水平并改善肝功能指标,本研究与该报道相符[23];另有研究显示,黄芪多糖能够通过调节免疫性肝损伤小鼠脾脏淋巴细胞表面CD28、CD80表达调节机体免疫功能[24]。本研究在此基础上探讨了黄芪多糖对病毒性肝炎小鼠可能的免疫效应调节机制,具有一定的创新性。另外胸腺肽属于胸腺组织分泌的具有生理活性的多肽,也是目前常用的免疫调节剂,有报道证实胸腺肽-α1可调节机体免疫,并改善慢性乙型肝炎患者的肝功能,推测该药物很可能通过调节机体免疫,抑制炎症反应,进而减轻肝损伤发挥改善肝功能的作用[25]。故而本研究选用胸腺肽-α1作为阳性对照药物。
病毒感染所致的免疫激活进而引发肝组织炎症损伤是一个十分复杂的病理过程,其中NOD1/RIP2/NF-κB通路参与并发挥重要作用。NODs的寡聚化被认为是受体激活与信号传递的表现,无论是直接识别病毒感染或病毒感染间接导致的NOD1被激活均可引起免疫炎症反应。烟曲霉菌感染可激活NOD1,进而引起气管上皮和肺组织上皮炎症浸润与组织损害,本研究也发现MHV-3感染可导致肝组织NOD1表达上调。RIP2位于NOD1的下游,属于一种丝氨酸/苏氨酸激酶,对半胱氨酸蛋白酶有募集作用,并且能够与NF-κB通路相互介导,参与细胞变性、凋亡等[26-27]。有报道证实,敲除小鼠胚胎纤维原细胞中RIP2,NOD1激动剂并不能激活NF-κB,这就说明RIP2是NOD1和NF-κB的桥梁,也是NOD1信号通路中信息转入的关键分子[28]。RIP2被激活后可对IκB激酶家族产生诱导作用,上调NF-κB表达,以NF-κB p65为代表的分子大量活化,p-NF-κB p65水平升高,启动相关炎症基因的表达,抵御致病微生物。然而NF-κB持续激活同时也会诱导机体释放大量的TNF-α、IL-1β和IL-8等因子,导致组织炎症浸润和功能损伤,有研究证实NF-κB表达升高甚至可导致器官衰竭,且与炎症反应有紧密关系[29]。因此在病毒性肝炎治疗时抑制NOD1/RIP2/NF-κB通路的信号传导有利于减轻免疫激活所致的炎症反应引发的肝组织损伤。本研究结果中胸腺肽组和黄芪多糖剂量组肝组织NOD1、RIP2、NF-κB p65 mRNA与蛋白表达,p-NF-κB p65水平均低于模型组,而模型组则均高于正常组,与上述分析一致,推测可能因为黄芪多糖是通过抑制NOD1/RIP2/NFκB通路减轻病毒性肝炎小鼠肝损伤的,且高剂量的黄芪多糖效果更理想,提示该药物在此方面有理想的开发价值。
对C3H/HeJ雌鼠采用MHV-3腹腔注射法可建立病毒性肝炎模型,且可见肝组织病理改变和病毒侵害;胸腺肽和黄芪多糖均可降低肝脏指数,改善肝功能,减轻炎症反应和肝损伤,减少病毒空斑数;胸腺肽和黄芪多糖可能通过抑制NOD1/RIP2/NF-κB通路减轻病毒性肝炎小鼠肝损伤;黄芪多糖的作用呈剂量依赖性,中剂量黄芪多糖作用与胸腺肽相当,而高剂量黄芪多糖作用更理想。

