美沙拉秦介导TGF-β1/Smad信号通路减轻脂多糖诱导的结肠上皮细胞炎症及凋亡
侯静 刘加宁 冯如 陆伟 王云 苏峰 (.徐州医科大学附属宿迁医院消化内科,宿迁 3800;.徐州医科大学附属宿迁医院药学部,宿迁 3800)
溃疡性结肠炎(ulcerative colitis,UC)是一类慢性炎症性复发性疾病,表现为结肠、直肠黏膜及黏膜下层持续性、融合性炎症反应,临床表现为腹痛、腹泻和便血,严重者可发展为结直肠癌[1]。UC发病较为复杂,主要与地域、遗传、环境、饮食和自身免疫等多种因素相关,随着社会经济不断发展,全球UC发病率持续上升,且研究发现UC可能参与结直肠癌发生及发展,但具体发病机制尚不清楚[2-3]。目前UC主要治疗手段包括药物治疗和手术治疗,治疗初期通常选择药物治疗,而美沙拉秦(Mesalazine,MS)肠溶片是常见UC治疗西药,主要成分为5-氨基水杨酸,具有非甾体类抗炎药效果[4];重症UC患者则选择手术治疗,过早手术患者会失去保留结肠的机会,过晚又会错过最佳手术时间。MS治疗UC具有显著效果,但MS预防UC的临床证据尚需实验研究证实,且MS治疗UC的作用机制尚未阐明。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6及可溶性白细胞介素-2受体(soluble interleukin-2 receptor,sIL-2R)作为被广泛研究的炎症因子,可促进白细胞活化,使肠道黏膜炎症反应持续[5-7]。MAVROPOULOU等[8]证明克罗恩病(Crohn's disease,CD)患者血清IL-6水平和UC患者sIL-2R水平可作为非侵入性生物标志物识别疾病活动状态。
多项研究表明结肠上皮细胞与UC发生相关,其中增殖、凋亡与结肠生长息息相关[9]。TGF-β1/Smad信号通路在UC进程中发挥重要作用,且该通路可作为UC治疗药物靶点[10-11]。MS是否通过介导TGF-β1/Smad通路调节UC的报道较少。因此本研究为探求MS介导的可能机制,构建体外UC细胞模型,研究MS对LPS诱导的结肠上皮细胞生长、增殖和凋亡的影响,明确MS对炎症因子TNF-α、IL-6和sIL-2R表达及TGF-β1/Smad信号通路的调控作用,从分子角度说明MS对UC的治疗作用,为MS临床治疗UC提供重要依据。
1 材料与方法
1.1 材料 人结肠上皮细胞NCM-460购自河南省工业微生物菌种工程技术研究中心;LPS、MS(纯度≥99%,上海源叶生物科技有限公司);胎牛血清、DMEM-H培养基(美国Gibco公司);Hoechst 33258染色试剂盒(江苏凯基生物技术股份有限公司);ELISA试剂盒(北京贝博生物科技有限公司);EdU细胞增殖检测试剂盒(上海碧云天生物技术有限公司);二喹啉甲酸(bicinchoninic acid,BCA)蛋白试剂盒(英国Abcam公司);鼠抗人TGF-β1、Smad2、Smad3、Smad7、p-Smad2、p-Smad3和β-actin抗体(一抗)、碱性磷酸酶标记的山羊抗鼠IgG(二抗)(美国CST公司);MF52-N型倒置荧光显微镜(广州市明美光电技术有限公司);Multiskan FC酶标仪(美国Thermo公司);OI 1000型凝胶成像系统(广州光仪生物科技有限公司)。
1.2 方法
1.2.1 KEGG信号通路富集分析 使用KEGG数据库(https://www.kegg.jp/pathway/)对炎症性肠病细胞相关通路进行分析,物种选择“human”。
1.2.2 人结肠上皮细胞NCM-460培养 人结肠上皮细胞NCM-460在37 ℃、5%CO2条件下培养,培养基选用DMEM-H培养基(补加10%胎牛血清),待细胞贴壁达80%以上时进行传代,取第4代对数生长期细胞用于后续实验。
1.2.3 细胞分组与给药 细胞分为Con组、LPS组、MS组(0.1、0.2、0.4 mg/L MS)和inhibitor组,Con组细胞不加药物干预,LPS组加入1 mg/L LPS诱导24 h构建UC细胞模型,MS组分别采用0.1、0.2、0.4 mg/L MS干预LPS组细胞,inhibitor组在0.2 mg/L MS组基础上添加10 μmol/L LY2109761进行干预,每组3个重复。
1.2.4 细胞形态学观察 将各组药物干预24 h的NCM-460细胞置于倒置显微镜下观察形态并拍照记录。
1.2.5 EdU法测定NCM-460细胞增殖率 取各组干预48 h的细胞进行EdU处理,去除培养液,0.5 ml 4%多聚甲醛室温固定15 min,0.5 ml 3%BSA洗涤3次;0.5 ml 0.3%TritonX-100室温去除BSA 10 min,BSA洗涤3次;12孔板中每孔加200 μl Click反应液(现配现用),室温避光孵育30 min,3%BSA洗涤3次去除Click反应液;每孔加入0.5 ml Hoechst,室温避光孵育10 min;3%BSA洗涤3次去除Hoechst;装片,荧光显微镜拍照,Image J软件处理图片。以EdU阳性染色细胞(红色)占总细胞(蓝色)的百分比表示细胞增殖率。
1.2.6 Hoechst 33258染色测定NCM-460细胞凋亡 PBS缓慢清洗药物干预24 h的NCM-460细胞2次,5 min/次;4%多聚甲醛(现用现配) 4 ℃固定10 min;PBS洗涤3次(5 min/次),5 mg/L Hoechst 33258染色液染色10 min,PBS清洗3次(5 min/次),封固后荧光显微镜观察细胞凋亡情况,随机选择3个视野拍照。
1.2.7 ELISA试剂盒检测NCM-460细胞培养液中炎症因子水平 收集各组干预24 h后的细胞上清,分别按照TNF-α、IL-6和sIL-2R ELISA试剂盒说明书操作,测定炎症因子TNF-α、IL-6和sIL-2R释放量。细胞培养液离心收集上清,分别将100 μl标准品及待测上清加入酶标板,37 ℃孵育2 h,弃上清;加100 μl生物素化抗体工作液和酶结合物工作液37 ℃孵育1 h;洗涤后用90 μl底物溶液37 ℃孵育10 min;加入50 μl终止液,5 min内测量各孔450 nm处OD值。
1.2.8 Western blot测定NCM-460细胞中TGF-β1/Smad通路相关蛋白表达 干预24 h后,收集各组细胞于RIPA液冰上裂解,4 ℃、12 000 r/min离心20 min,取上清进行蛋白变性,制胶,上样,SDS-PAGE凝胶电泳,100 mA恒流转PVDF膜,5%脱脂牛奶封闭2 h,参照抗体说明加入一定比例稀释的一抗(TGF-β1、Smad2、Smad3、Smad7、p-Smad2、p-Smad3和β-actin),再加碱性磷酸酶标记的山羊抗鼠IgG二抗稀释液,显影,一抗孵育2~3 h,二抗孵育2 h,分别用TBST洗涤3次,凝胶成像系统拍照记录。蛋白灰度值用G表示,蛋白相对表达量=G目的蛋白/G内参蛋白(β-actin)。
1.3 统计学分析 采用SPSS23.0软件进行统计学分析。多组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。GraphPad Prism 8.0软件作图,Image J软件计算EdU增殖细胞数、总细胞数和蛋白灰度值。
2 结果
2.1 TGF-β1/Smad通路及炎症因子选择 使用KEGG PATHWAY数据库对人炎症性肠病细胞进行通路富集分析(图1),TGF-β可间接抑制炎症性肠病、参与CD发生,UC属于炎症性肠病的一种,因此选择TGF-β通路进行研究。人炎症性肠病细胞中TGF-β通路直接调控下游Smad2/3基因,通过磷酸化发挥作用,Smad7可抑制Smad2/3蛋白表达(图2),因此选择TGF-β及下游Smad2/3、Smad7基因进行研究。炎症因子TNF-α和IL-6与炎症性肠病发生相关(图1),且MAVROPOULOU等[8]证明UC患者sIL-2R水平可作为非侵入性生物标志物识别疾病活动状态,所以本研究选择IL-6、TNF-α和sIL-2R炎症因子进行实验。

图1 人类炎症性肠病相关信号通路图Fig.1 Signaling pathways associated with human inflammatory bowel disease
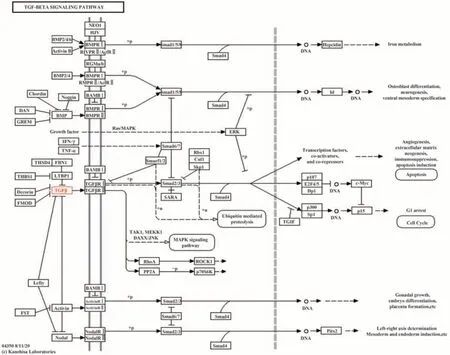
图2 人炎症性肠病中TGF-β信号通路图Fig.2 TGF-β signaling pathway in human inflammatory bowel disease
2.2 MS对人结肠上皮NCM-460细胞形态学的影响 人结肠上皮NCM-460细胞经LPS诱导24 h后,细胞生长受到抑制;0.1、0.2、0.4 mg/L MS处理LPS组细胞24 h后,细胞生长抑制能力下降,轮廓逐渐清晰,贴壁能力增强,Inhibitor组细胞生长趋势和形态变化与MS组细胞相同(图3)。
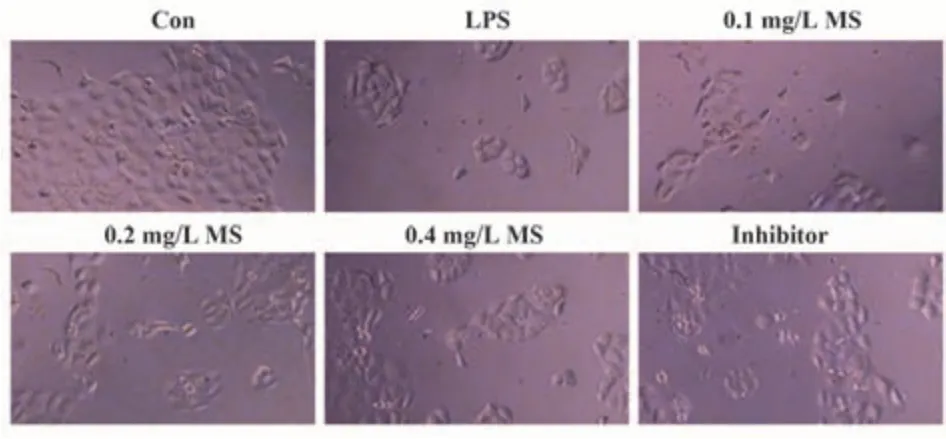
图3 倒置显微镜观察NCM-460细胞形态学变化(×20)Fig.3 Morphological changes of NCM-460 cells observed by inverted microscope (×20)
2.3 MS促进NCM-460细胞增殖 LPS处理24 h后,EdU阳性细胞数比Con组明显减少,提示LPS处理降低NCM-460细胞增殖率(图4);与LPS组相比,随着MS浓度增加,细胞增殖率逐渐升高,其中0.2和0.4 mg/L MS增加显著(P<0.05);与0.2 mg/L MS组相比,抑制剂进一步提升细胞增殖率(P<0.05)。

图4 EdU检测NCM-460细胞增殖情况(×20)Fig.4 NCM-460 cell proliferation detected by EdU assay (×20)
2.4 MS抑制NCM-460细胞的凋亡 正常细胞核呈淡蓝色,形态呈圆形,凋亡细胞核呈亮蓝色。LPS处理24 h后,LPS组细胞与Con组相比,凋亡细胞数明显增加;与LPS组相比,MS组细胞凋亡数随着处理浓度增加逐渐减少,而Inhibitor组细胞凋亡数进一步减少(图5)。

图5 荧光倒置显微镜下观察NCM-460细胞凋亡(×40)Fig.5 NCM-460 cells apoptosis observed under fluorescent inverted microscope (×40)
2.5 MS抑制NCM-460细胞炎症 ELISA检测不同处理组NCM-460细胞培养液中TNF-α、IL-6和sIL-2R表达(图6),与Con组相比,LPS组细胞炎症因子TNF-α、IL-6及sIL-2R表达均显著升高;MS处理后,炎症因子水平逐渐降低,呈剂量依赖性(P<0.05);与0.2 mg/L MS组相比,抑制剂进一步降低炎症因子表达(P<0.05)。

图6 ELISA检测NCM-460细胞炎症因子释放量Fig.6 Release of inflammatory factors from NCM-460 cells by ELISA
2.6 MS抑制NCM-460细胞TGF-β1/Smad通路活化 Western blot测定不同处理组NCM-460细胞TGF-β1、Smad2、Smad3、p-Smad2、p-Smad3和Smad7表达(图7),各组Smad2和Smad3蛋白表达无显著差异(P>0.05)。与Con组相比,LPS组细胞Smad7表达显著减少,而TGF-β1、p-Smad2和p-Smad3蛋白表达显著增加;与LPS组相比,MS组细胞Smad7表达显著升高,而TGF-β1、p-Smad2和p-Smad3蛋白表达显著降低,且呈剂量依赖性(P<0.05);与0.2 mg/L MS组相比,Inhibitor组Smad7表达显著升高,而TGF-β1、p-Smad2和p-Smad3蛋白表达显著降低。
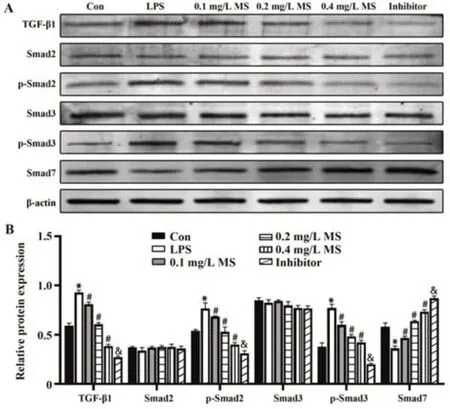
图7 Western blot检测NCM-460细胞TGF-β1/Smad通路相关蛋白表达Fig.7 TGF-β1/Smad pathway-related proteins expressions in NCM-460 cells detected by Western blot
3 讨论
UC是一种常见的消化道疾病,病程较长,极难治愈,具有易复发、治疗病程长等特点,且极易恶化发展为结直肠癌[12]。最近报道指出UC在我国乃至全世界发病率逐年上升,因此,对UC发病机制的研究及治疗方法的探讨成为医疗卫生界重要课题。多数研究者认为该病主要由促炎因子(TNF-α、IL-6等)以及抗炎因子不平衡导致,临床一般选用药物消除炎症反应,而MS作为治疗UC的常见药物,能有效抑制炎症介质白三烯形成、肠壁组织炎症反应和机体肠道病菌炎症递质,清除氧自由基,改善机体或血小板活化因子活性状况,从而改善UC患者临床症状[13-15]。为探求MS介导的可能新机制,本研究探讨其对结肠上皮细胞NCM-460功能、炎症及TGF-β1/Smad信号通路的影响,发现MS可能通过降低TGF-β1/Smad通路活性抑制其凋亡和炎症。
研究表明LPS能够诱发促炎因子表达从而引发炎症。李迪等[16]利用LPS诱导的小鼠BV-2小胶质细胞构建炎症细胞后IL-6释放量显著增加,而郝浩扬等[17]发现LPS诱导的小鼠乳腺组织中TNF-α显著增加,与本研究结果一致。本研究发现LPS诱导人结肠上皮细胞NCM-460增殖受到抑制,凋亡增加,且炎症因子TNF-α、IL-6、sIL-2R水平升高。祝斌等[18]研究发现,葡萄糖硫酸钠诱导的小鼠UC模型中,MS可能通过T细胞亚群发挥抗炎及治疗UC作用;耿艳丽等[19]研究表明MS治疗后UC患者症状显著减轻,且体内TNF-α、IL-6、IL-1β水平显著低于治疗前,证实了MS对UC的治疗作用。本研究利用不同浓度MS处理细胞,发现随着MS浓度增加,NCM-460细胞增殖率升高,细胞凋亡率降低,且TNF-α、IL-6、sIL-2R表达呈浓度依赖性降低,说明MS能够保护NCM-460细胞免受LPS伤害,促进NCM-460细胞生长。
TGF-β1/Smad信号通路能够参与机体发育过程中的细胞生长、分化、凋亡和细胞动态平衡过程,且与炎症性肠病相关[20-21]。陶鹏宇等[22]研究表明TGFβ1/Smad信号通路可能是六味地黄丸减轻糖尿病肾病炎症损伤的机制之一。于芝等[23]研究发现右美托咪定通过抑制TGF-β1/Smad信号通路激活减轻炎症对人软骨细胞的损伤作用。本研究发现LPS诱导的细胞中Smad7蛋白表达明显下降,而TGF-β1、p-Smad2和p-Smad3蛋白表达显著增加,表明LPS组细胞TGF-β1/Smad信号通路被激活;而MS组和抑制组细胞Smad7蛋白表达显著升高,而TGF-β1、p-Smad2和p-Smad3蛋白表达显著降低,说明MS可通过抑制TGF-β1/Smad信号通路发挥其抗炎作用。
综上,MS通过抑制TGF-β1/Smad信号通路从而减轻LPS诱导的细胞炎症反应和促凋亡作用,抑制UC细胞增殖,促进NCM-460细胞生长。

