鸡柔嫩艾美耳球虫2种假定致密颗粒蛋白基因的克隆与表达
李天恩,周思含,孙洪超,付 媛,石团员,*,闫文朝
(1.河南科技大学 动物科技学院,河南 洛阳 471023; 2.浙江省农业科学院 畜牧兽医研究所,浙江 杭州 310021)
鸡球虫病由专性寄生于宿主肠道上皮细胞内的艾美耳属球虫所引起[1]。每年因鸡球虫病造成的全球经济损失超过144亿美元,严重制约着养鸡业健康发展[2]。在目前世界公认的7种鸡球虫中,柔嫩艾美耳球虫(Eimeriatenella)的致病性最强,同时也是国内外各地鸡群感染最普遍的优势虫种[3],其感染不受年龄段限制,主要寄生在盲肠上皮细胞,造成肠上皮细胞坏死,肠黏膜损伤,最常见的临床症状是血便[4-7]。轻度感染时可对鸡的生长发育、生产性能造成影响,重度感染可造成鸡大批量死亡[8]。此外,柔嫩艾美耳球虫感染后对宿主黏膜系统的严重破坏会降低机体的免疫力,导致其他病原感染可能性增加。研究发现,柔嫩艾美耳球虫与J亚群禽白血病病毒双重感染时,可导致雏鸡更严重的肠道组织损伤和较高的死亡率[9]。然而,目前鸡球虫病传统防控策略主要依赖药物和弱毒活卵囊疫苗,随着球虫耐药虫株的频发,以及公众对鸡肉、蛋产品药物残留问题的日益关注[10],抗球虫药物存在防治效果不佳和使用受限等实际问题[11],活卵囊疫苗也存在成本高、不易操作和潜在返强散毒等诸多弊端[12]。因此,养鸡生产上亟需球虫病新型疫苗。采用基因工程技术研制安全、有效的鸡球虫新型疫苗是一个很有吸引力的研究方向,其中,重组亚单位疫苗的表达系统较为成熟,该系统具有生产周期短、产量高和生产成本相对较低等优点,而筛选具有良好免疫保护效果的疫苗抗原蛋白,无疑是重组亚单位疫苗研制的关键[13]。
致密颗粒(dense granule, DG)是顶复合器门原虫(包括球虫、弓形虫和新孢子虫等)特有的一种分泌性亚细胞器,在透射电镜下为单层膜包裹的球形致密小体,数量和大小随种类和发育阶段的不同存在差异[14]。早在上世纪的八九十年代,就有国内外学者在球虫子孢子和裂殖子内观察到DG的报道,E.tenella细胞内的DG数量大约为4个,且观察到了DG向纳虫空泡(parasitophorous vacuole, PV)分泌蛋白的现象[15-16]。致密颗粒蛋白(GRAs)是一类由致密颗粒分泌的、具有重要生物学功能和免疫学应用价值的蛋白质,在弓形虫(Toxoplasmagondii)上已得到深入研究。目前,已报道的弓形虫GRAs有54种[17-19]。蛋白质序列和结构显示,GRAs是一类分子量大小为20~60 ku,具有靶向信号肽和疏水性α螺旋结构的分泌性小分子蛋白[17]。按照其参与PV结构和功能不同,可大致分为3类:(1)纳虫空泡膜(PVM)结构和功能相关GRAs,包括GRA3、GRA5、GRA7、GRA8、GRA10、GRA14、GRA15、GRA19~24、GRA33、GRA35和GRA36[17,20-21],这类GRAs可形成伸入宿主细胞质内的细长突出,与PV结构稳定性、宿主逃避和营养物质交换功能密切相关;(2)泡内膜样微管网络(MNN)结构和功能相关GRAs,包括GRA2、GRA3、GRA4、GRA6、GRA9、GRA12和GRA14[17,20-21],这类GRAs存在于PVM上,与虫体空间稳定、有序分裂和物质运输功能密切相关;(3)非PV结构相关GRAs,这类GRAs包括位于PV腔内的可溶性GRA1和最终靶向宿主细胞核的GRA15、GRA16、GRA24,具有催化和宿主细胞应答调节功能[16]。另外,按照其免疫应答类型和应用价值来说,GRAs大体可分为2类:(1)能够激发宿主Th1型/CD8+T细胞为主要免疫应答的GRAs,包括GRA1、GRA6、GRA7和GRA14等,因Th1型或CD8+T免疫应答是宿主清除细胞内原虫的主要免疫机制,这类GRAs具有较高的疫苗研发价值[22]。据Scorza等[23]报道,GRA1蛋白免疫C3H小鼠后,能够激发宿主高水平的CD8+T为主的特异性免疫应答,免疫小鼠攻虫后的存活率可达75%~100%;另据Quan等[24]和Vazini等[25]报道,GRA7也能够激发高水平的保护性免疫应答,免疫小鼠存活时间和存活率均显著提高,弓形虫脑组织包囊减少率可高达80%以上,GRA1和GRA7都是具有弓形虫疫苗研发价值的候选抗原基因。(2)能够激发宿主较高体液特异性免疫应答的GRAs,包括GRA2、GRA4、GRA7、GRA24和GRA41等;其中,GRA7不仅能够激发宿主细胞免疫应答,也能够激发宿主较高的体液免疫应答,能够用于人、猪、鸡和猫等动物的弓形虫病诊断,GRAs在弓形虫病诊断中也具有较高的应用价值[26-30]。
令人遗憾的是,尽管国内外对球虫DG的报道较早,目前尚未有关于球虫GRAs分子生物学和功能方面的确切研究报道。鉴于GRAs对球虫胞内寄生、发育起重要作用,以及在球虫新型疫苗研发中的潜在价值,本研究以E.tenella北京株为研究对象,通过对E.tenella基因组分析,发掘到2种假定致密颗粒蛋白基因hEtGRA12、hEtGRA9,进而通过基因扩增、质粒构建和原核表达获得重组蛋白rhEtGRA12、rhEtGRA9,并鉴定了其抗原性,为球虫致密颗粒蛋白基因功能和免疫应用深入研究奠定了基础。
1 材料与方法
1.1 材料
柔嫩艾美耳球虫北京株由中国农业大学寄生虫实验室馈赠并由本实验室传代保存。Trans1-T1、Transetta (DE3)感受态细胞、TransScript®One-Step RT-PCR SuperMix一步法RT-PCR试剂盒购自北京全式金生物技术股份有限公司,pET32a(+)表达载体为实验室保存,pMD19-T克隆载体、dNTP、10×Buffer、rTaq酶、DNA marker、蛋白质分子量标准购自宝日医生物技术(北京)有限公司,DNA琼脂糖凝胶回收试剂盒、质粒小量提取试剂盒购自北京索莱宝科技有限公司,Trizol试剂购自赛默飞世尔科技(中国)有限公司,胰蛋白胨、酵母提取物、琼脂粉和琼脂糖购自OXOID公司。
1.2 球虫假定致密颗粒蛋白基因序列筛选
目前尚未有关于球虫致密颗粒蛋白基因的确切报道,本研究首先从NCBI基因库下载目前已报道的顶复合器门原虫(如刚地弓形虫、犬新孢子虫、猪囊等孢球虫等)的GRAs基因序列,然后通过BLAST工具分别将其与NCBI中E.tenellaHoughton株基因组比对分析,筛选出11条与GRAs蛋白序列相似性较高的假定基因序列,进而利用Primer Primier 5.0软件设计合成相应的引物(引物由杭州有康生物技术有限公司合成),引物序列见表1。根据推荐的反应程序进行逆转录PCR(RT-PCR)。

表1 克隆E. tenella假定致密颗粒蛋白基因序列所用引物Table 1 Primers for cloning dense granule protein hypothetical genes in E. tenella
1.3 RT-PCR
取新鲜的E.tenella孢子化卵囊5×107个,通过机械研磨、化学消化、G3漏斗过滤、水平离心等系列方法步骤提取子孢子;取感染E.tenella后第5天的鸡盲肠,刮取肠黏膜依次通过酶消化、离心洗涤、红细胞裂解、Percoll密度梯度离心等手段提取第2代裂殖子。利用Trizol试剂提取子孢子、裂殖子的总RNA,然后进行RT-PCR。扩增产物经1.5%琼脂糖凝胶电泳鉴定,采用琼脂糖凝胶回收试剂盒回收目的片段。将回收的目的片段与pMD19-T载体于16 ℃连接过夜,转化至大肠埃希菌Trans1-T1感受态细胞。经含有氨苄抗性的LB固体培养基于37 ℃过夜培养,挑取单菌落培养并扩增,选择扩增阳性菌液送杭州有康生物技术有限公司测序。
1.4 球虫假定致密颗粒蛋白结构生物信息学分析
通过一系列生物信息学分析软件对扩增获得的疑似基因蛋白结构,包括基本理化性质(ProtParam tool在线软件,https://web.expasy.org/protparam/)、信号肽(SignalP-5.0在线软件,https://services.healthtech.dtu.dk/)、跨膜结构域(TMHMM-2.0在线软件,https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)、二级结构(GOR4在线软件,https://npsa-prabi.ibcp.fr/cgi-bin/secpred_gor4.pl)、抗原表位(Antigenic在线软件,http://imed.med.ucm.es/Tools/antigenic.pl)和亲疏水性(Protscale在线软件,https://web.expasy.org/protscale/)等进行分析,并与已知的其他顶复合器门原虫GRAs蛋白功能结构域保守性进行比对分析,以确定扩增到的基因序列是否为球虫假定致密颗粒蛋白基因。
1.5 球虫假定致密颗粒蛋白重组表达质粒的构建
将测序正确的pMD19T-hEtGRA克隆质粒和pET32a(+)表达载体经限制性内切酶双酶切,酶切产物用琼脂糖凝胶回收试剂盒回收。通过T4 DNA连接酶16 ℃连接过夜,构建出重组表达质粒pET32a(+)-hEtGRA,并转化至大肠埃希菌Transetta (DE3)感受态细胞。经含有氨苄抗性的LB固体培养基37 ℃过夜培养。挑取单菌落培养,通过质粒小提试剂盒提取质粒,用PCR和双酶切鉴定。
1.6 球虫重组蛋白rhEtGRA表达、纯化与Western blot分析
将鉴定阳性的pET32a(+)-hEtGRA重组表达菌按1∶100比例扩大培养至D600(600 nm处的吸光度)为0.6~0.8时,加入终浓度为1 mmol·L-1的IPTG,37 ℃、200 r·min-1诱导表达4 h。将诱导表达后的菌液于4 ℃ 10 000×g离心10 min,收集菌体弃去上清液。加入菌体10倍体积的裂解液将菌体充分悬浮,冰浴超声破碎,将破碎液转移至离心管,4 ℃,10 000×g离心10 min,取上清液(蛋白粗提物)待过柱。在纯化柱中加入适量Ni-NTA纯化介质并静置15 min,再对Ni-NTA纯化柱进行清洗、平衡。将蛋白粗提物加入Ni-NTA纯化柱,使目的蛋白与Ni2+充分接触,再经过洗杂、洗脱处理,即可得到纯化的目的蛋白。以纯化的目的蛋白为抗原进行SDS-PAGE,并转印到NC膜上,进行Western blot分析。以鸡抗柔嫩艾美耳球虫阳性血清和鸡阴性血清作为一抗,辣根过氧化物酶(HRP)标记的兔抗鸡IgG作为二抗,对重组蛋白抗原的特异性进行鉴定。
1.7 鼠抗rhEtGRA多克隆抗体的制备与检测
取6周龄SPF(无特定病原体)小鼠,将已测定浓度的rhEtGRA与弗氏完全佐剂或弗氏不完全佐剂1∶1混合后充分乳化,并采用颈部皮下多点注射的方式免疫小鼠。首免剂量为每只100 μg,二免、三免剂量均为每只50 μg,每次免疫间隔14 d。三免后第7天摘取眼球采血,采集的血液在37 ℃温箱静置1 h,再静置于4 ℃冰箱过夜,第2天3 000×g离心5 min,分离血清并置于-80 ℃冰箱保存备用。使用间接ELISA方法检测多克隆抗体效价,以rhEtGRA为抗原,以rhEtGRA免疫小鼠血清和阴性鼠血清为一抗,以HRP标记的羊抗鼠IgG为二抗,经过显色后用H2SO4终止,最后在酶标仪中读取450 nm处的吸光度D450。
2 结果与分析
2.1 球虫假定致密颗粒蛋白基因hEtGRA12、hEtGRA9
通过RT-PCR扩增E.tenella子孢子、裂殖子总RNA,获得特异性扩增条带2条,分别命名为hEtGRA12基因(ETH_00023950)、hEtGRA9基因(ETH_00031740)。hEtGRA12条带测序大小为1 188 bp(图1-A),与E.tenellaHoughton株核苷酸序列一致性为99.92%,氨基酸序列一致性为100%,与T.gondiiME49株致密颗粒蛋白GRA12相似性为33.88%。hEtGRA9条带测序大小为1 110 bp(图1-B),与E.tenellaHoughton株核苷酸序列一致性为99.91%,氨基酸序列一致性为99.73%,与T.gondiiME49株致密颗粒蛋白GRA9相似性为27.5%。
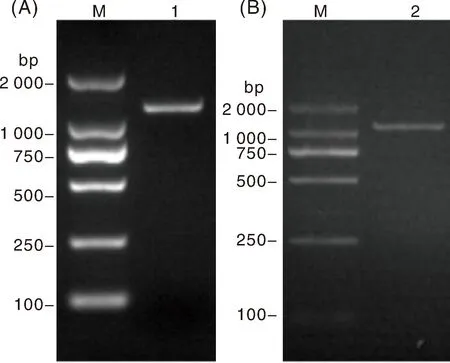
M,DNA marker;1,hEtGRA12基因片段;2,hEtGRA9基因片段。M, DNA maker; 1, hEtGRA12 gene fragment; 2, hEtGRA9 gene fragment.图1 hEtGRA12、hEtGRA9基因的克隆Fig.1 Cloning of hEtGRA12 gene and hEtGRA9 gene
对hEtGRA12基因进行同源数据库OrthoDB(https://www.expasy.org/resources/orthodb)分析,结果表明,顶复合器门GRA12蛋白在艾美耳属和肉孢子虫科均存在(图2-A)。下载相应的基因和蛋白序列,采用MEGA 11软件进行比对分析,并用NJ法构建系统发育树,结果显示,hEtGRA12蛋白氨基酸序列与刚地弓形虫(T.gondii)、犬新孢子虫(Neosporacaninum)、贝氏贝诺孢子虫(Besnoitiabesnoiti)、猪囊等孢球虫(Cystoisosporasuis)致密颗粒蛋白GRA12物种间相似性为28.8%~39.6%(图2-B),hEtGRA12与刚地弓形虫致密颗粒蛋白GRA12(TgGRA12)氨基酸序列间相似性最高,约为40%。系统发育树表明,hEtGRA12种间与TgGRA12亲缘关系最近(图2-C)。利用EMBL-EBI中成对序列比对工具(https://wwwdev.ebi.ac.uk/Tools/jdispatcher/)对hEtGRA9蛋白进行相似性比对分析,结果表明hEtGRA9与TgGRA9、BbGRA9蛋白序列相似性分别为27.5%、29.5%(图3)。
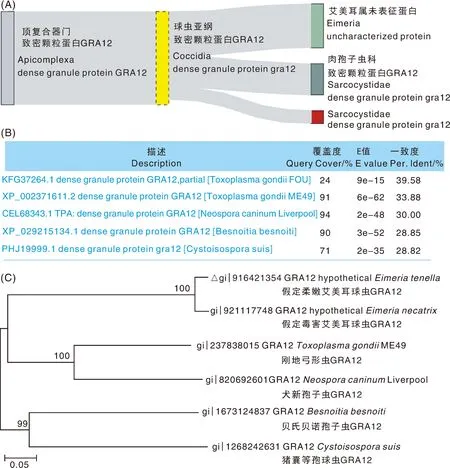
A,同源性分析;B,序列相似性分析;C,亲缘关系分析,△表示hEtGRA12蛋白序列。A, Analysis of homolog; B, Analysis of sequence similarity; C, Analysis of kinship, △ represented sequence of hEtGRA12 protein.图2 hEtGRA12蛋白同源性与系统发育分析Fig.2 Homology and phylogenetic analysis of hEtGRA12 protein

A,hEtGRA9与TgGRA9蛋白序列相似性分析;B,hEtGRA9与BbGRA9蛋白序列相似性分析。●,hEtGRA9蛋白序列;▲,TgGRA9蛋白序列;◆,BbGRA9蛋白序列。A, Sequence similarity analysis of hEtGRA9 and TgGRA9 protein; B, Sequence similarity analysis of hEtGRA9 and BbGRA9 protein. ●,Sequence of hEtGRA9 protein; ▲, Sequence of TgGRA9 protein; ◆, Sequence of BbGRA9 protein.图3 hEtGRA9蛋白序列相似性分析Fig.3 Sequence similarity analysis of hEtGRA9 protein
2.2 hEtGRA12、hEtGRA9蛋白具有保守功能结构域
生物信息学软件分析结果显示,hEtGRA12蛋白含有395个氨基酸,其中酸性氨基酸(Asp+Glu)38个、碱性氨基酸(Arg+Lys)45个;分子式为C1977H3054N558O569S19,原子总数6 177;理论分子量、等电点分别为44.35 ku、9.03;亲水指数为-0.237,属于亲水性蛋白;含有疏水性信号肽,位于1~24位氨基酸(图4-A);无跨膜结构域(图4-B);含有多个亲水性较高的区域,其中较为典型的主要有108、147、234位氨基酸,均位于-3.0~-4.0的超强亲水性区域(图4-C);在该蛋白的395个氨基酸中,130个氨基酸可能形成α螺旋(32.91%),97个氨基酸形成延伸链(24.56%),168个氨基酸形成无规则卷曲(42.53%)(图4-D);存在17个可能的抗原表位(图4-E)。
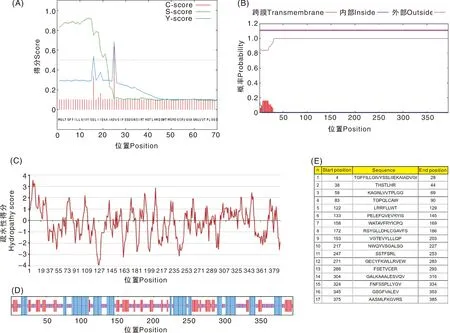
A,信号肽预测;B,跨膜区预测;C,亲/疏水性分析;D,二级结构预测,蓝色代表α螺旋,紫色代表无规则卷曲,红色代表延伸链;E,抗原表位预测。图5同。A, Prediction of signal peptide; B, Prediction of transmembrane region; C, Analysis of hydrophilic/hydrophobic; D, Prediction of secondary structure, blue represented α-helix, purple represented random coi, red represented extended strand; E, Prediction of antigen epitope. The same as in figure 5.图4 hEtGRA12蛋白的生物信息学分析Fig.4 Bioinformatics analysis of EtGRA12 protein
生物信息学软件分析结果显示,hEtGRA9蛋白含有369个氨基酸,其中酸性氨基酸(Asp+Glu)60个、碱性氨基酸(Arg+Lys)46个;分子式为C1713H2719N533O560S7,原子总数5 532;理论分子量、等电点分别为39.97 ku、5.16;亲水指数为-0.856,属于亲水性蛋白;含有疏水性信号肽,位于1~25位氨基酸(图5-A);无跨膜结构域(图5-B);含有多个亲水性较高的区域,其中较为典型的主要有119、230、307、363位氨基酸,均位于-3.0~-4.0的超强亲水性区域(图5-C);在该蛋白的369个氨基酸中,187个氨基酸可能形成α螺旋(50.68%),18个氨基酸形成延伸链(4.88%),164个氨基酸形成无规则卷曲(44.44%)(图5-D);存在9个可能的抗原表位(图5-E)。
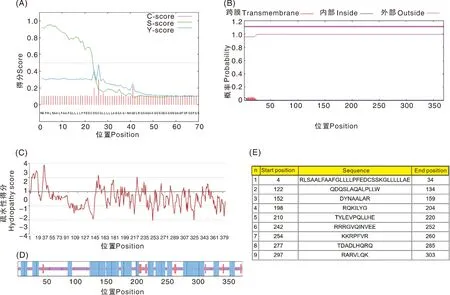
图5 hEtGRA9蛋白的生物信息学分析Fig.5 Bioinformatics analysis of hEtGRA9 protein
hEtGRA12、hEtGRA9均有信号肽、α螺旋,超强亲水性区域,均属于亲水性蛋白,对TgGRA12、TgGRA9蛋白结构进行分析,发现也同样具有信号肽、在二级结构上也均只有α螺旋、延伸链和无规则卷曲3种结构模式组成(图6),且同属于亲水性蛋白,提示hEtGRA12、hEtGRA9在蛋白功能结构域上与TgGRA12、TgGRA9具有一定的保守性。
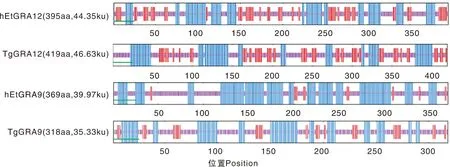
绿色,信号肽;蓝色,α螺旋;紫色,无规则卷曲;红色,延伸链。Green, Signal peptide; Blue, α-Helix; Purple, Random coil; Red, Extended strand.图6 蛋白功能结构域保守性分析Fig.6 Conservative analysis of protein functional domain
2.3 hEtGRA12、hEtGRA9基因的原核表达
将pMD19T-hEtGRA12质粒和pET32a(+)表达载体用BamHⅠ和HindⅢ双酶切,用T4 DNA连接酶连接,构建出重组表达质粒pET32a(+)-hEtGRA12,经BamHⅠ和HindⅢ双酶切鉴定有目的基因片段(图7-A),表明原核表达质粒构建成功。pET32a-hEtGRA12重组表达菌经IPTG诱导表达后,用超声破碎仪破碎,离心后分别取上清液和沉淀进行SDS-PAGE鉴定,结果显示,获得了63.6 ku的目的重组蛋白rhEtGRA12(图7-B)。
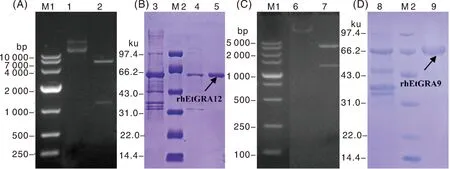
A,pET32a(+)-hEtGRA12质粒双酶切鉴定;B,hEtGRA12蛋白的表达纯化;C,pET32a(+)-hEtGRA9质粒双酶切鉴定;D,hEtGRA9蛋白的表达纯化。M1,DNA marker;M2,蛋白分子量标准;1,pET32a(+)-hEtGRA12质粒;2,pET32a(+)-hEtGRA12质粒双酶切产物;3,未纯化的hEtGRA12蛋白;4~5,纯化的hEtGRA12蛋白;6,pET32a(+)-hEtGRA9质粒;7,pET32a(+)-hEtGRA9质粒双酶切产物;8,未纯化的hEtGRA9蛋白;9,纯化的hEtGRA9蛋白。A, Identification of pET32a (+)-hEtGRA12 plasmid by double enzyme digestion; B, Expression and purification of hEtGRA12 protein; C, Identification of pET32a (+)-hEtGRA9 plasmid by double enzyme digestion; D, Expression and purification of hEtGRA9 protein; M1, DNA maker; M2, Protein maker; 1, pET32a (+)-hEtGRA12 plasmid; 2, Digestion product of pET32a(+)-hEtGRA12 plasmid; 3, Unpurified hEtGRA12 protein; 4-5, Purified hEtGRA12 protein; 6, pET32a(+)-hEtGRA9 plasmid; 7, Digestion product of pET32a(+)-hEtGRA9 plasmid; 8, Unpurified hEtGRA9 protein; 9, Purified hEtGRA9 protein.图7 hEtGRA12、hEtGRA9基因的重组表达Fig.7 Recombinant expression of hEtGRA12 and hEtGRA9 genes
使用同样的方法和相对应的内切酶构建hEtGRA9基因重组表达质粒,并进行蛋白的表达纯化。结果显示,成功构建了重组表达质粒pET32a(+)-hEtGRA9(图7-C),获得了约67.00 ku的重组蛋白,与理论蛋白分子量59.46 ku存在差异,推测重组蛋白rhEtGRA9存在翻译后修饰(图7-D)。
2.4 rhEtGRA12、rhEtGRA9重组蛋白的抗原性
Western blot结果表明,重组蛋白rhEtGRA12、rhEtGRA9能够被鸡抗柔嫩艾美耳球虫阳性血清识别,表明具有较好的反应原性(图8-A、8-B)。
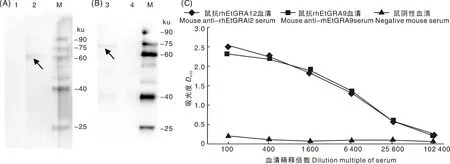
A,重组蛋白rhEtGRA12 Western blot分析;B,重组蛋白rhEtGRA9 Western blot分析;M,蛋白质分子量标准;1、4,阴性鸡血清;2、3,抗柔嫩艾美耳球虫阳性鸡血清;C,鼠抗rhEtGRA12、鼠抗rhEtGRA9多克隆抗体效价检测。A, Western blot analysis of recombinant protein rhEtGRA12; B, Western blot analysis of recombinant protein rhEtGRA9; M, Protein marker; 1 and 4, Negative chicken serum; 2 and 3, Anti-Eimeria tenella positive chicken serum; C, Detection of mouse anti-rhEtGRA12 and mouse anti-rhEtGRA9 polyclonal antibody titers.图8 rhEtGRA12、rhEtGRA9抗原性分析Fig.8 Antigenicity analysis of rhEtGRA12 and rhEtGRA9
以获得的多抗和鼠阴性血清为一抗,以HRP标记的羊抗鼠IgG为二抗,再经过显色、终止反应,最后在酶标仪中读取D450。取4个鼠抗rhEtGRA12、鼠抗rhEtGRA9血清和2个鼠阴性血清的平均值作图,结果表明,小鼠体内均产生了高水平的抗体(图8-C),抗体效价为1∶102 400,表明rhEtGRA12、rhEtGRA9重组蛋白具有较好的免疫原性。
3 讨论
致密颗粒蛋白是顶复合器门原虫特有的亚细胞器致密颗粒分泌的重要功能蛋白,具有较高的免疫学应用价值,然而目前尚未有关于球虫致密颗粒蛋白的确切报道,仅有些许假定致密颗粒蛋白的报道。本研究通过序列相似性比对和功能结构域保守性分析从E.tenella北京株发掘并成功克隆了2个鸡球虫假定致密颗粒蛋白基因hEtGRA12、hEtGRA9;序列相似性比对结果显示,hEtGRA12、hEtGRA9与Houghton株对应的基因编码的氨基酸序列一致性分别为100%、99.73%,而与顶复合器门其他原虫致密颗粒蛋白GRA12、GRA9物种间相似性分别为28.8%~39.6%、27.5%~29.5%,表明hEtGRA12、hEtGRA9基因在种内具有高度保守性,在种间具有不同程度差异性,提示球虫中的致密颗粒蛋白除了具有顶复合器门原虫共性的功能外,还可能具有独特的种内功能。弓形虫致密颗粒蛋白之间或与已知功能的蛋白之间没有显著相似性,也没有共同的保守结构域,但基于它们在致密颗粒内独特的共定位被定义为GRA蛋白家族,但大多数均包含一个与它们分泌情况相关的N端疏水信号肽和α螺旋[17]。本研究中hEtGRA12、hEtGRA9蛋白均含有疏水信号肽,且α螺旋结构占比很高,对TgGRA12、TgGRA9蛋白结构进行分析,发现也同样具有信号肽,在二级结构上也均只有α螺旋、延伸链和无规则卷曲3种结构模式组成,且同属于亲水性蛋白,提示hEtGRA12、hEtGRA9在蛋白功能结构域上与TgGRA12、TgGRA9具有一定的保守性,进而提示hEtGRA12、hEtGRA9可能为鸡球虫真正的致密颗粒蛋白。
蛋白质二级结构中的无规则卷曲指不能被归入明确的二级结构如折叠片或螺旋的多肽区段,因其肽链没有一定规律且易变形,大多位于蛋白分子表面,因此利于与抗体结合,同时也是潜在的抗原表位。hEtGRA12、hEtGRA9蛋白序列无规则卷曲结构将近占全部结构的一半,表明它们具有很好的潜在抗原表位。氨基酸残基因其亲/疏水性可分为亲水性氨基酸和疏水性氨基酸,疏水性氨基酸残基位于蛋白质内部,主要构成了蛋白质折叠的主要动力[31]。亲水性氨基酸残基位于蛋白质表面,连续的高亲水氨基酸残基通常构成一侧线性抗原表位,因此它也是判断B细胞抗原表位的常用参数[32]。hEtGRA12、hEtGRA9蛋白均具有多个超强亲水性区域,可构成一侧线性抗原表位。通过抗原决定簇预测网站预测到hEtGRA12、hEtGRA9分别有17、9个潜在的抗原决定簇,进一步说明hEtGRA12、hEtGRA9蛋白可能具有很好的免疫原性,具有成为候选抗原分子的潜力。蛋白异源表达是通过分子生物学技术将外源基因克隆到人工载体上,构建出异源表达体系,从而获得特定蛋白的一种方法。大肠埃希菌具有遗传背景清楚、易培养、廉价、繁殖速度快、蛋白高表达等优点,已成为很多异源蛋白表达的首选[33]。本研究通过大肠埃希菌原核表达系统获得的重组蛋白rEtGRA12、rhEtGRA9,rEtGRA12、rhEtGRA9可与鸡抗E.tenella阳性血清发生特异性反应,表明重组蛋白rEtGRA12、rhEtGRA9均具有较好的反应原性。本研究还利用纯化的蛋白免疫小鼠制备多抗,检测小鼠血清中抗rEtGRA12、rhEtGRA9抗体水平,结果表明,可以诱导小鼠产生较高的抗体水平,再次验证了这2种重组蛋白具有较好的免疫原性和反应原性,具有成为抗鸡球虫病优秀疫苗抗原分子的潜力。
虽然NCBI已公布了柔嫩艾美耳球虫假定致密颗粒蛋白基因EtGRA9(ETH_00028350),但是已有研究证明该基因并不是真正的致密颗粒蛋白基因。Hu等[34]利用CRISPR/Cas9介导的柔嫩艾美耳球虫分泌蛋白的基因标记法对假定的EtGRA9基因进行研究,结果在囊泡中发现了EtGRA9的标记信号,而未在致密颗粒中发现,表明EtGRA9是一种分泌蛋白,可以帮助柔嫩艾美耳球虫子孢子从孢子囊中释放,并可能在子孢子和裂殖子入侵过程中发挥重要作用,并非真正的球虫致密颗粒蛋白。本研究根据序列相似性和保守的功能结构重新假定了一种EtGRA9基因(ETH_00031740),并命名为hEtGRA9。本研究中hEtGRA12基因(ETH_00023950)目前已有了相关研究报道,Mu等[35]构建了基因ETH_00023950的真核表达质粒并转染到鸡肝癌(LMH)细胞,然后对转染后的LMH细胞进行转录组测序,结果表明,该基因改变了LMH细胞2 680个基因的表达,说明该基因具有很高的研究价值。虽然hEtGRA12基因已经被初步研究过,但其克隆到的序列与Houghton株相比,存在碱基差异,并由此导致提前终止翻译。本研究克隆到的基因其蛋白序列与Houghton株相比一致性100%,在功能上可能会与Mu等[35]的研究有所差异,所以很有必要进一步研究该基因的相关生物学特性。
本研究利用分子克隆手段获得了E.tenella北京株hEtGRA12、hEtGRA9基因编码区的全长序列,并通过生物信息学相关技术和方法对hEtGRA12、hEtGRA9蛋白进行了分析,获得了重组蛋白rhEtGRA12、rhEtGRA9并鉴定了其抗原性。这两种重组蛋白具有很好的抗原性,后续研究拟对其定位和免疫效果进行评估。本研究在一定程度上为球虫致密颗粒蛋白基因功能和免疫应用深入研究奠定了基础。

