越西县某羊场口蹄疫抗体消长规律研究与探讨
■ 杨富贵 王娟红,2,3* 张桥桥 常卫华,2,3* 陈彬龙 吉能伍各 舒 豪 唐馨怡 蒲 彬
(1.西昌学院动物科学学院,四川西昌 615013;2.四川攀西动物疫病检测与防控实验室,四川西昌 615013;3.四川地方特色山羊重点实验室,四川西昌 615013)
口蹄疫(foot-and-mouth disease,FMD)是由口蹄疫病毒(foot-and-mouth disease virus,FMDV)引起的多发于猪、牛、羊等偶蹄目动物的一种急性、烈性、热性、高度接触性传染病,世界动物卫生组织已将其列为A 类传染病之首,其对畜牧业发展和人类食品卫生安全构成巨大威胁,目前主要以接种疫苗的方式来保护易感动物,通过检疫淘汰来净化畜群[1]。由于检疫淘汰需要强有力的财政支持,世界上大部分国家以接种疫苗预防为主,也正因如此,口蹄疫领域的科学家都在积极开展不同类型疫苗及不同形式免疫程序方面的研究,利用最经济有效的疫苗和最佳的免疫程序来预防口蹄疫的发生[2]。我国大部分地区,根据生产实践,结合当地的养殖模式,设定不同的免疫程序。对于口蹄疫疫苗初免的时间不同,学者也有不同看法,刘贺等[3]认为,首次免疫的时间应该与国家要求的70%抗体合格率相符合,因此应该在母源抗体下降到70%左右,即28 日龄时进行首次免疫。高琳琳[4]认为羊口蹄疫的免疫时间应该根据免疫后抗体水平来确定,而抗体水平在接近而未低于临界保护值时(即45 日龄时)免疫效果较好。史杰等[5]通过对比试验发现,羊55日龄时进行首次免疫效果最好。由此看来,不同的饲养场,饲养管理模式不同,免疫程序也会有差异。
本研究根据四川省越西县某羊场饲养管理实际情况,选择健康羔羊,通过酶联免疫吸附试验分别对该养殖场未接种口蹄疫疫苗与接种口蹄疫疫苗后的羔羊体内口蹄疫抗体水平进行动态监测,掌握抗体消长规律,以期为该羊场优化口蹄疫免疫程序提供数据支撑,为该场的防疫工作、生产管理等提供参考。
1 材料与方法
1.1 试验动物
试验所用湖羊均为越西县某羊场未接种口蹄疫疫苗的羔羊,采用放牧加补饲的方式饲养,白天放牧,归牧时补饲适量的精料及燕麦秆等农副产物。根据该羊场口蹄疫抗体抽检结果可知,该场哺乳期母羊口蹄疫抗体水均在85%以上,符合国家要求的70%水准,故随机挑选适龄羔羊进行试验。
1.2 疫苗及试剂
口蹄疫O型、A型二价灭活疫苗(OHM/02株+AKT~Ⅲ株),批号为2021033,天康生物制药有限公司生产;口蹄疫A 型抗体液相阻断ELISA 检测试剂盒(批号为20210608133)、口蹄疫O 型抗体液相阻断ELISA 检测试剂盒(批号为20210608133),兰州兽研生物科技有限公司生产;抗原(批号为2021101135),兰州兽研生物科技有限公司生产,-20 ℃保存;其他试剂2~8 ℃保存。
1.3 试验分组
选取15 日龄湖羊羔羊24 只为A 组,选取60 日龄湖羊羔羊24只为B组。A组羔羊随着生长每间隔14 d左右检测其母源抗体水平1 次,直至67 日龄。B 组羔羊在60 日龄接种疫苗,与母羊分开单独饲养,随后分别在接种疫苗后第7、14、21、28 天采血并检测口蹄疫抗体。
1.4 免疫
使用连续注射器进行颈部肌肉注射,一羊一换针头,防止羔羊交叉感染,注射剂量为1 mL/只。
1.5 血液采集
使用普通真空采血管进行颈静脉采血,一次采血5 mL,分离血清,4 ℃保存。
1.6 抗体检测
1.6.1 主要试剂准备
口蹄疫A 型病毒稀释液:将口蹄疫A 型病毒抗原从-20 ℃环境中取出置于常温环境下解冻30 min,随后将口蹄疫A型病毒抗原用抗原稀释液稀释至1∶20的工作浓度,实际配备溶液剂量按照50 µL×(实际使用免抗包被板孔数-4)+400 µL计算。
口蹄疫O 型病毒稀释液:将口蹄疫O 型病毒抗原从-20 ℃环境中取出置于常温环境下解冻30 min,随后将口蹄疫O型病毒抗原用抗原稀释液稀释至1∶15的工作浓度,实际配备溶液剂量按照50 µL×(实际使用免抗包被板孔数-4)+400 µL计算。
1.6.2 抗原抗体反应
稀释血清:取酶标板,分别在A1~A6 每个孔位加入50 µL 的PBST 稀释液,随后A1 孔按照50 µL/孔的量加入被检血清,使用移液器吹打10~15 次后,吸取A1 孔血清与PBST 稀释液混合溶液至A2 孔,重复以上操作直至血清与PBST溶液稀释比例为1∶64,吹打最后一个孔后将移液枪头与枪头内50 µL 溶液一起弃去。随后将酶标板A3~A6的4个孔溶液按照50 µL的量移液至A1~D1。重复此操作直至酶标板上的1~10列都为血清稀释液;同时稀释阳性对照血清和阴性对照血清。
加病毒抗原:试验血清、阴性血清和阳性血清中的每一稀释孔加入稀释后的病毒抗原,稀释液量为50 µL,而病毒抗原对照孔加入稀释后的病毒抗原稀释液量为100 µL。
将加好样品的酶标板用封板膜封板,随后放入调速振荡器振荡3 min,取出后置于恒温箱37 ℃温育30 min。
1.6.3 加酶标抗体工作液
温育后沥干并拍打干燥包被板,在每个孔中加入PBST 稀释液,沥干PBST 稀释液,拍干,重复上述动作5 次,然后在每个孔中加入A 型或O 型酶标抗体工作液(蓝色),用封板膜封板后置于恒温箱37 ℃温育30 min。
1.6.4 加TMB底物混合液
温育结束后,将孔内液体倒掉,拍干,随后每孔加入350 µL PBST 稀释液后,倒掉PBST 稀释液,拍干,重复以上操作5 次,随后每孔加入TMB 底物混合液50 µL,用封板膜封板后置于恒温箱37 ℃反应15 min。
1.6.5 终止显色反应结束后,每孔加入终止液50 µL,终止反应,将酶标板放入酶标仪内读取OD450nm值。
1.7 数据分析
用SPSS 16.0 软件对数据进行处理,结果以“平均值”表示。
2 结果与分析
2.1 羔羊口蹄疫母源抗体变化情况
2.1.1 口蹄疫A型母源抗体变化情况
羊场内随机抽检适龄羔羊24只,在5个时间点分别采集血液样品测定口蹄疫A 型母源抗体,结果见表1。由表1 可知,羔羊口蹄疫A 型母源抗体合格率在14 日龄时为79.16%,30 日龄时降至国家水平线以下,60 日龄时为37.50%,随着时间推移,羔羊口蹄疫A 型母源抗体合格率逐步下降。

表1 A组羔羊口蹄疫A型母源抗体变化情况
2.1.2 口蹄疫O型母源抗体变化情况
羊场内随机抽检测适龄羔羊24只,在5个时间点分别采集血液样品测定口蹄疫O 型母源抗体,结果见表2。由表2 可知,羔羊口蹄疫O 型母源抗体合格率在14 日龄时为87.50%,30 日龄时已降至国家水平线以下,60 日龄时合格率为45.83%,随着时间的推移,羔羊口蹄疫O型母源抗体合格率逐步下降。
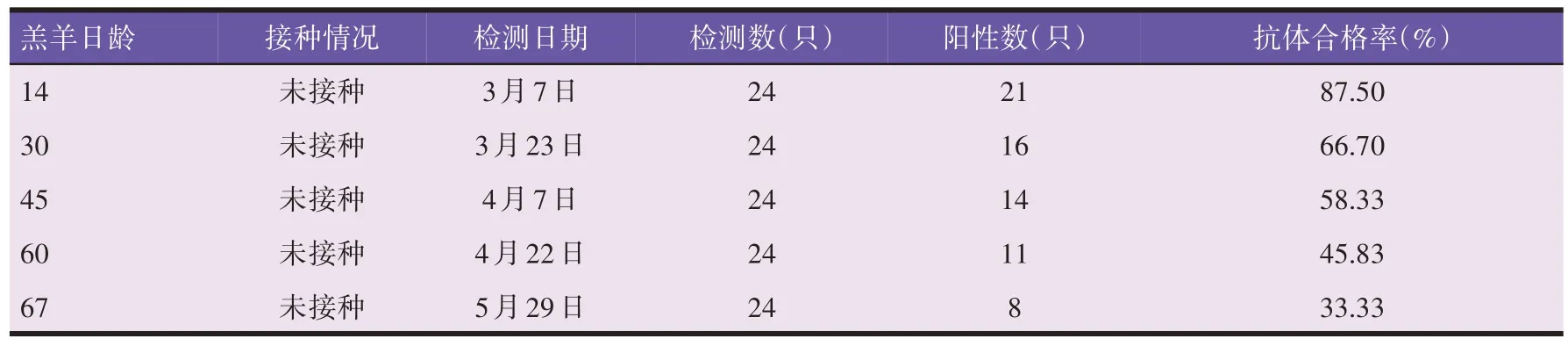
表2 A组羔羊口蹄疫O型母源抗体变化情况
2.1.3 羔羊口蹄疫母源抗体消长情况口蹄疫O 型母源抗体与A 型母源抗体随着时间的推移而逐渐下降,可能与羔羊无法从母乳中摄取到足够的母源抗体有关;并且A、O型母源抗体下降幅度基本一致,但是在30日龄与60日龄之间,口蹄疫O 型母源抗体下降幅度略低于口蹄疫A 型母源抗体下降幅度(见图1)。
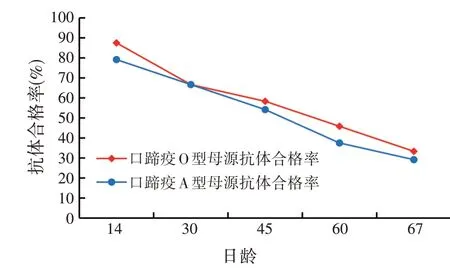
图1 A组羔羊口蹄疫母源抗体变化情况
2.2 羔羊接种疫苗后抗体变化情况
2.2.1 接种疫苗7 d内羊只采食情况
羔羊在免疫前采食量正常,部分羊只在免疫后第2~4 天出现食欲不振、精神萎靡等情况,第5 天与第6 天采食量恢复正常。
2.2.2 羔羊免疫后口蹄疫A型抗体变化情况
羊场内随机抽检60 日龄羔羊24 只,在6 个时间点分别采血,测定口蹄疫A型抗体,结果见表3。口蹄疫A 型抗体免疫合格率在接种7 d 时为16.67%,接种21 d 时增长到70.83%,符合国家要求的70.00%抗体合格率,接种42 d 时达到峰值91.67%,接种56 d 时再无变化,可见随着时间推移,羔羊口蹄疫A 型抗体合格率逐步上升并达到峰值。
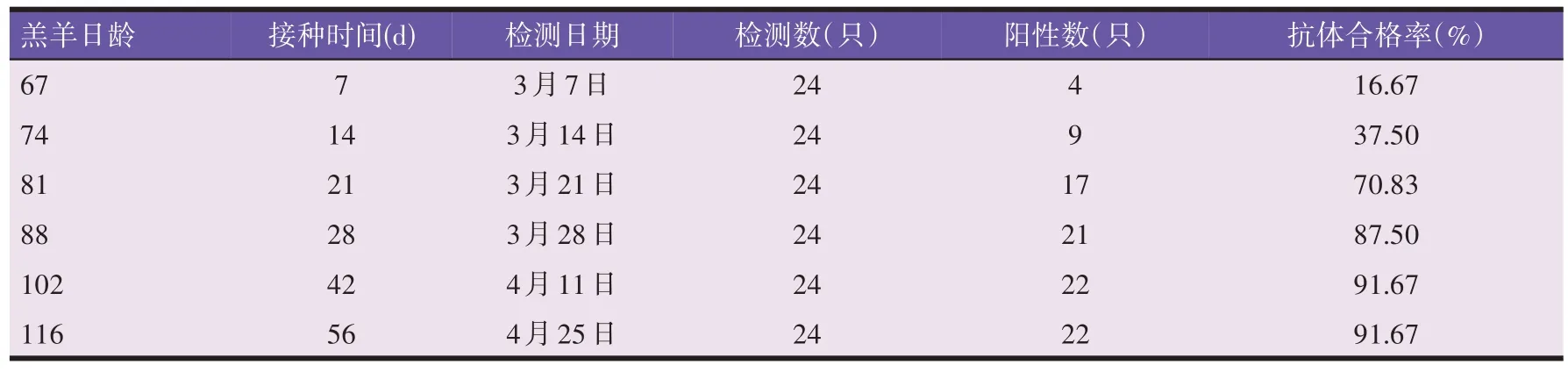
表3 B组羔羊免疫后口蹄疫A型抗体变化情况
2.2.3 羊免疫后口蹄疫O型抗体变化情况
羊场内随机抽检60日龄羔羊24只,在6个时间点分别采血,测定口蹄疫O型抗体,结果见表4。羔羊口蹄疫O型抗体合格率在接种7 d时为25.00%,接种21 d时增长到75.00%,符合国家要求的70%抗体合格率,在接种56 d 时达到峰值91.67%,随着时间的推移,羔羊口蹄疫O型抗体合格率逐步上升并达到峰值。

表4 B组羔羊免疫后口蹄疫O型抗体变化情况
2.2.4 羔羊免疫后口蹄疫A、O型抗体变化情况
从图2可以看出,免疫后口蹄疫O 型、A 型抗体随着时间的推移逐渐上升,可能是羔羊从疫苗免疫过程中产生口蹄疫抗体。接种后一个月内,A 型抗体合格率虽然低于O 型抗体合格率,但之后A 型抗体合格率的增长比O 型抗体合格率增长快,在接种后第2 个月时,O 型抗体合格率略低于A 型抗体合格率,但是在免疫56 d后,口蹄疫A、O型抗体合格率趋于一致。该现象的产生可能与疫苗中两种毒株的浓度有关,也可能与动物机体反应有关。
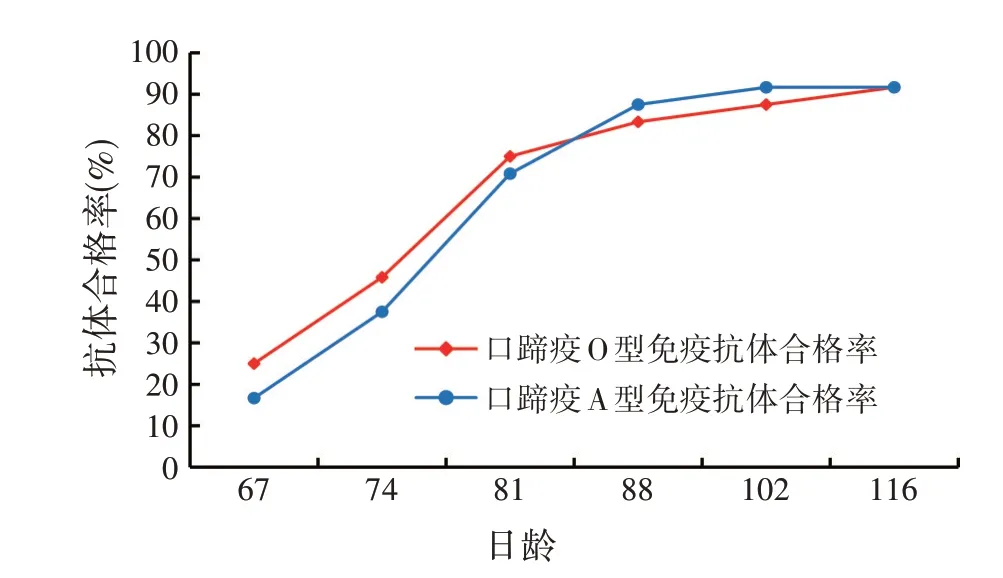
图2 羔羊免疫后口蹄疫抗体变化情况
3 讨论
3.1 口蹄疫母源抗体变化情况
母源抗体是新生胎儿免疫前抵抗疫病的有效保障。新生胎儿在吃到母乳后,体内抗体逐步提升,在1~3 d 达到峰值,其半衰期为21~23 d,在体内存留时间约为2 个月,但是随着时间的推移,新生胎儿的母源抗体开始下降[6]。根据该羊场以往的口蹄疫常规检测数据可知,该场使用的口蹄疫疫苗在成年羊中产生了良好的抗体阳性率,其中包括怀孕母羊,说明该场所使用的疫苗在产生抗体方面具有较强的可靠性。在本研究中,口蹄疫A、O 型母源抗体阳性率在14 日龄时都超过了70.00%,随后一直在下降,在30日龄后甚至低于70.00%,此时羔羊虽仍然与母羊处于同一圈舍,获得口蹄疫抗体的途径并没有变化,但是体内抗体仍然在不断减少。随着时间的推移,母羊分泌的母乳中抗体水平也随之下降[7],此时羔羊虽然以母乳为主,但是已经不能从母乳中获得足量的口蹄疫抗体,因此羔羊体内口蹄疫抗体水平不断下降[8]。从本研究结果得知,30~60 日龄时羔羊口蹄疫O 型母源抗体下降幅度较口蹄疫A 型母源抗体下降幅度小,可能与抗体在机体内的代谢方式有关。
3.2 免疫后口蹄疫抗体变化情况
口蹄疫疫苗接种是羔羊在母乳中摄取不到口蹄疫抗体时对羔羊体内抗体的一种补充手段。对于养殖场来说,疫苗接种程序的制定具有地方性、独特性,受各个养殖场的养殖方式、饲料配比、消毒手段、气候、品种等因素影响。在第一次免疫时,母源抗体对免疫效果有一定的影响,这些母源抗体可保护幼畜不受感染[9],对早期预防口蹄疫具有重要意义,当然幼龄动物的主动免疫也会影响免疫效果[10]。如在母源抗体水平较高的情况下进行免疫接种,进入体内的疫苗可被中和,可造成免疫失败[11]。在母源抗体水平较低时进行接种,虽然会有良好的免疫效果,但是羔羊在一定时间内并不能获得足够的免疫保护,有感染疫病的风险,并且风险随着时间的增长逐渐增大[12]。在本研究中,67 日龄时未接种的羔羊口蹄疫A、O 型抗体合格率分别为29.17%、33.33%,67 日龄时已经免疫的羔羊口蹄疫A、O 型抗体合格率分别为16.67%、25.00%,在相同日龄下,接种后比未接种的羔羊平均抗体低10 个百分点,推测可能有以下几个原因:羔羊在接种后转群,与成年母羊隔开,失去了母源抗体的摄入,导致体内抗体水平不足;也可能是体内母源抗体与疫苗抗原产生中和反应,导致体内抗体水平下降[13-14],下降原因有待深入研究。在疫苗接种21 d 后免疫抗体合格率达70.00%左右,符合国家要求的口蹄疫免疫抗体合格率[15]。口蹄疫A、O 型抗体合格率在接种后42 d基本保持稳定,无太大变化。
综上所述,该场在羔羊60 日龄接种口蹄疫疫苗是可行的,对羔羊口蹄疫具有较好的保护作用。研究中个别数据与国家规定的并不完全一致,但通过该研究可为口蹄疫免疫程序的制定提供参考,有助于养殖场做好每年的强制免疫计划,保障口蹄疫抗体水平在国家规定的范围内。
4 结论
本研究通过酶联免疫吸附试验分别对越西某羊场未接种口蹄疫疫苗与接种口蹄疫疫苗的羔羊体内口蹄疫抗体水平进行动态监测,结果表明该养殖场在羔羊60 日龄时进行口蹄疫免疫接种是可行的,而且对羔羊口蹄疫具有较好的保护作用。试验结果对羊场免疫程序的制定具有一定的借鉴意义,有助于养殖场做好每年的强制免疫计划。

