TNF-α和TGF-β1在胚胎停育患者蜕膜组织中的表达*
崔 莉,刘 杰,邹 歌,王怡佳,陈 燕,董建新
(华北理工大学附属医院妇产科,河北唐山 063000)
胚胎停育指妊娠早期胚胎因各种原因停止发育,滞留于宫腔内未自然排出的一种病理性妊娠[1]。造成胚胎停育的病因机制复杂多样,不仅与子宫解剖结构、外在环境、内分泌失调等有关,还可能受饮食或生活习惯的影响,但目前仍然有约50%的胚胎停育患者尚未明确发病原因[2]。近年来研究表明,胚胎停育可能与滋养细胞侵入异常、胎盘形成过程中绒毛血管异常、胚胎滋养细胞凋亡异常及免疫调节异常等因素有关[3]。有学者发现,肿瘤坏死因子-α(TNF-α)作为一种重要的炎性细胞因子,能够通过控制滋养细胞的生长来影响胚胎的增殖、生长和发育。此外,转化生长因子-β1(TGF-β1)作为一种具有多功能的细胞因子,可以调节免疫应答、介导炎症发生,并调控细胞增殖和分化,参与胚胎的生长发育。本研究通过分析TNF-α、TGF-β1及其mRNA在孕早期胚胎停育患者及正常妊娠孕妇蜕膜组织中的表达,探讨二者对于胚胎停育的影响,给孕早期胚胎停育的诊断和治疗提供新的思路。
1 资料与方法
1.1 一般资料
选取2020年11月至2021年10月就诊于该院妇产科门诊并经B超确诊的40例早期胚胎停育患者为观察组,另选取40例同期正常妊娠并自愿要求人工流产的孕妇为对照组。两组均停经12周以内,无生殖系统感染或自身免疫性疾病。两组年龄、BMI、血小板计数、血红蛋白、白细胞计数、流产史、吸烟史、既往慢性病史等均无明显差异(P>0.05),两组既往胚胎停育史有明显差异(P<0.05),见表1。本研究经本院伦理委员会审核批准(202112070028),患者均知情同意。
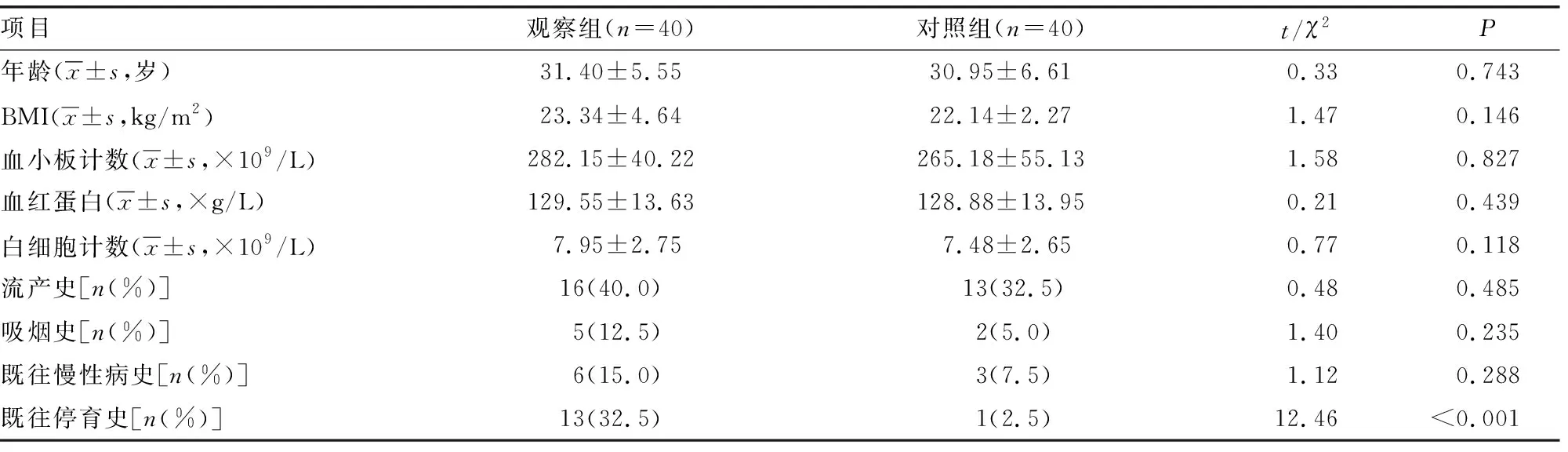
表1 两组一般资料比较
1.2 方法
1.2.1标本的收集与储存
在人工流产期间分别收集两组患者的蜕膜组织,无菌生理盐水多次清洗后,放入冻存管于液氮中冻存。
1.2.2免疫组织化学法检测蜕膜组织TNF-α和TGF-β1的表达
取蜕膜组织用4%多聚甲醛组织固定液,梯度乙醇脱水,石蜡包埋切片;将切片脱蜡水化,柠檬酸盐修复液(pH 6.0)高压煮沸后放入切片,加热2 min进行抗原修复,蒸馏水和磷酸盐缓冲液(PBS)冲洗3次后,用3%过氧化氢(H2O2)去离子水进行封闭,室温放置15 min;滴加TGF-β1抗体及TNF-α单克隆抗体(一抗,北京中衫金桥有限公司),放入4 ℃冰箱过夜,次日复温,PBS冲洗3次后加入山羊抗兔IgG抗体(二抗),室温孵育30 min后PBS冲洗5 min,重复3次;经二氨基联苯胺(DAB)染色3~5 min,苏木素复染、冲洗;脱水、透明、封片。光学显微镜[蔡司科技(苏州)有限公司]下观察分析。细胞染色程度评分:无色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分;阳性细胞比例评分:0~5%计0分,>5%~25%计1分,>25%~50%计2分,>50%~75%计3分,>75%计4分。细胞染色程度评分及阳性细胞比例评分相乘为最终得分,最终判定标准:0分代表阴性(-),1~4分代表弱阳性(+),5~8分代表中度阳性(++),9~12分代表强阳性(+++)。总阳性表达率=弱阳性+中度阳性+强阳性/总例数×100%。
1.2.3实时荧光定量逆转录PCR(RT-qPCR)法检测蜕膜组织TNF-α和TGF-β1 mRNA的表达
将待测蜕膜组织倒入液氮研磨至粉状,加入1 mL TRIzol裂解液充分混匀,振荡后静置 5~10 min;加入0.2 mL氯仿,室温静置3 min;4 ℃、12 000 r/min离心15 min;取上清液加入等体积异丙醇,摇匀静置10 min,4 ℃、12 000 r/min离心10 min;弃上清液,加1 mL提前预冷好的无水乙醇进行沉淀,再次混匀;4 ℃、12 000 r/min离心5 min,弃上清液待用;加入焦碳酸二乙酯(DEPC)水溶解RNA,采用紫外分光光度计(德国Eppendorf公司)测量260和280 nm处吸光度值,测量RNA溶液浓度;使用TIANS cript RT试剂盒(北京天根生物科技有限公司)进行逆转录合成cDNA第1条链;使用SYBR Green试剂盒(北京天根生物科技有限公司)在荧光定量 PCR 仪[伯乐生命医学产品(上海)有限公司]上进行实时荧光定量PCR,引物如下:TNF-α正向为5′-CAC AGT GAA GTG CTG GCA AC-3′,反向为5′-GAT CAA AGC TGT AGG CCC CA-3′;TGF-β1正向为5′-CAC CTT GGG CAC TGT TGA AGT-3′,反向为5′-TCC CTG CAT CTC AGA GTG TTG-3′;3-磷酸甘油醛脱氢酶(GAPDH)正向为5′-GAA TGG GCA GCC GTT AGG AA-3′,反向为5′-ATC ACC CGG AGG AGA AAT CG-3′。反应程序:95 ℃预变性15 min;95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸30 s,40个循环。用2-ΔΔCt法测定目的基因的相对表达水平。
1.3 统计学处理
2 结 果
2.1 两组蜕膜组织TNF-α和TGF-β1的表达
TNF-α和TGF-β1在两组蜕膜组织中均有阳性表达,主要分布在滋养细胞的细胞膜或细胞质中,呈现棕黄色颗粒。TNF-α在观察组蜕膜组织呈强阳性表达,在对照组蜕膜组织呈弱阳性表达,见图1A、B;TGF-β1在观察组蜕膜组织呈弱阳性表达,在对照组蜕膜组织呈强阳性表达,见图1C、D。观察组TNF-α总阳性表达率为80.0%(32/40),对照组为47.5%(19/40);观察组TGF-β1总阳性表达率为52.5%(21/40),对照组为75.0%(30/40);两组蜕膜组织TNF-α和TGF-β1表达情况比较,差异均有统计学意义(P<0.05),见表2。

A、B:分别为观察组、对照组蜕膜组织TNF-α的表达;C、D:分别为观察组、对照组蜕膜组织TGF-β1的表达。

表2 两组蜕膜组织TNF-α和TGF-β1表达情况比较(n)
2.2 两组蜕膜组织TNF-α和TGF-β1 mRNA表达水平比较
观察组TNF-α mRNA相对表达水平高于对照组,TGF-β1 mRNA相对表达水平低于对照组,差异均有统计学意义(P<0.05),见表3。

表3 两组蜕膜组织TNF-α和TGF-β1 mRNA相对表达水平比较
2.3 蜕膜组织TNF-α和TGF-β1 mRNA表达水平与胚胎停育的关系
采用两组蜕膜组织TNF-α和TGF-β1 mRNA相对表达水平的均值为临界值(TNF-α、TGF-β1 mRNA分别为3.59、0.81),高于临界值为高表达水平,低于临界值为低表达水平,进一步分析TNF-α和TGF-β1表达与胚胎停育之间的关系,结果提示:蜕膜组织TNF-α和TGF-β1 mRNA相对表达水平均与胚胎停育的发生有关(P<0.05),见表4。
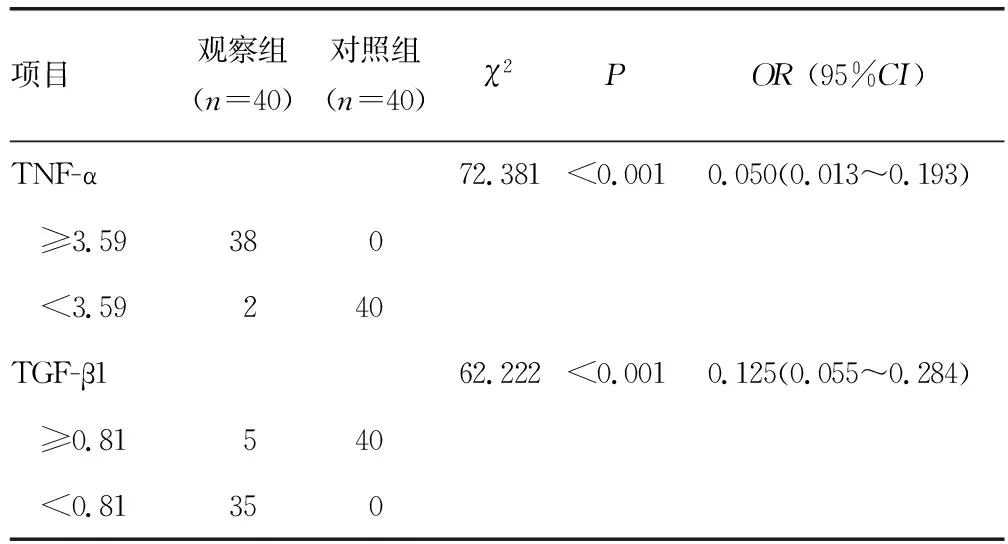
表4 蜕膜组织TNF-α和TGF-β1 mRNA相对表达水平与胚胎停育的关系(n)
3 讨 论
为了保证妊娠过程的顺利,母体与胚胎之间需协调一致[4]。在正常妊娠过程中,滋养细胞通过入侵并着床子宫内膜及肌层,侵入母体血管,促进胎盘锚定,形成生理性子宫血管重铸,为胚胎发育提供需求[5-6],期间滋养细胞会有一定程度的凋亡,若凋亡过度,会影响胚胎植入、着床及生长,从而导致流产[7]。此外,妊娠是一种独特的半同种移植过程[8],正常状态下胚胎在母体中生长发育不受排斥,但若母胎界面免疫耐受失衡则会导致胚胎停育的发生。
TNF-α是一种由巨噬细胞生成并且具有多种生物学功能的细胞因子,可参与机体免疫调节、体内雌孕激素调节、炎症反应及器官生成等,对肿瘤与病毒感染具有抑制作用[9-10],并在女性胚胎植入过程中发挥重要作用。研究表明,适量的TNF-α可以促进滋养细胞的正常增殖、分化及凋亡,改善孕妇的能量代谢,维持妊娠[11-12]。胚胎对于母体而言相当于同种异源物质,在着床过程中,由于辅助性T淋巴细胞(Th)1/Th2细胞免疫调节的存在,母体对胚胎不会产生排斥。Th1/Th2在胚胎发育过程中起到关键作用,具体表现为早期妊娠排斥与耐受的平衡。Th1主要分泌TNF-α、白细胞介素(IL)-2等细胞因子,介导细胞免疫反应,产生胚胎排斥作用;Th2主要分泌IL-4、IL-5、IL-6等细胞因子,介导体液免疫反应,形成母-胎免疫耐受,保护胎儿不被母体攻击[13-14]。妊娠的良好结局依赖于Th1和Th2的功能平衡,其失衡可能导致妊娠结局改变[15-16]。据王丽丽等[17]研究表明,自然流产患者蜕膜组织TNF-α表达水平高于正常妊娠并要求人工流产者,可能是由于TNF-α表达升高,Th1/Th2平衡被打破,偏向Th1,产生胚胎排斥作用引发不良妊娠结局。郑玫等[18]研究发现,稽留流产患者血清TNF-α表达水平高于正常早孕妇女,考虑TNF-α表达升高时破坏了Th1/Th2平衡,诱发免疫过度,从而导致稽留流产的发生。本研究结果发现,两组蜕膜组织滋养细胞的细胞质和细胞膜中均可见TNF-α阳性表达,且观察组蜕膜组织TNF-α阳性表达程度、TNF-α mRNA相对表达水平均明显高于对照组(P<0.05)。分析TNF-α过表达激发Th1型免疫反应,引起母体对胚胎的免疫反应,产生不利于妊娠的因素,破坏母体与胚胎的内平衡,从而导致胚胎停育的发生。此外,TNF-α还能促进炎症血栓形成,导致胚胎植入过程障碍,从而产生胚胎停育。总之,TNF-α表达升高可能破坏母体免疫耐受的建立,使胚胎植入过程受到影响,从而导致胚胎停育。
TGF-β1作为一种多功能的细胞因子,可以通过调节子宫内膜蜕膜化、滋养细胞侵入和黏附、母胎免疫耐受的建立等过程,参与妊娠早期胚胎细胞增殖、生长及发育[19-21]。有学者发现,E-钙黏连蛋白(E-cadherin,E-Cad)可出现在蜕膜上皮细胞及绒毛滋养细胞中[22],E-Cad能够维持细胞系统稳定,参与细胞的分化与侵袭[23]。当E-Cad异常表达可降低子宫内膜容受性,改变滋养细胞的入侵深度和黏附度,影响胚胎着床,从而影响胚胎的发育过程[24-25]。王冬亮等[26]研究发现,TGF-β1主要通过TGF-β/Smads信号传导通路下调E-Cad表达,当TGF-β1水平下调时,E-Cad 表达水平升高,胚胎着床失败,从而导致胚胎停育的发生。子宫内膜完成蜕膜化是胚胎成功植入的必要条件,在此过程中还需要多种细胞因子参加。TGF-β1表达升高可以增强蜕膜基质细胞趋化因子和配体的表达,改变子宫内膜容受性,有利于子宫内膜完成蜕膜化[27]。在本研究中,TGF-β1在早期胚胎停育患者蜕膜组织中的表达水平较低,而在早期正常妊娠孕妇蜕膜组织中表达水平较高。这可能是由于TGF-β1作为其家族中免疫性最强的一种因子,能够调节母胎免疫平衡,使胎儿不被母体的免疫系统攻击。当TGF-β1表达降低时,免疫调节功能失衡,免疫耐受建立受阻,从而使母体排斥胚胎,最终导致胚胎停育。
综上所述,TNF-α和TGF-β1在维持胚胎发育的过程中起着重要作用,当TNF-α表达高于正常水平或TGF-β1 表达低于正常水平,可能导致母胎免疫耐受失调,从而导致胚胎停育。TNF-α和TGF-β1的测定可能为早期胚胎停育的预测和治疗提供临床依据。但由于胚胎停育的病因和发病机制复杂,还需要进一步研究。

