16例头颈部毛发结构来源肿瘤的临床特征和超声表现分析*
梁 莹,戴九龙,何发伟,范玉亭,戴 全,卢 漫△
(1.成都中医药大学医学与生命科学学院,成都 611137;2.四川省肿瘤临床医学研究中心/四川省肿瘤医院·研究所/四川省癌症防治中心/电子科技大学附属肿瘤医院超声医学中心,成都 610041)
皮肤肿瘤种类繁多,毛发作为皮肤附属器官是肿瘤的好发部位,其中外毛根鞘囊肿是最常见的毛发肿瘤之一,其发病率可达5%~10%[1],毛囊瘤、增生性毛根鞘瘤等也偶见于临床。头皮等毛发密度大、代谢旺盛的部位是毛发肿瘤的常见部位,但由于头皮等位置较为隐蔽,加之多数肿瘤为良性,生长缓慢,因此常导致患者延迟就诊。本文回顾性分析16例头颈部毛发结构来源肿瘤的临床特征和超声表现,旨在加深对本类病变的认识,现报道如下。
1 资料与方法
1.1 一般资料
收集2017年12月至2022年1月在四川省肿瘤医院诊治的头颈部毛发结构来源肿瘤患者16例,其中男7例,女9例。发病年龄15~71岁,平均(38.3±14.9)岁,就诊年龄27~73岁,平均(49.5±14.9)岁,从发现病变到就诊间隔时间1个月至40年。14例为单发,2例为多发,共20个病灶。13例位于头皮,其中顶部6例,枕部7例,共17个病灶;2例位于项部,1例位于颏部,各1个病灶。所有病灶均于切除术前行超声检查,其中4例行超声造影检查。所有病灶均行组织病理学检查,以病理学为诊断金标准,外毛根鞘囊肿12例,16个病灶;毛囊瘤2例,增生性外毛根鞘瘤伴脂溢性角化症1例,毛发漏斗部囊肿1例,各1个病灶。患者签署知情同意书后行超声造影检查。
1.2 仪器与方法
使用Philips EPIQ5(线阵探头,频率5~12 MHz)、GE logiq E9(线阵探头,频率5~12 MHz)彩色多普勒超声诊断仪行超声检查。患者以仰卧位、俯卧位或侧卧位接受检查,充分暴露病变部位。部分患者剃除病变区域的毛发。测量病灶的最大径,并在与之垂直的最大切面上测量另外2条径。观察病变累及的层次及形态、边缘、内部回声、后方回声、血流信号(参照 Adler半定量法[2]对病变血流丰富程度进行分级),观察病变与周围组织的关系。
1.3 统计学处理
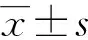
2 结 果
2.1 临床表现
16例头颈部毛发结构来源的肿瘤临床表现,见表1。
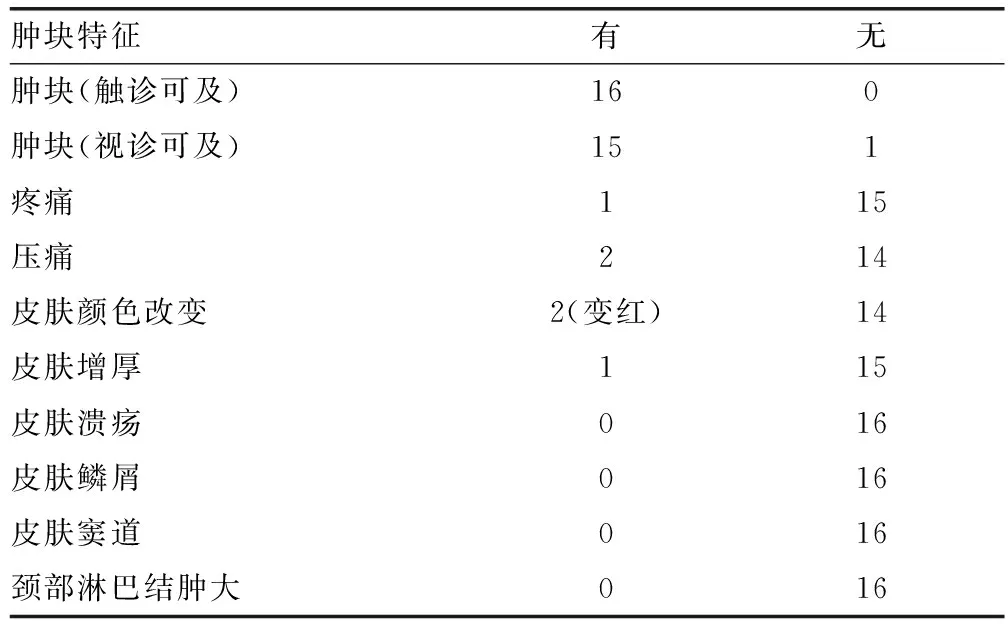
表1 16例头颈部毛发结构来源肿瘤的临床表现(n)
2.2 超声表现
外毛根鞘囊肿12例,男、女各6例。10例为单发,2例为多发(均为3个病灶),共16个病灶,其中9例13个病灶位于头皮,其余3例为项部2例、颏部1例。病灶最大径0.8~9.8 cm,平均(2.58±1.61)cm,最大病灶位于颏部,约9.8 cm×4.1 cm×6.6 cm。超声诊断为外毛根鞘囊肿5例,误诊为表皮样囊肿3例,仅提示良性病变未提示具体诊断4例,诊断准确率为41.7%。1例仅累及皮下组织,其余11例的15个病灶均累及真皮层及皮下组织。灰阶超声显示,所有病灶均为轮廓较清晰、形态较规则的混合回声结节:6个结节表现为中间部分规则的均质/不均质高回声,周边部分环状低回声(图1A),周边低回声环较厚者形成“靶环征”样回声纹理;4个结节表现为无回声结节内伴不规则的稍高回声团块,部分团块内可见点状强回声(图1B、C);3个结节表现为厚壁囊肿样结节,囊壁厚度较均匀,内壁不光滑,囊液较少;2个结节表现为囊壁厚度不均的厚壁囊肿伴低回声团,囊液呈密集点状弱回声(图1D);1个结节表现为不均质的低回声伴点状、短线状强回声(图1E)。彩色多普勒超声显示,16个结节均为Adler 0级。4例行超声造影,均未见增强(图2A、B)。
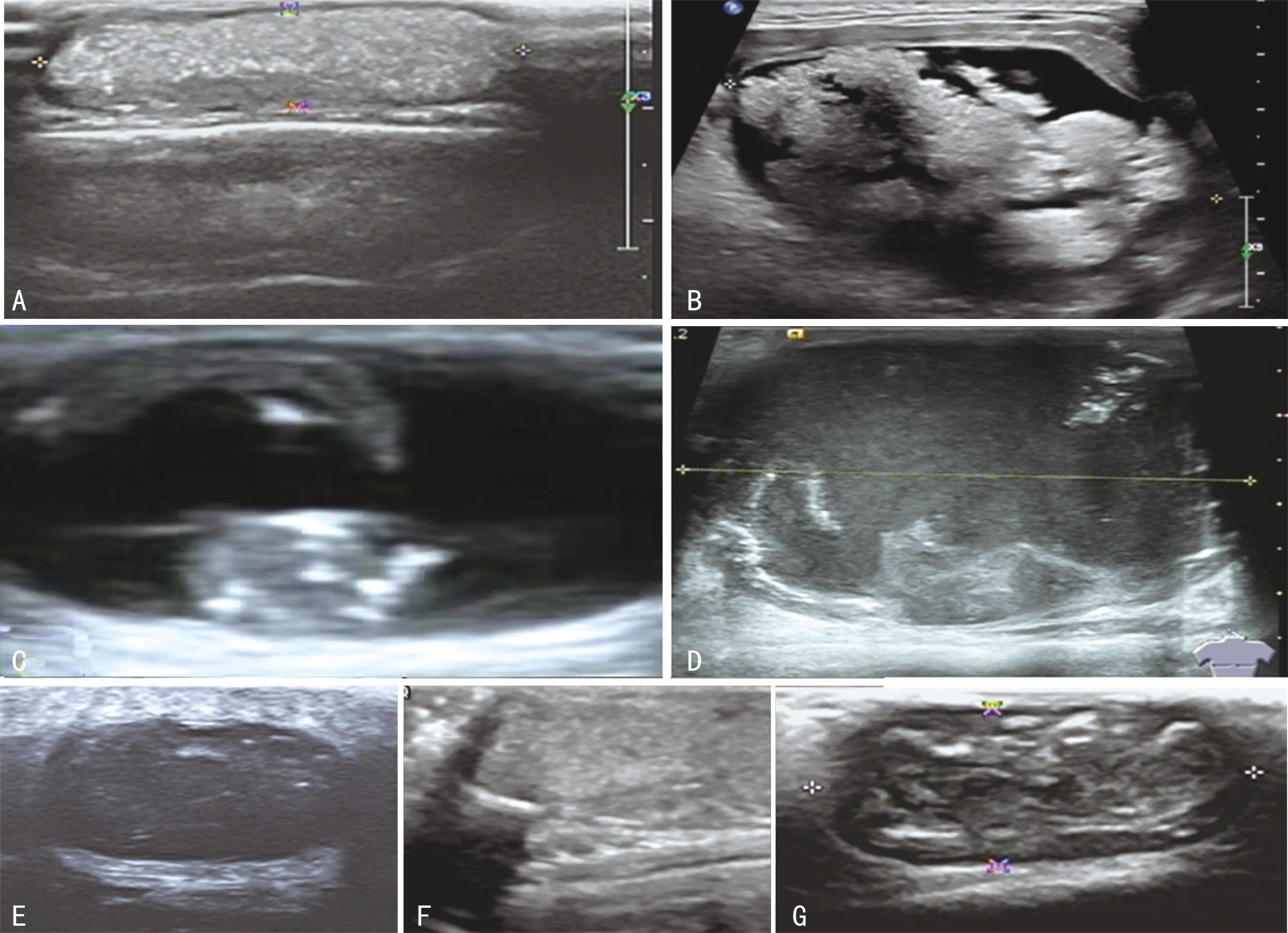
A:45岁女性患者,发现头皮肿物10年; B:35岁男性患者,发现颏部肿物7年;C:66岁女性患者,发现枕部肿物15年;D:48岁男性患者,发现头顶肿物40年;E:46岁女性患者,发现左枕部肿物8年;F:49岁女性患者,发现左枕部肿物8年;G:72岁女性患者,发现枕部肿物20余年。

A:73岁女性患者的超声造影图像(发现项部肿物2年);B:35岁男性患者的超声造影图像(发现颏部肿物7年);C:29岁男性患者的彩色多普勒超声图像(发现头顶部肿物3年)。
毛囊瘤2例,分别位于左枕部和头顶部,均为轮廓清晰、形态规则的椭圆形结节。左枕部结节大小约2.6 cm×1.6 cm×1.9 cm,呈不均质稍高回声伴后方回声增强(图1F),血流Adler 0级,病理提示该结节合并纤维增生及肉芽肿。头顶部结节大小约3.1 cm×0.6 cm×2.4 cm,呈不均质低回声伴后方回声增强,基底部探及血流信号Adler 2级(图2C),病理提示该结节合并感染。
增生性外毛根鞘瘤1例(图1G),位于枕部,表现为轮廓清晰、形态规则的椭圆形结节,中间呈稍高回声伴多发短条状、斑片状强回声,边缘呈环状低回声,血流信号Adler 0级。结节浅面的皮肤层增厚,探及斑片状低回声,病理提示为脂溢性角化症。
毛囊漏斗部囊肿1例,表现为轮廓清晰、形态规则的椭圆形厚壁囊性结节,伴明显的后方回声增强和侧方折射声影,血流信号Adler 0级。
3 讨 论
头颈部,尤其是头皮,由于毛发茂密、代谢旺盛,是毛发肿瘤的好发部位[3]。本研究中,外毛根鞘囊肿是最常见的头颈部毛发肿瘤,该病又称毛鞘囊肿或毛鞘峡部-退行性囊肿,是常染色体显性遗传疾病,多位于头皮[3-14],也可发生于阴囊、外阴、球结膜、肘部等罕见部位[15-21]。本研究中,81.2%的外毛根鞘囊肿位于头皮,与文献报道相符。文献报道常见为多发,但本研究中12例仅有2例(2/12,16.7%)为多发;DÜNDAR 等[22]和HE等[23]报道本病好发于女性,但本研究中男、女各占50%,推测可能与不同种群的性别差异或人群的代表性等因素有关。在超声上,外毛根鞘囊肿可有多种表现,与囊内容物的性状和囊壁是否破裂,是否继发增生、感染、肉芽肿等因素相关。本病常表现为轮廓清晰、形态规则的类圆形或椭圆形结节,发生破裂时形态可不规则。少数囊壁薄而光滑,多数囊壁有不同程度的增厚。囊内容物可能包含破碎细胞、角化物、胆固醇结晶等,呈豆渣样或淤泥状,因此回声不均,仅少数囊肿内含清亮囊液,剖开后迅速流失。如囊内容物为有形成分且充填囊腔并伴有囊壁增厚,则形成超声上常见的典型“靶环征”,即结节中间为不均质的高回声,周边为厚环状低回声,其为外毛根鞘囊肿最具代表性的超声表现。刘佩佩等[5]报道83.3%的病例可见“靶环征”。曹飞燕等[24]报道75.0%的病例可见“靶环征”。彩色多普勒超声图像上,外毛根鞘囊肿无血流信号,合并增生、感染时则可在囊壁区域或其周边显示不同程度的血流信号。超声造影能使血液中的微气泡在声场中产生强烈的背向散射和非线性效应获得对比增强的超声影像,能动态观察靶目标组织的微循环灌注,因此能够更加真实、准确地反映病灶形态学特点和范围[25]。本研究中4例行超声造影,各期均无增强,可进一步证实结节的囊肿性质。在超声上,外毛根鞘囊肿需与表皮样囊肿鉴别,赵梦竹等[3]认为,二者在累及层次、边界、形态、后方回声及内部血流分级等方面无差异,但前者更易发生于头皮,并且常有钙化灶和小片状液性无回声区,可作为鉴别诊断的依据。然而,当外毛根鞘囊肿合并钙化时,尚需与钙化上皮瘤鉴别,后者多见于青少年,没有囊壁结构,钙化更为常见,彩色多普勒超声上多可探及不同程度的血流信号,超声造影时可见不同程度的增强。
本研究中2例毛囊瘤和1例增生性外毛根鞘瘤的影像学表现均少见于文献。毛囊瘤又称毛囊上皮瘤,是一种来源于毛囊组织的良性错构瘤,临床少见,好发于面部,尤其多见于鼻部,而头皮、颈部、眼睑、四肢等处罕见[26-27]。2例毛囊瘤中1例呈高回声,血流Adler 0级;1例呈不均质低回声,基底部血流Adler 2级,病理提示合并感染。增生性外毛根鞘瘤又称增生性外毛根鞘囊肿,良恶性仍存争议,多见于60岁以上女性,90%以上发生于头皮,少部分发生于颈、胸、背等处[28-29]。芦青等[30]报道1例大腿恶性增生性外毛根鞘瘤的超声表现,肿块边界不清,形态不规则,内呈高低混合回声伴钙化灶,血流信号丰富。本例增生性外毛根鞘瘤轮廓清晰,形态规则,中部呈高回声伴钙化灶,周边呈环状低回声,类似外毛根鞘囊肿的“靶环征”,易被误诊。
本研究中,除1例在发现病变1个月后就诊,其余15例在发现病变后2~40年就诊,延迟就诊的时间较长,这可能是本研究中部分病变体积较大的原因。尽管头颈部毛发结构来源肿瘤以良性为主,生长缓慢,但过度延迟诊治可能导致就诊时病变较大,造成手术切除困难或美容损害,因此应及时就诊。外毛根鞘囊肿通常含较多内容物,有时甚至完全没有液性成分,因而容易与实性肿瘤混淆,借助彩色多普勒超声和超声造影可明确其囊性性质[31],为临床诊治提供更可靠的依据。

