呼吸窘迫综合征新生患儿血浆中miRNAs的差异性表达及临床意义
张 桓, 褚瑞海, 薛 琦, 路 真
(1潍坊医学院, 山东 潍坊 261000; 2潍坊市人民医院感染科, 山东 潍坊 261000)
新生儿呼吸窘迫综合征(Respiratory distress syndrome,RDS),又称为成熟不良肺综合征(Infant respiratory distress syndrome,IRDS),是一种常见且严重的新生儿疾病,通常发生于早产儿或胎龄较小的新生儿[1-2]。RDS的发病涉及肺发育不成熟、胎儿肺泡膜发育不良、肺表面活性物质生成不足等多种因素[3],但其具体的分子机制仍未完全阐明。miRNA是一类长度约为18~24个核苷酸的小分子非编码RNA,能够通过与目标mRNA的相互作用,参与调节各种生物学过程[4]。miRNA在肺部发育和肺泡表面活性物质合成等过程中有重要的调节作用,而肺部发育不成熟和肺泡表面活性物质不足是RDS的重要原因。研究表明,许多miRNA,例如miRNA-141参与了肺泡发育和细胞分化过程的调节[5],这些miRNA可能通过与其他基因或转录因子相互作用,影响细胞的增殖、分化和功能,间接影响肺泡表面活性物质的合成与分泌[6]。另外,miRNA还可通过影响机体氧化应激损伤而参与RDS的发生和发展[7]。本研究分析RDS新生患儿和健康新生儿血浆中miRNAs的差异表达谱,筛选出差异最为明显的miRNAs,并分析其与血气指标、心肌损伤指标及氧化应激指标的关系,以其寻找RDS潜在生物学标志物。
1 方法
1.1 研究对象选择2021年1月-2023年1月潍坊市人民医院收治的68例RDS新生患儿为研究对象。纳入标准:(1)符合《实用儿科学(第5版)》中有关新生儿RDS诊断标准;(2)出生后12 h内发生呼吸窘迫;(3)患儿在本院分娩并完成全程治疗;(4)单胎妊娠;(5)足月分娩;(6)临床资料完整,且监护人对本研究知情同意。排除标准:(1)合并存在其他重要器官严重的功能障碍;(2)住院期间死亡;(3)重度窒息;(4)合并先天性畸形、先天性疾病或遗传学疾病。另外选择同期在潍坊市人民医院出生的15例年龄、性别匹配的健康新生儿为对照。两组新生儿的性别、年龄、体重差异无统计学意义(P>0.05)。本研究经潍坊市人民医院伦理委员会审查并批准(批号:2019KL0016)。
1.2 血浆样本采集抽取68例RDS新生患儿及15例健康新生儿晨起空腹肘静脉血10 mL,离心(1 500 g,10 min)分离血清,留存血浆,保存于-80℃冰箱。
1.3 RNA-seq测序随机选取6例RDS新生患儿及6例健康新生儿血浆,使用NanoPhotometer®分光光度计、Qubit®2.0荧光光度计和Agilent 2141 RNA Nano 6000分析试剂盒从血浆中提取总RNA。使用NextSeq测序平台上的SE50测序程序对合格的DNA文库进行测序,以获得高质量的序列读数。通过Bowtie对数据进行清理并与参考基因组进行比对,并使用miRDeep2软件鉴定miRNAs。DESeq分析得到差异表达的miRNAs,筛选标准为Q值<0.05,|log2 fold change|>2。
1.4 反转录聚合酶链反应(Reverse transcription-polymerase chain reaction, RT-PCR)检测血浆miRNAs提取血浆总RNA,反转录后在CFX96实时PCR检测系统上进行RT-PCR。PCR反应条件为95℃变性20 s,然后95℃变性10 s,60℃变性20 s,70℃变性10 s,共40个循环。引物序列见表1。

表1 引物序列
1.5 血气指标、心肌损伤指标及氧化应激指标检测血气指标:用血气分析仪测定患儿动脉血氧分压(Partial pressure of oxygen,PaO2)。二氧化碳分压(Partial pressure of carbon dioxide,PaCO2)、吸氧分数(Fraction of oxygen uptake,FiO2)。PaO2/FiO2为氧合指数,是动脉血氧分压与吸入氧气浓度的比值,用于反映人体外周血液中的氧气含量。心肌损伤指标及氧化应激指标:用酶标仪检测患儿血浆肌酸激酶同工酶(Creatine kinase isoenzyme,CK-MB)、乳酸脱氢酶(Lactic?dehydrogenase,LDH)、超氧化物歧化酶(Superoxide dismutase,SOD)、丙二醛(Malondialdehyde,MDA)水平。
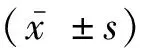
2 结果
2.1 RDS新生患儿血浆中miRNAs的差异表达RDS新生患儿与健康新生儿血浆中共1 230种差异表达miRNAs,其中693种表达上调,537种表达下调。miRNA-200b及miRNA-449差异表达倍数>20,是差异性表达最显著的miRNAs。见图1。

注: A, 层级聚类图; B, 火山图。
2.2 差异表达miRNAs的验证随机选择2种显著高表达(miRNA-200b、miRNA-449)、2种显著低表达(miRNA-596、miRNA-30c)、2种无明显差异表达(miRNA-696、miRNA-888-3p)的miRNA进行验证,RT-PCR检测结果与测序结果一致,表明测序结果有较高的准确性。见图2和表2。

注: *P<0.05。

表2 差异miRNAs的验证
2.3 不同时间点RDS新生患儿血浆miRNA-200b及miRNA-449的表达水平出院后1个月时RDS新生患儿血浆miRNA-200b及miRNA-449的表达水平均低于发作期和出院时(P<0.05),且出院时水平低于发作期(P<0.05)。见表3和图3。

注:与发作期比较, *P<0.05;与出院时比较, #P<0.05。
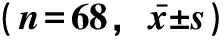
表3 不同时间点RDS新生患儿血浆miRNA-200b及miRNA-449的表达水平
2.4 血浆miRNA-200b、miRNA-449对RDS的诊断价值ROC曲线分析结果显示,血浆miRNA-200b、miRNA-449诊断RDS的曲线下面积(Area under curve,AUC)分别为0.702(95%CI:0.632~0.796)、0.763(95%CI:0.625~0.843), 灵敏度分别为73.6%、76.9%,特异度分别为69.8%、72.8%。见图4。

图4 血浆miRNA-200b、miRNA-449诊断RDS的ROC曲线
2.5 血浆miRNA-200b、miRNA-449与RDS新生患儿血气指标的相关性分析血浆miRNA-200b与miRNA-449相对表达水平分别与PaO2、PaO2/FiO2呈负相关(P<0.05),分别与PaCO2、FiO2呈正相关(P<0.05)。见表4。

表4 血浆miRNA-200b、miRNA-449与RDS新生患儿血气指标的相关性分析
2.6 血浆miRNA-200b、miRNA-449与RDS新生患儿心肌损伤指标及氧化应激指标的相关性miRNA-200b、miRNA-449分别与CK-MB、LDH、MDA呈正相关(P<0.05),分别与SOD呈负相关(P<0.05)。见表5。

表5 miRNA-200b、miRNA-449与RDS新生患儿心肌损伤指标及氧化应激指标的相关性
3 讨论
miRNAs通过影响肺泡表面活性物质合成和肺部免疫炎症反应,参与RDS的发生和发展[7-8]。本研究对RDS新生患儿血浆进行测序,发现miRNAs有明显变化,其中miRNA-200b、miRNA-449表达水平明显升高,且差异表达倍数>20倍。另外,随着RDS病情缓解,二者表达水平明显下降。以上提示miRNA-200b、miRNA-449可能参与RDS的发生和发展。分析原因可能为:(1)肺泡上皮细胞miRNA-200b及miRNA-449表达水平升高可抑制肺泡上皮细胞的成熟和重建[9],此外,miRNA-200b可以促进肺泡上皮细胞的上皮间质转化,破坏肺泡上皮细胞的完整性和功能恢复[10];(2)miRNA-449通过促进免疫炎症损伤而加重肺组织损伤[11];(3)miRNA-200b可通过抑制NKX2.1基因表达,影响肺泡上皮细胞的功能和肺发育[12-13];(4)miRNA-449可以通过抑制Bim和Bcl-2等凋亡相关基因表达,损伤肺泡上皮细胞[14-15]。本研究ROC曲线分析还发现,血浆miRNA-200b、miRNA-449诊断RDS的AUC分别为0.702、0.763,灵敏度分别为73.6%、76.9%,特异度分别为69.8%、72.8%,说明二者对RDS的诊断有一定价值。
氧合功能指标有助于评估RDA病情严重程度,并有助于预测患儿预后[16]。PaO2和PaO2/FiO2是评估肺气体交换功能的指标,其水平降低表示氧气无法充分进入血液。本研究发现,miRNA-200b及miRNA-449相对表达水平越高,患儿的PaO2、PaO2/FiO2越低,而PaCO2、FiO2越高,提示肺功能损伤越重。这是因为miRNA-200b和miRNA-449表达水平升高可导致肺泡上皮细胞功能障碍和肺泡结构破坏,进而影响血氧饱和度[10-11]。本研究还发现,miRNA-200b、miRNA-449分别与CK-MB、LDH、MDA呈正相关,而分别与SOD呈负相关,说明miRNA-200b和miRNA-449表达水平越高,患儿心肌损伤及氧化应激强度就越重。随着RDS病情进展,患儿逐渐出现呼吸困难和低氧血症,而持续存在的呼吸困难会导致患儿呼吸肌肥大,并增加胸腔内的负压[17]。这会进一步影响心脏功能,导致心肌受损。低氧血症可以导致心脏缺氧,也可能对心肌产生损伤。同时,RDS可能导致新生儿处于氧合不良的状态,从而导致氧化应激加剧[18]。氧化应激损伤会增加自由基释放,进而对细胞膜、蛋白质和DNA产生损害,这一病理变化又会加重氧化应激,造成恶性循环[19]。
综上所述,RDS新生患儿血浆miRNAs有明显异常表达,其中miRNA-200b、miRNA-449差异较为显著,二者与呼吸功能损伤、心肌损伤和氧化应激损伤相关。研究结果提示,miRNA-200b、miRNA-449有可能成为RDS的生物学标志物,有助于该疾病的诊治。本研究也存在一定的局限性,例如样本量小、未对患者进行远期随访、未分析miRNAs在RDS中的具体作用机制。未来需要开展基础研究,进一步探讨miRNA-200b、miRNA-449在RDS中的作用及机制。

