急性冠脉综合征患者血清ACE2、suPAR水平与氧化应激损伤及不良预后的关系
李 攀, 程国杰, 田苗苗, 孙越红, 李彦卓
(大兴区人民医院1急诊科, 2心内科, 3检验科, 北京 102600; 4首都医科大学附属北京天坛医院检验科, 北京 100070)
急性冠脉综合征(Acute coronary syndrom,ACS)是一组由急性心肌缺血引起的临床综合征,病理基础主要为冠脉不稳定斑块破裂或者糜烂致使不完全或完全闭塞性血栓形成[1]。随着人们饮食、生活习惯发生改变,ACS发病率逐年上升,死亡率亦随之增加。据报道,ACS患者1年后死亡率约为15%,5年累积死亡率可达20%[2]。PCI手术通过心导管技术将狭窄或闭塞的冠状动脉疏通,改善ACS患者心肌血流灌注,已成为治疗ACS的重要手段,但仍有部分患者术后仍存在支架内再狭窄或者再灌注损伤风险,导致其预后不良[3]。早期评估ACS病情及预后有重要的临床意义。血管紧张素转化酶2(Angiotensin converting enzyme 2,ACE2)为一种1型跨膜蛋白,主要分布于心脏和肾脏,胃肠道、肺、脑、肝等脏器中也相继发现ACE2。有研究发现,ACE2在小鼠心肌梗死边缘以及梗死后存活心肌中的水平明显上调[4],合并心肌损伤的新冠肺炎患者外周血液中ACE2呈高表达[5]。可溶性尿激酶型纤溶酶原激活物受体(Soluble urokinase type plasminogen activator receptor,suPAR)是尿激酶型纤溶酶原激活物受体的可溶形式,与炎症反应以及心力衰竭、冠心病、高血压、心房颤动等心血管疾病发病、进展等关系密切[6]。氧化应激是ACS发生和发展中的重要环节,ACS预后欠佳患者体内氧化应激更为严重[7]。目前对ACS发病机制认识有限,ACS诊治和预后评估方面的标志物还较少,且ACE2、suPAR与ACS氧化应激、术后心血管不良事件等的关系尚未有定论。基于此,本研究选择ACS患者为研究对象,探讨ACS患者血清ACE2、suPAR水平与氧化应激损伤、不良预后的关系,现报道如下。
1 资料与方法
1.1 一般资料选择2019年9月-2022年9月大兴区人民医院收治的125例ACS患者作为ACS组,并选取与之性别、年龄相匹配的50例冠脉造影结果完全正常者作为对照组。ACS组:年龄22~79岁,平均年龄(65.52±5.17)岁;男性86例;吸烟史40例;饮酒史44例;高血压史69例;2型糖尿病史33例;高脂血症史74例;发病至就诊时间(13.56±0.82)h;Gensini评分(40.24±8.56)分。对照组:年龄21~77岁,平均(64.94±5.23)岁;男性35例;吸烟史18例;饮酒史20例。两组性别、年龄和饮酒史无显著差异(P>0.05)。纳入标准:ACS诊断标准符合《急性冠脉综合征急诊快速诊治指南(2019)》[8];拟行经皮冠状动脉介入术(Percutaneous coronary intervention,PCI);年龄20~80岁;病历资料完整;签署知情同意。排除标准:合并血液系统疾病、自身免疫性疾病、精神疾病以及心、肝、肾功能不全;近4周内存在急慢性严重感染;妊娠期或哺乳期女性;有严重心脏瓣膜病、先天性心脏病、重度心律失常等其他心脏疾病;依从性差;入组前已进行介入治疗;随访失访者。本研究经大兴区人民医院伦理委员会审批通过(批号:2018XL025-1)。
1.2 研究方法
1.2.1 观察指标及冠脉病变程度评估 观察指标包括性别、烟酒史、发病至就诊时间、高血压史、2型糖尿病史、高脂血症史、左室射血分数(Left ventricular ejection fraction,LVEF)、冠脉病变程度、ACS类型、心功能Killip分级、住院时间、中性粒细胞计数、淋巴细胞计数等。冠脉病变程度评估[9]采用Gensini评分:3~25分为轻度病变;26~47分为中度病变;48~69分为重度病变。
1.2.2 外周血指标测定 (1)血液样本采集:受试者入院后3 h内采集其空腹肘静脉血5 mL,以3 000 r/min、5 min离心,分离血清。(2)血清ACE2、suPAR水平测定:ELISA法测定血清ACE2、suPAR水平,试剂盒购于上海西唐生物科技有限公司、武汉伊莱瑞特生物科技股份有限公司。(3)氧化应激指标测定:硫代巴比妥酸法测定丙二醛(Malondialdehyde,MDA)水平,改良巴木式直接法检测过氧化脂质(Lipid peroxide,LPO)水平,黄嘌呤氧化法测定超氧化物歧化酶(Superoxide dismutase,SOD)水平,试剂盒分别购自南京万木春生物科技有限公司、上海瓦兰生物科技有限公司、深圳海思安生物技术有限公司。
1.2.3 随访与预后评价 通过门诊复查或者电话方式对ACS患者随访6个月,每月1次,将发生心衰、再发心肌梗死、再次血运重建、全因死亡等主要不良心血管事件(Major adverse cardiac events,MACE)者纳入预后不良患者,反之纳入预后良好患者。
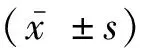
2 结果
2.1 两组血清ACE2、suPAR及氧化应激指标水平比较与对照组比较,ACS组血清ACE2、suPAR、MDA、LPO水平显著升高(P<0.05),血清SOD水平显著下降(P<0.05),见表1。

表1 两组血清ACE2、suPAR及氧化应激指标水平比较
2.2 不同病变程度ACS患者血清ACE2、suPAR水平比较轻度病变、中度病变、重度病变患者的血清ACE2、suPAR水平及Gensini评分依次上升,组间差异均有统计学意义(P<0.05)。见表2、图1。

注:与轻度病变比较, *P<0.05; 与中度病变比较, #P<0.05。

表2 不同病变程度ACS患者血清ACE2、suPAR水平比较
2.3 ACS患者血清ACE2、suPAR水平与氧化应激及Gensini评分的相关性Pearson检验显示,ACS患者血清ACE2、suPAR与MDA、LPO、Gensini评分呈正相关(P<0.05),与血清SOD呈负相关(P<0.05)。见表3、图2。

图2 ACS患者血清ACE2、suPAR水平与MDA、LPO、SOD及Gensini评分的相关性

表3 ACS患者血清ACE2、suPAR水平与氧化应激及Gensini评分的相关性
2.4 预后良好患者与预后不良患者临床资料及各指标水平125例ACS患者中预后不良45例,发生率为36.00%。两组性别、烟酒史、高血压史、2型糖尿病史、高脂血症史、ACS类型、心功能Killip分级≥3级占比、住院时间≥7 d占比、中性粒细胞计数、淋巴细胞计数差异无统计学意义(P>0.05);与预后良好患者比较,预后不良患者年龄、发病至就诊时间、Gensini评分、ACE2、suPAR、MDA、LPO显著升高(P<0.05),LVEF、SOD显著降低(P<0.05)。见表4。

表4 预后良好患者与预后不良患者临床资料及各指标水平
2.5Logistic回归模型分析ACS患者预后不良的危险因素和保护因素以预后不良为因变量,将表4中有统计学意义的因素作为自变量,赋值情况见表5,建立Logistic回归模型结果显示,年龄、发病至就诊时间、Gensini评分、ACE2、suPAR、MDA、LPO是ACS患者预后不良的危险因素(P<0.05),LVEF、SOD为其保护因素(P<0.05),见表6。

表5 ACS患者预后不良的变量赋值

表6 ACS患者预后不良的危险因素和保护因素
2.6ROC曲线分析血清ACE2、suPAR对ACS预后不良的预测价值绘制ROC曲线发现,血清ACE2预测ACS预后不良的曲线下面积(Area under curve,AUC)、灵敏度、特异度依次为0.712、85.61、54.03,血清suPAR预测ACS预后不良的AUC、灵敏度、特异度依次为0.748、81.60、64.02。两项联合预测ACS预后不良的AUC、灵敏度、特异度依次为0.894、88.00、84.01,显著优于单项检测(P<0.05)。见表7和图3。

图3 血清ACE2、suPAR预测ACS预后不良的ROC曲线

表7 血清ACE2、suPAR对ACS预后不良的预测价值
3 讨论
ACS发病和进展机制复杂,氧化应激与ACS关系密切[10]。ACS发生时,心肌组织处于缺血缺氧状态,氧自由基生成增多、清除减少,氧化与抗氧化系统失衡,造成心肌组织损伤,表现为外周血液中MDA、LPO水平上调,SOD水平下调[11-12]。本研究中,ACS患者血清MDA、LPO水平明显升高、SOD水平明显降低,这3项指标是反映机体氧化应激水平的常用指标,此结果提示ACS患者体内存在严重的氧化应激损伤。
ACE是肾素-血管紧张素-醛固酮系统(Renin angiotensin aldosterone system,RAAS)的限速酶,可催化血管紧张素I(Angiotensin I,AngI)转化为AngII。ACE2为ACE的同系羧肽酶,全长805个氨基酸,定位在极化细胞顶端膜上。ACE2与ACE的催化位点相同,但ACE2可将ACE介导合成的AngII代谢成Ang1-7,并且能与下游Mas受体结合,而发挥抗氧化应激、抑制炎症、抗细胞增殖、抗心肌纤维化等作用,同时还可通过提高舒缓激肽活性,诱导内皮超极化因子(Endothelium-derived hyperpolarizing factor,EDHF)、前列腺素、一氧化氮释放,而起到舒张血管效果。ACE2与ACE被认为是心血管保护因子之一[13]。有研究发现,心肌梗死后外周血内ACE2活性明显增强,并与左心室功能、梗死面积、心室不良重构有关;血清ACE2在糖尿病心肌病中显著升高,且其水平随心功能恶化而上升,说明ACE2可参与糖尿病心肌病发病和病情进展过程[14-15]。本研究结果显示,ACS患者血清中ACE2呈高表达并与Gensini评分呈正相关,提示ACE2可能参与了ACS发病与进展过程。ACS发生后,患者心脏内过表达ACE2,以对抗ACE-Ang II-AT1轴对心脏造成的不利影响,保护残存心功能,此类心肌缺血后心脏内ACE2水平上升现象同时也可表现在外周血液层面,故血清ACE2升高可能是ACS患者机体的代偿性保护作用[16]。本研究结果显示,ACS患者血清ACE2表达水平与MDA、LPO呈正相关,而与血清SOD呈负相关。ACE2具有抗氧化应激损伤的作用,故推测ACS发病和进展过程中血清ACE2水平上调可能与患者体内氧化应激过度激活有关。此外,Masson等[17]通过建立心肌ACE2过表达模型,观察到ACE2持续过表达对大鼠的心脏结构和功能有不良影响,如心肌细胞肥大、心肌间质纤维化等;Donoghue 等[18]发现心脏内持续高表达ACE2可引起大鼠恶性心律失常及高度房室传导阻滞(Advanced atrioventricular block,AVB),并增加猝死发生率,ACS患者中ACE2水平越高者冠脉病变程度越重、预后不良风险越大。
多项研究显示,ACS发生和发展过程中炎症反应发挥重要作用,慢性炎症反应可引起左室收缩功能障碍以及心室重塑,促使心功能恶化,加剧心肌损伤[19-20]。suPAR为新型炎症标志物之一,在炎症刺激下,体内suPAR可从细胞表面裂解,裂解后释放至血液中,进而引起外周血内suPAR含量增多。近年有研究显示[21-22],冠心病患者中suPAR呈异常高表达且其水平与冠脉狭窄程度有关;老年慢性心衰患者中发生MACE者外周血suPAR水平较未发生MACE者明显上升且有较好的预测价值。本研究中,ACS组血清suPAR明显高于对照组,而且患者血清suPAR水平与MDA、LPO、SOD相关。氧化应激在ACS急性血栓形成中起重要作用[23],而suPAR可增强机体氧化应激,参与组织损伤机制[24],故推测suPAR可能通过氧化应激途径参与了ACS发病过程。同时还发现suPAR在冠脉病变程度、预后状况不同的ACS患者中存在明显的水平差异,相较于轻中度冠脉病变以及预后良好患者,重度冠脉病变和预后不良患者suPAR水平均显著上升,且suPAR水平升高为ACS预后不良的危险因素,由此说明suPAR与ACS病变进展及不良预后有关。此外ACS患者本身存在明显的炎症反应,炎性环境下suPAR释放会增多,而suPAR又会使更多的炎症细胞聚集于内膜下,促使炎症因子大量分泌,形成正反馈,放大炎症效应,加重冠脉病变程度,致其不良预后[25]。本研究结果显示,除了年龄、发病至就诊时间、Gensini评分、LVEF等常见因素外,MDA、LPO、SOD也是影响ACS预后的相关因素;这与以往研究相符[26-27]。发生ACS后,患者体内氧化应激明显激活,导致心肌微循环障碍,加重血管内皮损伤,促使血液高凝状态,导致病情加重,预后不良[28]。本研究ROC曲线显示,血清ACE2联合suPAR预测ACS预后不良的AUC值可达0.894,提示其预测效能优,两者有望成为评估ACS临床预后的新型标志物。ACS入院后及时检测血清ACE2、suPAR水平,并结合年龄、发病至就诊时间、Gensini评分、LVEF等危险因素,有助于尽早筛查预后不良风险患者,进而实施干预措施,以改善患者预后。
综上所述,ACS患者外周血中ACE2、suPAR呈高水平,其水平与患者氧化应激损伤及不良预后关系密切,ACE2联合suPAR对于患者短期预后的预测价值较高。本研究也存在局限性:样本量较小,存在一定混杂、偏移因素;研究时长较短,缺乏长期随访;仅观察了ACS发病24 h内的血清ACE2、suPAR水平,未进行多时间点对比研究,故仍有待后续补充完善。

