睡眠障碍与非睡眠障碍维持性血液透析患者肠道菌群多样性分析
潘璐璐 王泽敏 陈辉 何颖雪 胡文雯 邵国建
作为终末期肾脏病患者的主要替代治疗方法,维持性血液透析(maintenance hemodialysis, MHD)可有效延长患者的生存期。但随着透析时间的增加,MHD 患者容易出现多种并发症,其中睡眠障碍较为常见,其会增加MHD 患者心血管疾病的发生风险以及死亡率[1-3]。目前对于MHD 患者睡眠障碍发生的影响因素及机制的研究,结论尚不一致。近年来,研究者发现肠道菌群能够影响大脑的活动,可能是睡眠机制的关键调节因素[4-5]。基于此,本研究通过分析睡眠障碍MHD 患者和非睡眠障碍MHD 患者肠道菌群结构的差异,探讨MHD 患者睡眠障碍与肠道菌群的关系,以期为临床上MHD 患者睡眠障碍的治疗提供新策略。
1 对象和方法
1.1 对象 选取2022 年1 至7 月在温州市中心医院根据匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)量表[6]评估为睡眠障碍(PSQI 总分≥5 分)和非睡眠障碍(PSQI 总分<5 分)的MHD 患者各30例。纳入标准:(1)年龄18~80 岁;(2)在本院规律接受MHD 治疗至少3 个月以上;(3)至少3 个月内无抗菌药物及益生菌制剂服用史。排除标准:(1)存在以下情况或疾病:精神疾病、认知功能障碍、严重心肺功能不全、恶性肿瘤、剧烈疼痛、消化系统感染、胆囊或结肠切除术后等;(2)正处于禁食或肠内、外营养支持患者;(3)患者或家属不能合作。两组患者性别、年龄、BMI 及原发病等一般资料比较差异均无统计学意义(均P>0.05),见表1。本研究经本院医学伦理委员会审查通过(批准文号:快K2021-04-040),所有患者知情同意并签署知情同意书。

表1 两组患者一般资料比较
1.2 方法
1.2.1 粪便标本采集 使用粪便微生物DNA 专用采集管收集患者新鲜粪便标本(约2~5 g),于30 min内放入-80 ℃冰箱保存。
1.2.2 标本DNA 提取和检测 采用粪便DNA 提取试剂盒(德国QIAGEN 公司)提取粪便标本总DNA,再通过琼脂糖凝胶电泳仪(美国Bio-RAD 公司)和紫外分光光度计(美国Thermo 公司)进行DNA 浓度及纯度的检测。
1.2.3 PCR 扩增 取50 ng 稀释后的基因组DNA 作为模板DNA,使用美国NEB 公司的Phusion Hot start flex 2X Master Mix 高效高保真酶对16S rDNA 基因V3-V4 可变区进行PCR 扩增,引物序列为341F(5'-CCTACGGGNGGCWGCAG-3'),805R(5'-GACTACHVGGGTATCTAATCC-3')。PCR 产物由核酸纯化试剂盒(美国Beckman 公司)纯化,Qubit 荧光仪(美国Invitrogen 公司)定量。
1.2.4 16S rDNA 高通量测序及生物学信息分析 对纯化后的PCR 产物使用Agilent 2100 生物分析仪(美国Agilent 公司)和文库定量试剂盒(美国Illumina 公司)进行评估。合格扩增产物使用NovaSeq 6000 测序仪(美国Illumina 公司)进行2×250 bp 的双端测序。将得到的原始数据进行拆分、拼接和过滤,再使用QIIME2 软件进行分析,将数据中有效序列以97%的相似度进行操作分类单元(operational taxonomic units,OUT)划分。基于NT-16S 与SILVA 数据库注释OUT,获得各样品在门和属分类学水平上的群落结构图。采用α 多样性和β 多样性进行菌群多样性分析。本研究α 多样性分析主要通过Chao1 指数、Shannon 指数和Simpson 指数进行样本内物种多样性的评估,其中Chao1 指数和Shannon 指数越大,Simpson 指数越小,代表群落α 多样性越高。β 多样性分析通过基于Bray-Curtis 距离的主坐标分析(principal co-ordinates analysis,PCoA)来反映样本间物种多样性。采用线性判别分析及效应量(linear discriminant analysis effect size,LEfSe)分析进行菌群差异性分析。
1.3 观察指标 观察并比较睡眠障碍组与非睡眠障碍组患者肠道菌群α 多样性、β 多样性、肠道菌群结构,并分析两组肠道菌群结构差异的显著性。
1.4 统计学处理 采用SPSS 25.0 统计软件。正态分布的计量资料以表示,组间比较采用两独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。计数资料以频数和构成比表示,组间比较采用χ2检验。肠道菌群生物学信息的统计分析和作图使用R 软件(Version 2.15.3)完成。P<0.05 为差异有统计学意义。
2 结果
2.1 睡眠障碍组与非睡眠障碍组患者肠道菌群α 多样性比较 睡眠障碍组患者肠道菌群的Chao1 指数为233.35±65.22,Shannon 指数为4.80±0.48,Simpson指数为0.0749±0.0253;非睡眠障碍组患者肠道菌群的Chao1 指数为235.91±59.73,Shannon 指数为4.24±0.51,Simpson 指数为0.1295±0.0570。两组患者肠道菌群的Chao1 指数比较差异无统计学意义(t=-0.159,P=0.874)。睡眠障碍组的Shannon 指数高于非睡眠障碍组(t=4.342,P<0.001),睡眠障碍组的Simpson指数低于非睡眠障碍组(t=-4.799,P<0.001)。这提示睡眠障碍组患者肠道菌群的α 多样性高于非睡眠障碍组患者。
2.2 睡眠障碍组与非睡眠障碍组患者肠道菌群β 多样性比较 PCoA 分析显示,PC1 对于样本差异的贡献值为15.01%,PC2 对于样本差异的贡献值为10.18%。睡眠障碍组与非睡眠障碍组样本在坐标图中虽有一定重合,但整体距离存在一定分离趋势,进一步Anosim 分析提示睡眠障碍组与非睡眠障碍组的群落结构差异有统计学意义(R=0.10,P=0.04),见图1。
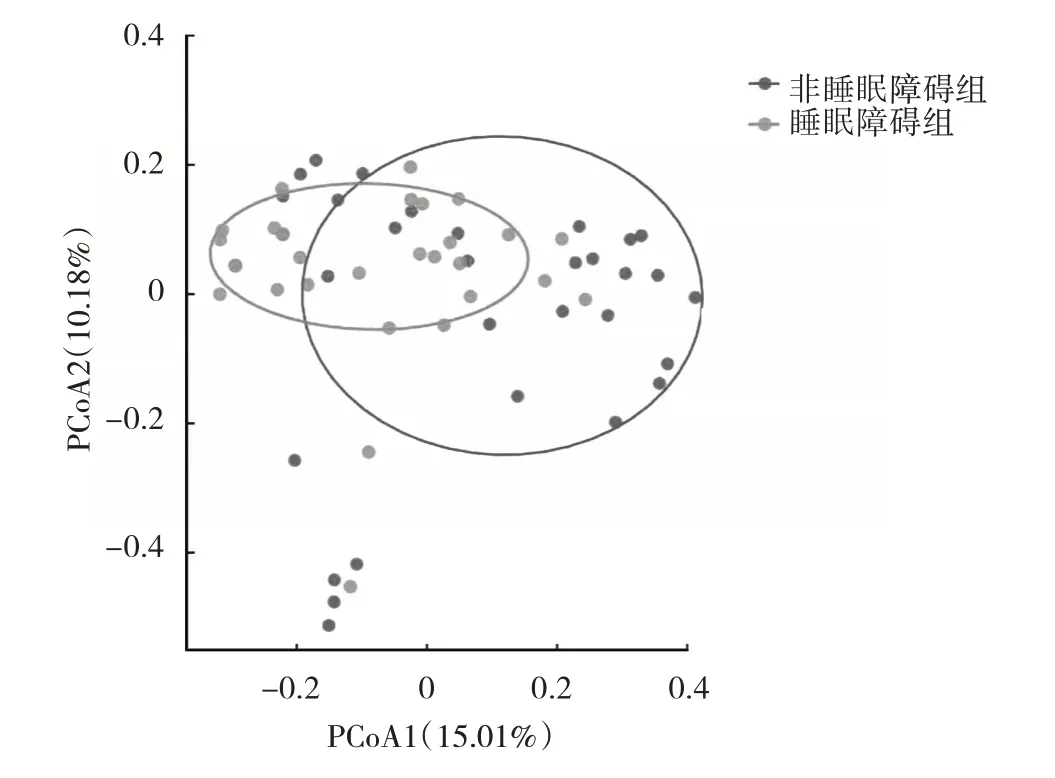
图1 两组患者肠道菌群β 多样性的PCoA 图
2.3 睡眠障碍组与非睡眠障碍组患者肠道菌群结构比较 在门分类水平,两组患者肠道菌群主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)及变形菌门(Proteobacteria)构成,这4 个菌门包含了所有样本丰度95%以上的肠道细菌。与非睡眠障碍组比较,睡眠障碍组中厚壁菌门的相对丰度明显下降,而变形菌门的相对丰度明显升高。在属分类水平,与非睡眠障碍组比较,睡眠障碍组中双歧杆菌属(Bifidobacterium)、罗氏菌属(Roseburia)及乳杆菌属(Lactobacillus)的相对丰度明显下降,而大肠杆菌-志贺氏菌属(Escherichia-Shigella)和毛螺菌属(Lachnospira)的相对丰度明显升高。
2.4 睡眠障碍组与非睡眠障碍组肠道菌群结构差异显著性分析 两组患者肠道菌群结构差异行LEfSe 分析,并制作LEfSe 分析柱状图。柱状图纵坐标是肠道菌群,横坐标是线性判别分析(linear discriminant analysis,LDA)分值,其长度代表差异的显著性。本研究LEfSe 分析的阈值设置为LDA>2.5,P<0.05。结果显示,在门水平,睡眠障碍组患者肠道菌群中拟杆菌门相对丰度显著高于非睡眠障碍组患者,厚壁菌门、放线菌门相对丰度显著低于非睡眠障碍组患者。在属水平,MHD 睡眠障碍组患者肠道菌群中拟杆菌属、大肠杆菌-志贺氏菌属、毛螺菌属、链球菌属(Streptococcus)、副拟杆菌属(Parabacteroides)、巴恩斯氏菌属(Barnesiella)及颤杆菌克属(Oribacterium)相对丰度显著高于非睡眠障碍组患者(均P<0.05),乳杆菌属、双歧杆菌属及罗氏菌属相对丰度显著低于非睡眠障碍组患者(均P<0.05)。见图2。
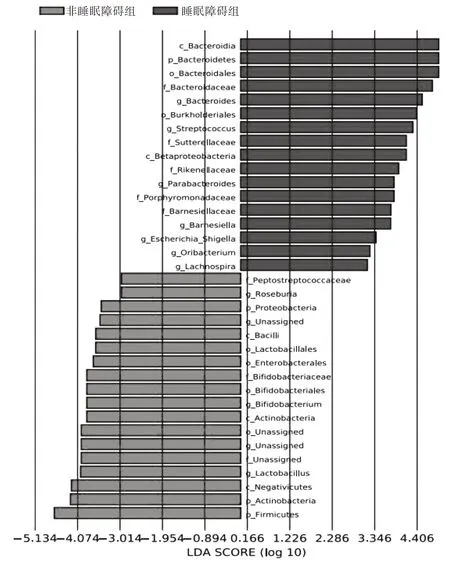
图2 两组患者肠道菌群LEfSe 分析柱状图
3 讨论
近年来,终末期肾脏病的患病人数呈现上升趋势,目前我国MHD 患者约63.2 万人[7]。睡眠障碍是困扰MHD 患者最突出的临床问题之一。睡眠障碍不仅造成MHD 患者虚弱、认知功能障碍、生活质量下降,还导致MHD 患者心血管疾病并发症和病死率的增加,严重影响MHD 患者的预期寿命。
人体肠道中存在着种类繁多的微生物群,其中厚壁菌门和拟杆菌门占整个菌群95%以上。此外还包括变形菌门、放线菌门和梭杆菌门等[8]。这些微生物不仅直接参与了人体的多项生理活动(如消化、免疫、内分泌等),还对大脑发育、情绪和认知功能具有多重影响[9]。研究发现,肠道菌群可通过多种途径影响中枢神经系统功能,并影响睡眠过程[10-11]。机体睡眠障碍的发生亦与肠道菌群的失调相关[12]。本研究初步探讨了睡眠障碍MHD 患者和非睡眠障碍MHD 患者肠道菌群的结构变化。结果显示,睡眠障碍组患者肠道菌群的α 多样性高于非睡眠障碍组患者,并且两组患者肠道菌群的β 多样性存在统计学差异。α 多样性分析是度量单个样本内有多少种微生物物种(丰富度),以及每个微生物物种所占的比例(均匀度),即关注样本自身的菌群组成与分布。当一个样本中所含微生物物种种类越多,则它的丰富度越高,所含的每种微生物物种的占比越平均,则均匀度越高。β多样性分析是度量不同样本间菌群组成的相似度大小,即关注各样本间的菌群组成差异。笔者推测,睡眠障碍MHD 患者肠道菌群结构发生紊乱,一些有害菌的增加可能导致了菌群丰富度增高。
通过LEfSe 多级物种差异判别分析,笔者发现,相对于非睡眠障碍MHD 患者,睡眠障碍MHD 患者肠道菌群中拟杆菌属、大肠杆菌-志贺氏菌属、毛螺菌属及链球菌属的相对丰度显著升高,而双歧杆菌属、乳杆菌属及罗氏菌属的相对丰度显著降低。动物研究表明,睡眠质量低下小鼠的肠道菌群中毛螺菌属丰度增多,而乳杆菌属丰度减少[13]。在人群中,失眠患者肠道菌群中拟杆菌属和毛螺菌属的丰度显著高于健康人群,而能够产生短链脂肪酸(short chain fatty acid,SCFA)的菌属的丰度显著降低[14]。作为肠道的有益菌,双歧杆菌属、乳杆菌属及罗氏菌属能够合成SCFA,在结肠运动、免疫调节及抗炎方面发挥重要作用[15-17]。一项研究表明,肠道菌群产生的SCFA 能够增加婴儿的睡眠时间[18]。双歧杆菌属和乳杆菌属还能够合成γ-氨基丁酸(gamma-aminobutyric acid,GABA),通过微生物-肠-脑轴,影响大脑功能。GABA 作为一种抑制性神经递质,能够缓解机体的焦虑行为,起到改善睡眠的作用。Spiegelhalder 等[19]亦证明GABA 水平低下能够引起睡眠障碍。大肠杆菌-志贺氏菌属归属于肠杆菌科。有研究者发现,对小鼠进行人为的睡眠剥夺后,其肠道内肠杆菌科的丰度显著升高[20]。链球菌属是一种革兰阳性兼性厌氧菌,主要将葡萄糖分解代谢产生乳酸,可能会降低肠道pH 值,导致兼性厌氧菌和厌氧菌的丰度变化,改变肠道微生物代谢,还可以穿过血脑屏障导致神经系统症状[21]。研究表明,链球菌能够导致睡眠障碍[22],并且相较于脑卒中后非睡眠障碍患者,脑卒中后睡眠障碍患者肠道菌群中链球菌属的丰度显著升高[23]。国内研究发现,Parabacteroides、Barnesiella 为抑郁症患者优势菌群[24-25],产后抑郁患者在其抑郁情绪的缓解与Oribacterium 相对丰度减少相关[26]。睡眠障碍往往与焦虑、抑郁等情况相伴随。本研究亦发现,睡眠障碍MHD 患者肠道菌群中Parabacteroides、Barnesiella 及Oribacterium 的相对丰度显著增加。
综上所述,睡眠障碍组MHD 患者肠道菌群的α多样性高于非睡眠障碍组MHD 患者,两组患者的肠道菌群结构组成存在差异。其中拟杆菌属、大肠杆菌-志贺氏菌属、毛螺菌属、链球菌属、Parabacteroides、Barnesiella 及Oribacterium 是MHD 睡眠障碍患者肠道菌群中的优势菌属,可能与MHD 患者的睡眠障碍存在相关性。但本研究样本量较小,也并未排除两组患者的生活因素及饮食因素方面的影响,上述结论有待后续更多的大样本研究明确。另外,本研究无法证实MHD 患者睡眠障碍与肠道菌群结构改变之间的因果关系及相互作用机制,亦有待后续进一步的研究探讨,以期更好地为临床治疗和干预提供理论依据。

