脐带血造血干细胞体外生成红细胞过程中高效脱核体系的研究
陈晨 占启刚 盛琦 张晶晶 应燕玲 章伟 朱发明 何吉
脐带血、成人骨髓、外周血来源的造血干(祖)细胞及胚胎干细胞、诱导多能干细胞等可在体外大量诱导生成红细胞[1]。然而在体外培养生成的红细胞中,能实现脱核的红细胞只占极少数,多数红系细胞停留在晚幼红细胞阶段,不能完成脱核步骤。已证实只有脱核的成熟红细胞才能发挥正常的生理功能,而有核红细胞的携氧功能明显较低。因此,脱核是体外生成成熟红细胞能否成功应用的关键步骤之一;但在体外培养过程中脱核效率较低[2-3]。为了提高造血干细胞生成成熟红细胞的能力,根据实验室前期研究基础,本实验选择可能促进红系细胞脱核的磷脂酰肌醇激酶(phosphatidylinositol trihydroxykinase,PI3K)、细胞松弛素B 和组蛋白脱乙酰化酶2(histone deacetylase 2,HDAC2)作为脱核剂,探讨这3 种脱核剂促红系脱核过程中的作用,以建立体外生成红细胞高效脱核体系,现报道如下。
1 材料和方法
1.1 主要试剂 CD34+细胞免疫磁珠分选试剂、CD34+细胞分选缓冲液Buffer(德国美天旎公司);1.077 Ficoll淋巴细胞分离液(美国GE 公司);pH 7.2 PBS(美国Gibco 公司);无血清培养基(Stem SpanTMSFEM,加拿大Stem Cell 公司);促红细胞生成素(erythropoietin,EPO)、干细胞生长因子(stem cell factor,SCF)、IL-3(美国PeproTech Inc 公司);CD235-FITC 抗体(美国Biolegend 公司)、SYTO-64 核酸染料(美国Invitrogen 公司);人2,3-二磷酸甘油酸(2,3-Diphosphoglycerate,2,3-DPG)酶联免疫分析试剂盒(美国Sigma 公司);ATP 测定试剂盒(美国Promega 公司);细胞松弛素B(英国abcam 公司)、PI3K(英国Millipore 公司)、HDAC2(美国Cayman Chemical 公司)。
1.2 方法
1.2.1 脐带血采集 脐带血来自浙江省脐带血造血干细胞库自愿无偿捐献者,均签订知情同意书。正常健康产妇足月顺产胎儿娩出后,立即断脐,消毒行静脉穿刺,用脐带血收集袋收集脐带血。本研究经浙江省血液中心医学伦理委员会审查通过(批准文号:省血液中心伦审2023 年研第002 号)。
1.2.2 脐带血单个核细胞分离 用0.9%氯化钠溶液1∶1 稀释脐带血,加到比重为1.077 g/mL 的淋巴细胞分离液上,1 500 r/min(423 g)离心35 min,收集中间的单个核细胞层。加入PBS 溶液重悬,2 000 r/min(751 g)离心10 min,去上清液,重复上述操作。最后用CD34+细胞分选缓冲液Buffer 300 μL 重悬细胞。
1.2.3 CD34+细胞分选富集 采用CD34+细胞免疫磁珠分选试剂(包含FcR Blocking Reagent、microbeads),严格按试剂盒说明书操作。加100 μL FcR Blocking Reagent 于上述细胞悬液中,混匀,加100 μL microbeads,混匀,2~8 ℃冰箱中孵育30 min,加10 mL Buffer,1 000 r/min(300 g)离心10 min,去上清液,加500 μL Buffer 悬浮细胞。将分选柱子放入磁铁中,加500 μL Buffer 于柱中湿润柱子,将细胞悬液加到柱中过柱,加500 μL Buffer 洗3 次。将柱子移出磁铁,放入收集管中,加1 000 μL Buffer 于柱中,加压使细胞洗下来,重复磁珠分选步骤。
1.2.4 脐带血造血干细胞体外生成红细胞体系的构建 将富集的CD34+细胞用无血清培养基混匀后,以104个细胞/mL 浓度接种至无血清培养基中,培养体系为10 mL。置37 ℃、5% CO2湿度培养箱中培养21 d,第4、7、11、15、18 天半量换液。第7 天将细胞浓度调整至105个细胞/mL,第11 天细胞浓度调整至5×105~1×106个细胞/mL,第15 天将细胞浓度调整至5×106~10×106个细胞/mL。添加细胞因子如下:第0、4 天:EPO(33.3 ng/mL)+SCF(100 ng/mL)+IL-3(5 ng/mL)。第7 天:EPO(33.3 ng/mL)+SCF(100 ng/mL)。第11、15、18 天:仅添加EPO(33.3 ng/mL)。
1.2.5 脐带血造血干细胞体外生成红细胞体系3 种脱核剂浓度和添加时间的优化选择 PI3K、细胞松弛素B、HDAC2 3 种脱核剂分别设置4 个浓度和添加时间。利用4 因素4 水平的正交设计进行实验分组。在培养期间加入脱核剂时转为6 孔板培养,培养体系为2 mL,细胞数为5.5×105个/孔。设置不加脱核剂孔作为对照组。4 因素为:脱核剂PI3K、HDAC2、松弛素B 和加入脱核剂时间。每个因素有4 个水平:PI3K 浓度为0、20、50、100 ng/mL;HDAC2 浓度为0、60、150、300 ng/mL;松弛素B 浓度为0、25、50、75 ng/μL;加入脱核剂的时间为第7、11、15、18 天。见表1。采用L16(44)正交实验设计表,分成16 组,见表2。以红细胞脱核率为评价指标,考察各个因素对红细胞脱核的影响。
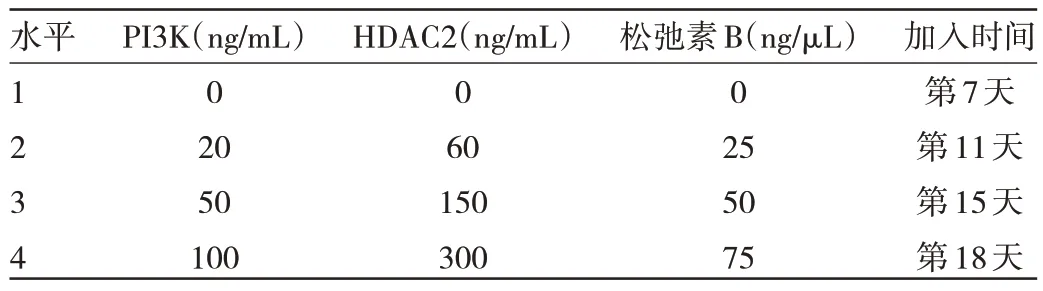
表1 实验因素和水平
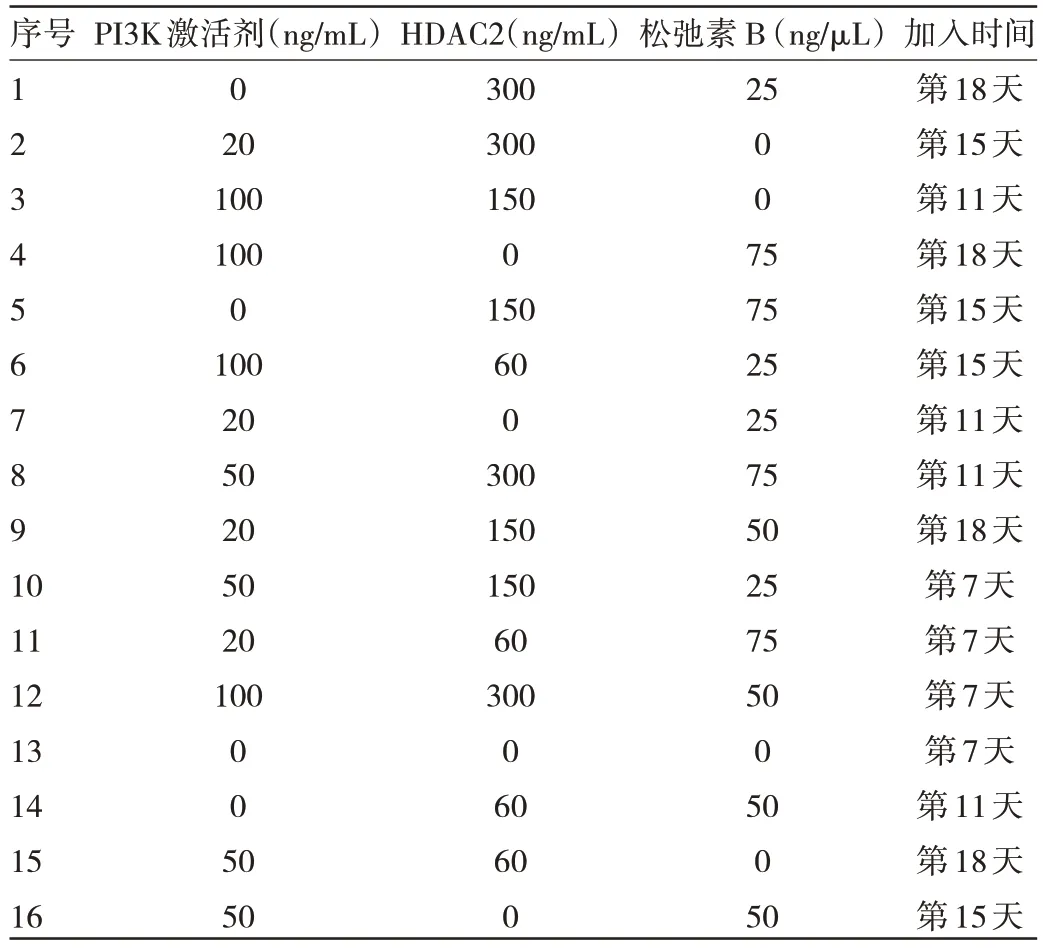
表2 正交实验设计表
1.2.6 优化条件的验证实验 根据正交实验得到的优化条件作为优选组,以不加脱核剂作为对照组,用1.2.4 构建的体系,加入脱核剂,进行脐带血造血干细胞体外生成红细胞培养,评估红细胞脱核的效果。
1.2.7 流式细胞术检测 取50 μL 细胞悬液加入流式管中,加入流式抗体CD235-FITC 2 μL,每106个细胞加入稀释的SYTO-64 核酸染液1 ml(1 μL SYTO-64 核酸原染料加1 mL 0.9%氯化钠稀释),轻微振荡混匀,避光孵育30 min,洗去未结合的荧光抗体后,使用流式细胞仪上机检测和分析。脱核率(%)=SYTO-64-细胞比例/CD235+细胞比例×100%。
1.2.8 细胞染色观察 取10 μL 培养细胞悬液到载玻片上涂开,形成直径1 cm 左右的涂片,自然晾干,瑞氏吉姆萨染色,按试剂盒说明书操作。
1.2.9 细胞电镜检测 对培养的红细胞通过固定、洗涤、染色、脱水、干燥后将样本转移到S-3000N 扫描电子显微镜(日本日立公司)载样台上,喷铂金,电镜检测。
1.2.10 红细胞2,3-DPG 含量检测 采用ELISA 法检测红细胞2,3-DPG,严格按试剂盒说明书操作。取1 mL PBS稀释后的细胞悬液,置-20 ℃冰箱冷冻20 min。取出融化后2 000 r/min 离心20 min,取上清液作为样本。配置标准品。在酶标包被板上分别设空白孔、标准品孔、待测样品孔。加50 μL 样品于酶标板孔底部,37 ℃温育30 min 后,洗板,加酶温育30 min,洗板,显色,加终止液。根据标准品OD 值作出回归曲线,并得出曲线方程,将待测样品的OD 值代入方程,得出相应浓度,再乘以稀释倍数,即得到待测样品细胞内的2,3-DPG 含量。
1.2.11 红细胞ATP 含量检测 采用化学发光法检测,严格按试剂盒说明书操作。用PBS 稀释细胞悬液成1×107/mL。配制标准品,分别设空白孔、标准品孔、待测样品孔。加100 μL 样品,每孔做复孔。每孔加入100 μL celltiter-glo 试剂,室温孵育10 min 稳定荧光信号值。发光检测仪记录发光值。根据标准品发光值作出回归曲线,并得出曲线方程,将待测样品的发光值代入方程,得出待测样品细胞内的ATP 含量。
1.2.12 检测红细胞计数 采用Sysmex xs-900i 血细胞计数仪(日本希森美康公司)测RBC。
1.3 统计学处理 采用SPSS 22.0 统计软件设计正交方案。采用GraphPad Prism 8.0 软件处理验证数据。计量资料以表示,组间比较采用两独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 脐带血造血干细胞体外生成红细胞体系脱核剂浓度和加入时间选择 根据正交设计实验计算出的R值可知,各因素对脱核率的影响大小依次为松弛素B、加脱核剂时间、PI3K、HDAC2,即松弛素B 对脱核率影响最大。通过K值判断,优选条件为第15 天加脱核剂、PI3K 浓度100 ng/mL、HDAC2 浓度150 ng/mL、松弛素B浓度75 ng/μL,以此优选条件作为优选组。见表3。
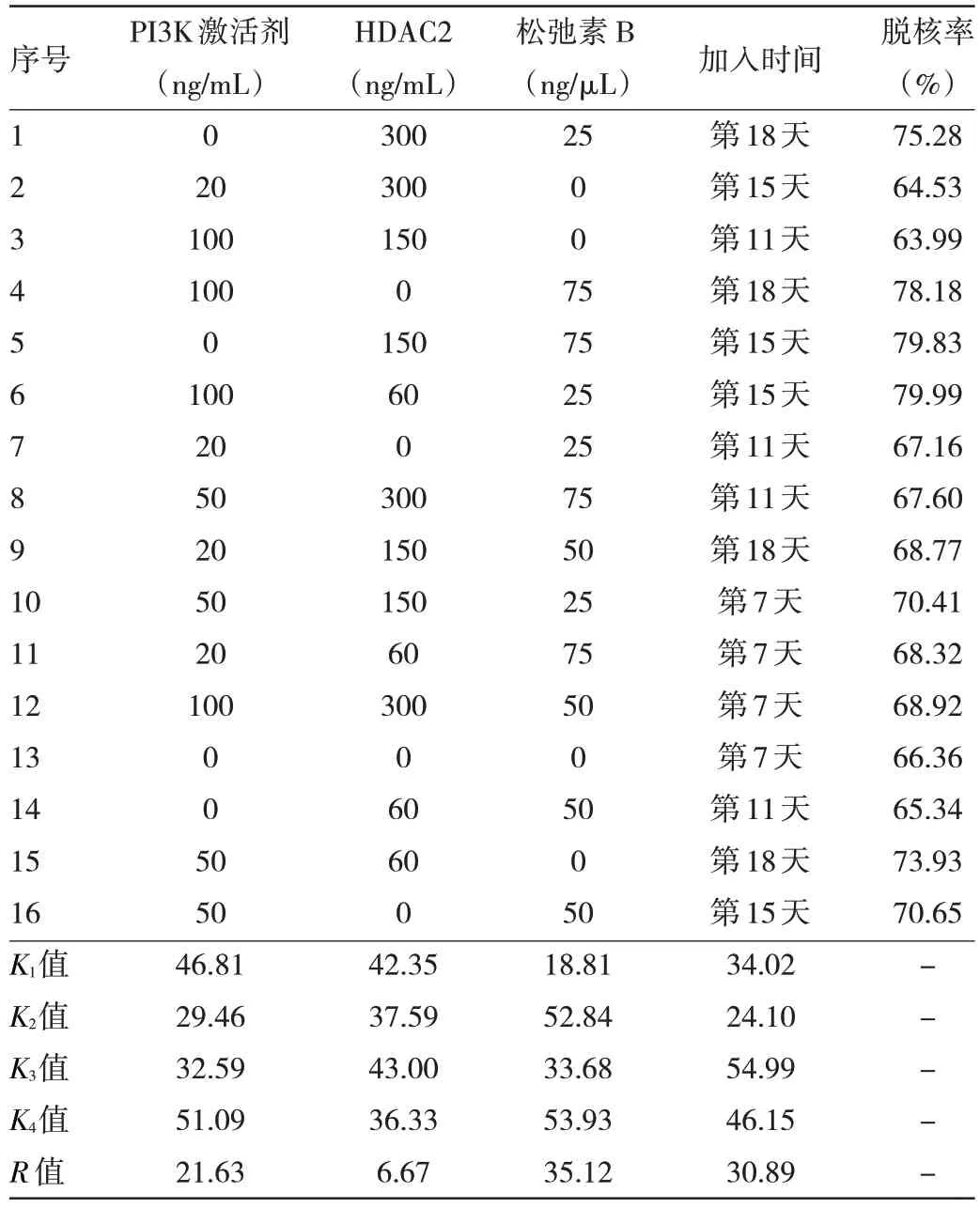
表3 体外生成红细胞体系脱核剂浓度和加入时间
2.2 优选条件的验证实验结果 优选组与对照组CD235+细胞比例比较差异无统计学意义(P>0.05)。优选组SYTO-64-细胞数及脱核率明显高于对照组(均P<0.05)。优先组与对照组红细胞内ATP、2,3-DPG比较差异均无统计学意义(均P>0.05)。按照优选条件培养至第21 天的结果见表4。
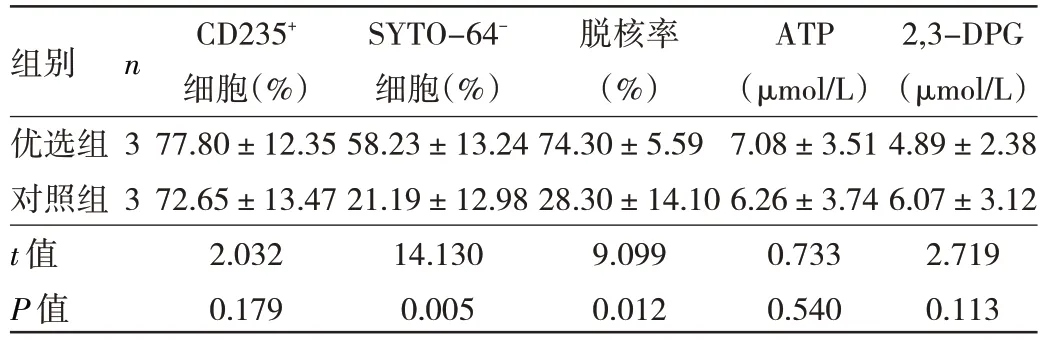
表4 优化条件的验证实验结果
2.3 RBC 和形态分析结果 初始104个CD34+细胞经本实验体系培养后,第21 天RBC 平均可达2×1010/L。培养至第18 天出现成熟无核红细胞,见图1(插页)。
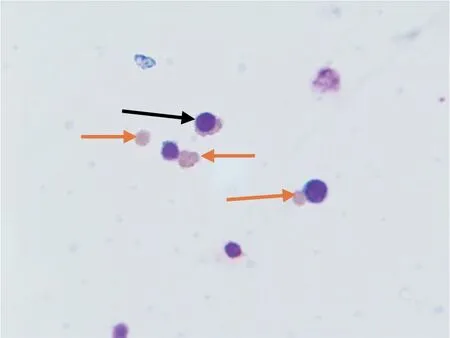
图1 培养至第18 天时细胞形态
2.4 红细胞电镜观察结果 培养第21 天的细胞通过电镜观察可见典型的双凹圆盘状,见图2(插页)。

图2 培养第21 天的红细胞电镜照片
3 讨论
对于严重贫血或需要外科手术输血的患者,红细胞输注是一种成熟且不可替代的治疗方法。然而,全球范围内异体血液供应存在严重紧缺状态,而且异体输血时涉及血液传播疾病以及输血后并发症等问题,因此寻找红细胞的替代来源在血液领域十分迫切和必要[4]。目前,红细胞替代来源的研究主要集中在全氟化碳、Hb 氧载体和干细胞诱导红细胞等方面,其中干细胞诱导生成红细胞是指通过使用胚胎干细胞、诱导多能干细胞或造血干细胞在体外经过一系列诱导分化产生红细胞的过程[5-6]。体外生成红细胞是模拟体内红细胞形成的过程,需要经过脱核步骤才能形成成熟的无核红细胞,脱核过程则是红细胞成熟终末阶段发生的关键事件。在体外培养生成红细胞体系中,脱核效率低下是一个较常见的问题[7-9],目前在诱导干细胞红系分化的体系中,只有在基质细胞的辅助下诱导造血干(祖)细胞才能实现较为高效的成熟和脱核效率,但基质细胞会影响其后续的应用;而无基质细胞体系或是以胚胎干细胞、诱导多能干细胞为起始细胞的诱导体系中,红细胞成熟和脱核效率仍然有待提高。研究表明,在体外条件下通过诱导人胚胎干细胞可以获得脱核红细胞,但是其脱核率在60%左右[10-11];多能干细胞在体外诱导条件下可以获得晚幼红细胞,但是其脱核率仅有4%~10%[12]。因此如何提高体外培养体系红细胞脱核率就显得尤为重要,值得继续深入研究。
早期研究观察到细胞松弛素B 能诱发体外培养的小鼠L 细胞发生脱核作用;随后的研究发现在体外培养的条件下,细胞松弛素B 对人红白血病K562 细胞也有诱导脱核的作用[13-14]。除此之外,研究发现在红细胞脱核的过程中,还有众多的蛋白质及因子参与其中,其中组蛋白去乙酰化酶2 对红细胞的脱核有重要的调控作用[15-17]。使用组蛋白去乙酰化酶抑制剂曲古霉素A 和丙戊酸作用于即将脱核的细胞,能明显地抑制染色体的凝集、肌动蛋白收缩环的形成以及细胞的脱核。Chao 等[18]研究发现当红细胞脱核时,PI3K 的产物磷脂酰二磷酸和磷脂酰三磷酸在细胞膜的胞质侧聚集,抑制PI3K 功能可阻碍细胞极化,导致细胞脱核受阻,提示红细胞去核过程依赖于PI3K 调控的细胞极化。进一步研究发现此过程是由微管介导PI3K 信号通路的活化,引发肌动蛋白的不对称聚集,从而导致细胞极化现象的产生,并且这种现象的产生对下一步细胞核的移位及最终细胞核的排出有重要的意义。
本实验室前期进行了PI3K、细胞松弛素B 和HDAC2 对红细胞脱核作用的单因素分析,结果显示3种因子分别对红细胞脱核均有促进作用,脱核率可达40%~60%,这提示如果3 种脱核剂共同作用或能更好地促进脱核,提高脱核率。因此,本实验设计4 因素4水平正交实验,3 种脱核剂不同浓度、不同加入时间共16 个组合分析脱核效果。实验得出优化条件为第15天加脱核剂,PI3K 浓度为100 ng/mL,HDAC2 浓度为150 ng/mL,松弛素B 浓度为75 ng/μL。并根据此优化条件作为优选组进行验证,结果显示与对照组相比,优选组SYTO-64-细胞数及脱核率明显高于对照组,脱核率达74.30%。而且成熟红细胞形态和功能正常,说明3 种脱核剂存在协同作用,这为体外诱导分化红细胞脱核提供了一种可行的方法。
综上所述,目前有关体外生成红细胞脱核过程的具体机制尚不完全清楚,而干细胞体外生成红细胞过程中红细胞脱核率较低,这已成为体外获取功能性红细胞的主要技术瓶颈之一。尽管本研究提升了红细胞脱核率,但仍不能满足临床需求,今后将进一步研究建立体外生成红细胞高效脱核培养体系,为临床输血提供一种新的来源,有利于提升血液安全。

