五味苦参肠溶胶囊对溃疡性结肠炎大鼠的疗效及作用机制研究
熊加彬 李珍 吴俊俊 李春霞 王宇芳 李华铭
溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病的一种,是以结直肠黏膜连续性、弥漫性炎症改变为特点的慢性非特异性肠道炎症性疾病,病情长期反复发作,严重影响患者的生活质量[1]。临床上,轻度UC 主要以氨基水杨酸类药物治疗,中度及重度UC 以激素、免疫抑制剂及生物制剂等对症治疗为主,且需长期使用药物,不良反应较大,患者经济负担重。因此,进一步探究UC 发病机制,发掘更好的治疗方案有重要的临床意义。近年的临床及实验室研究证实很多中药具有很好的抗炎作用,中医认为UC 归于“泄泻”“痢疾”等范畴[2],中药提取物具有多靶点、多层面作用的优点,从整体上分期辩证治疗是中医药治疗UC的巨大优势。目前临床使用五味苦参肠溶胶囊治疗UC 已经取得较好效果,但其治疗UC 的作用机制尚不明确。基于此,本研究分析五味苦参肠溶胶囊对UC 大鼠血清和组织IL-6、IL-10、黏液蛋白2(mucin2,MUC2)、髓过氧化酶(myelopexoxidase,MPO)水平的影响,探讨该方法治疗UC的可能作用机制,现报道如下。
1 材料和方法
1.1 实验动物 SPF 级纯种Wistar 大鼠40 只[(200±20)g],雌雄各半,由浙江中医药大学动物中心提供,实验饲养室许可证号:SYXK(浙)2021-0003。饲养条件:温度(20~26)℃,湿度50%~60%,每12 h 明暗交替,换风15~20 次/h。本实验经浙江鹰旸医药研发中心实验动物伦理委员会审查通过(批准文号:ZJEY-20220124-04)。
1.2 主要试剂和仪器 五味苦参肠溶胶囊(北京中惠药业有限公司,药物组成:苦参、地榆、青黛、白及、生甘草,含生药0.96 g/粒,批号:Z20150002),美沙拉嗪缓释颗粒剂(葵花药业股份有限公司,批号:H19980148),3%葡聚糖硫酸钠(dextran sulfate sodium,DSS)试剂(美伦生物科技有限公司,批号:J0627C),山羊抗兔IgG 二抗(上海一基生物有限公司,批号:GR2545642-1),MUC2(美国Affinity 抗体公司,批号751C1445),EZ-10Total RNA Mini-Preps Kit 总RNA 小量提取试剂盒(生工生物工程上海股份有限公司,批号:I829KA6099),SYBR Green qPCR 试剂盒(翌圣生物科技上海股份有限公司,批号:H0108041),逆转录试剂盒(江苏康为世纪生物科技股份有限公司,批号:36320),罗氏Light-Cycler 96 实时荧光定量PCR 仪(瑞士罗氏制药公司,型号:LightCycler®96),MPO 测试盒(南京建成生物工程研究所有限公司,批号:20220914),IL-6 ELISA 试剂盒、IL-10 ELISA 试剂盒(泉州市睿信生物科技有限公司,批号:Sep 2022)。
1.3 动物分组与造模 Wistar 大鼠适应性喂养7 d,确定大鼠健康后,采用随机数字表法分为4 组:空白组、模型组、美沙拉嗪组、五味苦参肠溶胶囊组,每组10只。除空白组大鼠给予正常饮食外,其余3 组大鼠给予3%DSS 自由饮用7 d,次日观察大鼠排泄物,大鼠拉稀或排出血便则表明造模成功。
1.4 干预方法 确定大鼠造模成功后,各组大鼠予常规饲料和饮水,保证大鼠生活环境通风及清洁。造模后第4 天,五味苦参肠溶胶囊组大鼠予以配制五味苦参肠溶胶囊药物颗粒悬浊液2 mL(以成人剂量换算为大鼠剂量432 mg/kg 体质量)灌胃,美沙拉嗪组大鼠以配制的美沙拉嗪悬浊液2 mL(以成人剂量换算为大鼠剂量200 mg/kg 体质量)灌胃,空白组、模型组予0.9%氯化钠溶液2 mL 灌胃,1 次/d,连续2 周。
1.5 检测指标及方法
1.5.1 一般状态及疾病活动指数(disease activity index,DAI)评分 每日上午10:00 观察各组大鼠精神、活动、皮毛、饮食、饮水情况,并记录大鼠体重、粪便性状及便血情况,称体质量并记录,进行DAI 评分。DAI评分=体质量下降评分+大便性状评分+便血评分,各评分标准见表1。

表1 DAI 评分标准
1.5.2 结肠黏膜大体形态损伤指数(colon mucosa damage index,CMDI)评分 大鼠连续灌胃2 周后禁食1 d,二氧化碳吸入法安乐死,分离并切取结肠,沿肠系膜纵行剪开,用0.9%氯化钠溶液冲洗干净,观察结肠黏膜大体损伤情况和评分,取2 块病变结肠组织,用0.9%氯化钠溶液冲洗干净,取中段长约0.5 cm 的结肠组织,置入4%多聚甲醛溶液中固定,肉眼观察黏膜损伤情况,CMDI 评分标准见表2。

表2 CMDI 评分标准
1.5.3 血清IL-6、IL-10 水平及结肠组织IL-6、IL-10 mRNA 表达水平检测 大鼠安乐死后立即从腹主动脉取血,采用ELISA 法检测各组大鼠血清IL-6、IL-10 水平,按试剂盒说明书操作。取结肠组织,采用qRTPCR 法检测结肠组织IL-6、IL-10 mRNA 表达水平。qRT-PCR 引物见表3,按试剂盒说明书操作。
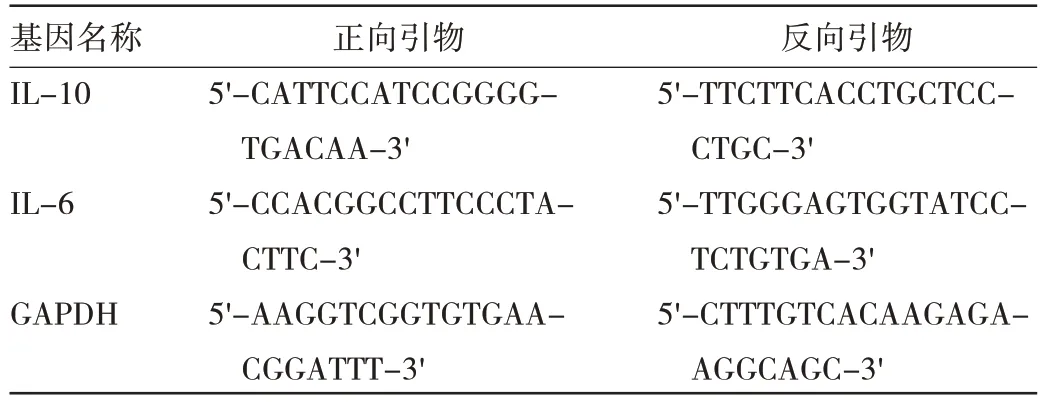
表3 qRT-PCR 引物
1.5.4 结肠组织MUC2 表达情况检测 将固定后的结肠组织石蜡包埋、切片,采用免疫组化染色法,显微镜下观察结肠组织MUC2 表达情况。采用K-Viewer 病理分析软件及Image-Pro Plus 6.0 管理系统采集和处理图像,进行半定量分析;用计算机IPP 6.0 系统测量出每个样本累积光密度(IOD 值)和Area 值(200 倍视野下样品面积),计算IOD/Area 比值作为相对半定量分析指标(AOD 值)。
1.5.5 结肠组织MPO 活性检测 采用髓过氧化物酶比色法,称取各组大鼠结肠组织约100 mg,按重量体积比为1∶19 加匀浆介质制备成5%的组织匀浆,60 ℃水浴10 min,取出后立即置于460 nm 处,1 cm 光径,双蒸水调零,紫外可见分光光度计测定各管吸光度值,检测各组织MPO 活性。
1.6 统计学处理 采用SPSS 25.0 统计软件。计量资料以表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验。非正态分布的计量资料以M(P25,P75)表示,组间比较采用秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 4 组大鼠给药干预期间一般状态及DAI 评分比较 在给药干预期间,4 组大鼠的毛发状态、饮食情况、活动情况、精神状态均正常,4组大鼠体质量比较差异均无统计学意义(均P>0.05),见图1;给药干预第14 天,与模型组比较,美沙拉嗪组与五味苦参肠溶胶囊组大鼠DAI 评分均明显降低(均P<0.05),见图2。

图1 4 组大鼠给药干预期间体质量比较
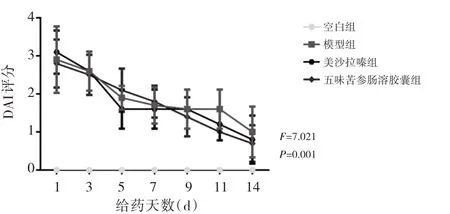
图2 4 组大鼠给药干预期间DAI 评分情况比较
2.2 4 组大鼠结肠黏膜组织损伤情况比较 模型组大鼠结肠黏膜明显充血、水肿,五味苦参肠溶胶囊组、美沙拉嗪组大鼠结肠黏膜充血、水肿均明显减轻,见图3(插页)。4 组大鼠CMDI 评分分别为0、1.50±0.21、0.70±0.17、0.50±0.13 分,4 组比较差异有统计学意义(F=12.622,P<0.001)。与空白组相比,模型组大鼠CMDI 评分升高(P<0.05);与模型组相比,美沙拉嗪组和五味苦参肠溶胶囊组大鼠CMDI 评分均降低(均P<0.05)。
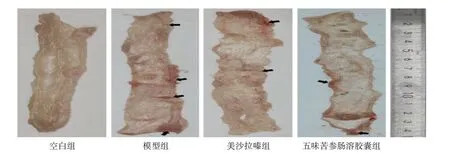
图3 4 组大鼠结肠黏膜形态
2.3 4 组大鼠血清IL-6、IL-10 水平及结肠组织IL-6、IL-10 mRNA 表达水平比较 4 组大鼠血清IL-6、IL-10 水平及结肠组织IL-6、IL-10 mRNA 表达水平比较差异均有统计学意义(均P<0.05)。与空白组比较,模型组大鼠血清IL-6 水平与结肠组织IL-6 mRNA 表达水平均升高(均P<0.05),血清IL-10 水平与结肠组织IL-6 mRNA 表达水平均降低(均P<0.05);与模型组比较,美沙拉嗪组和五味苦参肠溶胶囊组大鼠血清IL-6 水平与结肠组织IL-6 mRNA 表达水平均降低(均P<0.05),血清IL-10 水平与结肠组织IL-6 mRNA 表达水平均升高(均P<0.05)。见表4。
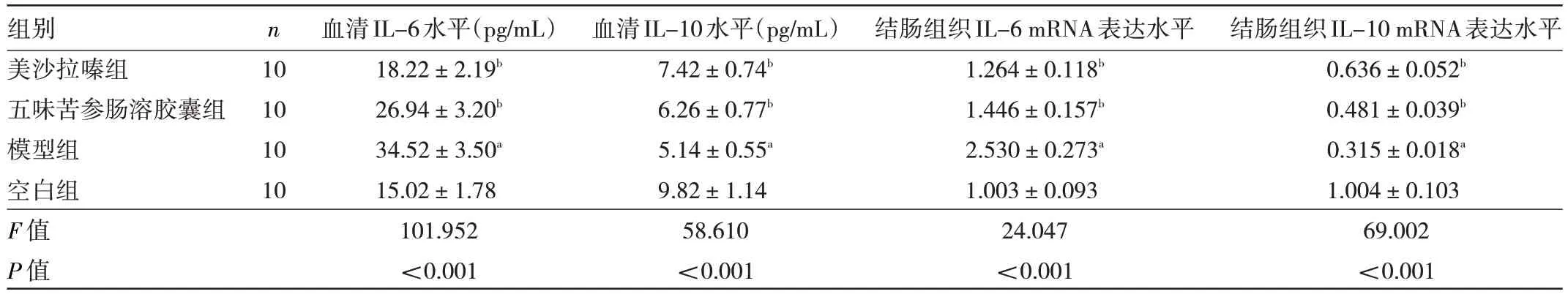
表4 4 组大鼠血清IL-6、IL-10 水平及结肠组织IL-6、IL-10 mRNA 表达水平比较
2.4 4 组大鼠结肠组织MUC2 表达情况比较 4 组大鼠结肠组织MUC2 表达的AOD 值分别为0.50±0.04、0.26±0.03、0.40±0.05、0.46±0.03,4 组比较差异有统计学意义(F=22.211,P<0.001)。与空白组比较,模型组大鼠结肠组织MUC2 表达下调(P<0.05);与模型组比较,美沙拉嗪组和五味苦参肠溶胶囊组大鼠结肠组织MUC2 表达均上调(均P<0.05)。见图4(插页)。
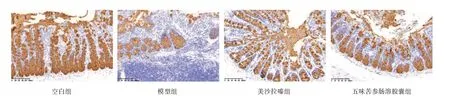
图4 4 组大鼠结肠组织MUC2 表达情况镜下所见
2.5 4 组大鼠结肠组织MPO 活性比较 4 组大鼠结肠组织MPO 活性分别为0(0,0)、1(1,2)、1(1,2)、0.5(0,1),4 组比较差异有统计学意义(F=40.361,P<0.001)。与空白组比较,模型组大鼠结肠组织MPO 活性升高(P<0.05);与模型组比较,美沙拉嗪组和五味苦参肠溶胶囊组大鼠结肠组织MPO 活性均降低(均P<0.05)。
3 讨论
UC 病因与发病机制较为复杂,多数观点认为是由于遗传-环境等因素共同作用引起黏膜屏障缺失、免疫反应失调,从而维持和促进炎症反应[3]。肠道黏膜屏障破坏在UC 发展中起决定性作用,是UC 患者预后的敏感指标[4-5]。黏液层隔离肠黏膜细胞与肠腔,保护肠黏膜细胞免受细菌及其代谢产物、食物抗原等接触和刺激,由多种核心蛋白组成,其中最为重要是杯状细胞分泌的MUC2。该蛋白缺失会增加肠黏膜细胞通透性,肠腔内细菌和抗原等进入诱导级联免疫反应,进一步增加肠道屏障损伤[6]。本实验研究发现UC 大鼠结肠组织MUC2 表达下调。这与黄强等[7]研究结果相符,但机制尚不明确。
周钰艳[8]研究肠黏膜胶质细胞对UC 患者杯状细胞合成分泌MUC2 的影响,发现活动期UC 的结肠黏膜MUC2 的减少与黏膜胶质纤维酸性蛋白表达增加呈正相关,黏膜胶质纤维酸性蛋白表达增加促进肠黏膜胶质细胞胶质网络形成,通过Toll 样受体4 通路影响MUC2 蛋白表达。本研究发现,美沙拉嗪组和五味苦参肠溶胶囊组大鼠结肠组织MUC2 表达上调,其作用机制可在今后的科研工作中进一步探讨。
结肠黏膜及黏膜下层炎症是UC 患者的主要病理特点,炎性标志物检测有助于评估肠道炎症程度,从而指导诊断、治疗及效果评估[9]。细胞因子是炎症标志物之一,是重要炎症介质和免疫调节因子,IL 是参与免疫系统调节的细胞因子,分为促炎细胞因子和抗炎细胞因子,IL-10 是多细胞因子,主要通过下调组织相容性复合物-Ⅱ类分子及刺激分子CD80 和CD86 表达来阻碍抗原呈递,同时能拮抗促炎因子分泌,抑制免疫反应[10]。IL-6 属于促炎细胞因子,炎症反应关键调节剂,主要通过与靶细胞表面IL-6 受体结合形成复合物,调控炎症因子表达[11]。刘竺华等[12]与刘景鸿等[13]分别研究敛疮生肌灌肠疗法、白黎芦醇对UC 大鼠炎症反应的影响,结果发现通过调控TLR4/NF-kB 通路升高血清IL-10 水平同时降低IL-6 水平可减轻UC 大鼠肠道炎症反应。本研究结果显示,五味苦参肠溶胶囊组与模型组相比,血清IL-6 水平及结肠组织IL-6 mRNA 表达水平降低,同时血清IL-10 水平及结肠组织IL-10 mRNA 表达水平升高。这表明五味苦参肠溶胶囊降低UC 大鼠结肠黏膜炎性因子的表达,抑制炎症瀑布样反应,促进黏膜修复。
既往研究发现,UC 患者结肠黏膜病理组织有大量中性粒细胞渗入,且与隐窝脓肿形成相关,其中MPO由中性粒细胞分泌,其活性反映中性粒细胞浸润的程度,间接反应肠道炎症,中性粒细胞富集主要通过Janus 酪氨酸蛋白激酶/信号转导及转录激活因子通路,并且可促进UC 发展为结肠癌[14]。冯云等[15]研究发现UC 患者病情严重程度与MPO 表达呈正相关。本研究结果显示,与模型组比较,五味苦参肠溶胶囊组结肠组织中MPO 活性显著降低,此与Zhao 等[16]研究结果相符。上述结果说明了五味苦参肠溶胶囊能够明显减少UC 大鼠结肠黏膜炎症细胞浸润,可能具有抗感染作用。
现代中医认为湿热是UC 疾病活动及反复发作的重要病理因素,清肠化湿是治疗基础[17]。中医基于“整体观念”和“辨证论治”的个体化治疗原则在治疗UC方面发挥了重要作用。此外,中医药治疗UC 有疗效显著、复发率低、不良反应少等优点,包括中药方剂、单味中药提取物等,如大黄素、姜黄素、忍冬素、黄连素等。五味苦参肠溶胶囊为中药复合制剂,由苦参、地榆、青黛、白及、甘草组方,以苦参为君药,可清热燥湿、止血止痢。Yao 等[18]研究发现苦参碱有抗炎和调节肠道菌群的作用,可改善3% DSS 诱导的结肠炎;地榆入大肠、肝经,可凉血止血、解毒敛疮。朱阳青[19]研究表明地榆能降低DAI 评分,同时具有收敛、杀菌、抗炎等作用,青黛与地榆同用,可增强其清热解毒、凉血止血之效,乃臣药。Xie 等[20]研究发现青黛能改善DSS诱导的UC 大鼠的体重减轻,还可通过调节肠道微生态改善结肠炎,白及有收敛止血、消肿生机之效,佐助君臣药。Gong 等[21]研究白及可降低炎症反应,生甘草可调和诸药,清热解毒,并缓急止痛。Kong 等[22]研究甘草可能是通过激活核因子E2 相关因子2/PTEN 诱导假定激酶1 途径促进线粒体自噬降低UC 小鼠的炎症因子和氧化应激水平。刁凌云等[23]研究发现单用五味苦参肠溶胶囊可改善UC 患者临床症状。上述多项临床及实验研究表明五味苦参肠溶胶囊治疗UC 有较好疗效,但主要集中在对受体表达、炎症因子水平等机制方面的研究。
综上所述,本研究发现五味苦参肠溶胶囊能够明显改善UC 大鼠DAI 及CDMI 评分,降低促炎因子IL-6水平,升高抗炎因子IL-10 水平,上调UC 大鼠MUC2 的表达,同时降低MPO 活性,促进UC 大鼠肠道黏膜屏障修复,快速缓解UC 大鼠炎症反应。这为五味苦参肠溶胶囊临床治疗UC 提供理论参考,并为进一步研究五味苦参肠溶胶囊治疗UC的作用机制提供实验基础。

